耐镉细菌的分离及其对土壤中镉的形态影响
2018-03-14刘玉玲铁柏清李园星露魏祥东叶长城刘孝利
刘玉玲 ,铁柏清 *,李园星露 ,魏祥东 ,彭 鸥 ,叶长城 ,刘孝利 ,孙 健
(1.湖南农业大学资源环境学院,长沙 410128;2.湖南省重金属污染耕地安全高效利用工程研究中心,长沙 410013;3.广东工业大学环境科学与工程学院,广州 510006)
重金属镉(Cd)因移动性大、毒性高、污染面积较广被称为“五毒之首”[1]。21世纪以来,随着工业飞速发展,矿产累年采冶,导致农田Cd污染日趋严重[2]。我国受Cd污染地区已涉及11个省(市)的25个地区[3]。目前对受重金属污染的土壤修复,主要采用的技术方法有化学修复、物理修复、生物修复和微生物修复[4]。微生物作为土壤中的活性胶体,具有比表面积大、带电荷、代谢活动旺盛、种类繁多、数量大等特点,有的土壤微生物不仅参与土壤中污染物的循环过程,还可作为环境载体吸附重金属污染物[5]。由于微生物对重金属具有积累、吸附和解毒作用,土壤重金属污染微生物处理技术的发展及应用受到广泛关注。Francesca等[6]研究发现硫酸盐还原菌对Cd的生物吸附去除率达到77%。晋银佳等[7]证实荧光假单胞菌菌体代谢能够产生铁载体,铁载体能够与Cd2+络合,使得油麦菜对Cd的吸收减少,其中采用砂基方式培养的油麦菜Cd含量降幅最高达50.74%。
Delftia菌属是1999年由Wen等[8]发现的一个新菌属,目前对该类菌的研究主要集中于对有机污染物的去除能力上,如 Zhang 等[9]、梁泉峰[10]、Xiao 等[11]研究发现Delftia能够高效降解苯胺并分析了其降解的相关基因和降解途径。González等[12]发现 Delftia sp.能降解 2,4-D,在 2,4-D 初始浓度为 100 mg·L-1时,降解率达到99.9%。叶杰旭等[13]发现Delftia能以氯苯为唯一碳源和能源,并且能够降解氯苯。对于Delftia修复重金属污染土壤的研究较少,Prakash等[14]报道了D.tsuruhatensisAR-7可以通过胞内积累或细胞膜吸附将 Se4+转化为 Se0,Caravaglia 等[15]、Morel等[16]和Ubalde等[17]报道了Cr(Ⅵ)抗性菌 D.acidovorans AR 和 Delftia sp.JD2对Cr(Ⅵ)的生物转化,其可将Cr(Ⅵ)还原成毒性较低的Cr(Ⅲ)。目前还没有Delftia对于Cd污染土壤修复方面的报道。
土壤中重金属以各种不同的形态存在,重金属的不同形态具有不同的化学活性和生物有效性,重金属形态分布在一定程度上可以反映重金属的生物有效性和毒性变化,重金属的形态及其转化对研究重金属的环境效益及重金属污染治理修复具有重要意义[18-19]。目前,关于微生物-土壤重金属形态的研究较少,本研究通过从矿区镉污染土壤中筛选分离的耐Cd细菌,探究目标菌株对土壤中Cd形态分布的影响,以期为重金属污染土壤微生物修复提供理论依据和数据支持。

表1 土壤理化性质Table1 Soil physical and chemical properties
1 材料与方法
1.1 供试土壤
供试土壤采自湖南省株洲市霞湾地区某冶炼厂周边受重金属污染的0~20 cm土层土壤,为偏中性紫砂土。由表1可知,重金属含量普遍较高,与国家土壤环境质量三级标准(为保障农林生产和植物正常生长的土壤临界值)相比,Pb、Zn、Cu、Cd的含量分别为国家土壤环境质量三级标准的 2.71、10.06、15.61、174.87倍,其中Cd超标最为严重。
1.2 耐Cd菌株的筛选
培养基:牛肉膏3 g、蛋白胨10 g、氯化钠 5 g、琼脂 15~20 g、蒸馏水 1 L,pH 7.2~7.4。121 ℃高压灭菌锅灭菌30 min。液体培养基不加琼脂。
称取5 g土样,加入到45 mL已灭菌并装有玻璃珠的液体培养基(Cd2+含量 50 mg·L-1)中,30 ℃、150 r·min-1振荡培养,4 d为一个周期,一个周期结束后以10%(V/V)的接种量转接入新鲜的液体培养基(Cd2+含量 100 mg·L-1)中,150 r·min-1继续振荡培养一个周期,再转接4次,至液体培养基中的Cd2+浓度增加到300 mg·L-1。取最后一次富集培养液 0.2 mL,以 10 倍比稀释法稀释后涂布于分离纯化培养基平板上,并在30℃的恒温培养箱中倒置培养48~96 h。肉眼观察菌落生长情况,并分别挑选不同形态的典型单菌落,在新的分离纯化培养基平板上继续划线分离,直到培养出菌落特征一致的纯菌种。然后将纯菌种接种到含Cd2+的液体培养基中振荡培养,观察菌株生长情况,选择生长较好的菌株保存并进行吸附试验。取1 mL菌液接入50 mL已灭菌的液体培养基中,培养基含Cd2+浓度为 10 mg·L-1和 100 mg·L-1,在 30 ℃下振荡培养24 h后,取25 mL培养液于13 000 r·min-1离心15 min,取上清液测定Cd2+浓度,并筛选Cd2+吸附率最高的菌株,即为目标菌株进行后续研究。
1.3 目标菌株鉴定
菌株的形态及生理生化鉴定:观察菌株的形态特征并根据菌株的形态特征,按照《常见细菌系统鉴定手册》对分离纯化的细菌进行鉴定。
菌株16S rRNA的扩增和鉴定:将1.2中筛选出的目标菌株培养至对数期,取适量的菌体到30 μL无菌水中,98 ℃热解 20 min 后,4000 r·min-1离心 1 min。取1 μL上清液作为模板DNA,用于PCR扩增。用细菌 16S rRNA 通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′和 1492R:5′-TACGGCTACCTTGTTACGACTT-3′)来进行PCR扩增。扩增产物由湖南擎科生物技术有限公司进行测序。
1.4 目标菌株的生长曲线
将目标菌株接种在液体培养基中,30℃、120 r·min-1培养24 h,以2%的接种量接入新的Cd2+浓度为0(CK)、10、100 mg·L-1培养基中,在 0~54 h 周期里,以3 h为时间间隔取样,于600 nm下测定不同浓度下的生长曲线。
1.5 不同培养条件对菌株去除Cd2+效果的影响
1.5.1 菌体的制备
将目标菌株接种在液体培养基中30℃、120 r·min-1培养24 h,用无菌水洗涤两次后制成OD600=1.6(7.6×108cfu·mL-1)的菌悬液。
1.5.2 pH对目标菌株吸附Cd2+的影响
将50 mL含10 mg·L-1Cd2+的培养液pH分别调至5.0、6.0、7.0、8.0、9.0,每个 pH 值设置 3 个重复,灭菌后对培养液的pH进行测定,并做相应校正。按2%接种量分别接入菌悬液,30 ℃、120 r·min-1振荡培养 48 h,13 000 r·min-1离心 5 min,采用 ICP-OES 测定上清液Cd2+的浓度,计算目标菌株对Cd2+的吸附量和吸附率。
1.5.3 培养温度对目标菌株吸附Cd2+的影响
将 50 mL含 10 mg·L-1Cd2+的培养液 pH 调为7.0,灭菌后按2%的接种量接入菌悬液,分别于10、20、30、35、40 ℃下 120 r·min-1振荡培养 48 h,测定方法同1.5.2。
1.5.4 培养时间对目标菌株吸附Cd2+的影响
将 50 mL含 10 mg·L-1Cd2+的培养液 pH 调为7.0,灭菌后按2%的接种量接入菌悬液,于30℃、120 r·min-1分别振荡培养 18、24、36、48、72 h,测定方法同1.5.2。
1.5.5 Cd2+浓度对目标菌株吸附Cd2+的影响
分别配制 Cd2+浓度为 1、5、10、50、100 mg·L-1的培养液,pH调为7.0,灭菌后按2%的接种量接入菌悬液,于 30 ℃、120 r·min-1振荡培养 48 h,测定方法同1.5.2。
1.6 菌株对土壤Cd形态的影响
试验用土先经过阳光曝晒后过2 mm筛,试验用塑料小盆钵的上缘直径10 cm,底面直径9 cm,高14 cm。每盆装土150 g(以风干土计)。将菌株培养48 h后接种 3 mL(T1,接种量为 1.44×1011cfus)和 10 mL(T2,接种量为 4.8×1011cfus)到土壤中,加蒸馏水使土壤含水量保持田间持水量的60%。以不加菌的为对照(CK),分别于接种后 0、5、10、20、30 d 取鲜土样 10 g测定土壤Cd的形态。
1.7 分析方法
Cd的形态分析采用BCR法[20],用ICP-OES(美国PE8300)测定其Cd的浓度。BCR提取法:(1)用40 mL 0.11 mol·L-1的醋酸(HOAc)在室温(22±5)℃下提取弱酸可溶态 Cd;(2)用 40 mL 0.5 mol·L-1盐酸羟胺(pH=2.0)在室温(22±5)℃下提取可还原态 Cd;(3)加入 10 mL 8.8 mol·L-1H2O2(pH=2~3)溶液,先在室温(22±5)℃下反应 1 h,间歇振荡,然后在(85±2)°C 水浴反应1 h,取下盖子继续水浴加热使其体积至3 mL;再向其中加入10 mL 8.8 mol·L-1H2O2(pH=2~3)溶液,85±2°C水浴反应1 h,继续水浴加热使其体积小于1 mL。冷却后加入50 mL 1 mol·L-1NH4OAc提取可氧化态Cd;(4)残渣态Cd提取采用全消解处理,消解步骤同土壤全量消解。
1.8 数据处理
图表处理运用Microsoft Excel软件;多重差异显著性分析运用IBM SPSS Statistics 22.0软件。计算公式:吸附率=(初始浓度-终浓度)/初始浓度×100%。
2 结果与分析
2.1 耐Cd菌株的分离与鉴定
供试土壤样品经梯度富集培养后,分离纯化得到生长良好的耐Cd菌株12株,其中细菌9株,真菌3株,分别命名为 B1~B9 和 F1~F3(表 2)。从表 2 可以看出,当液体培养基中Cd2+初始浓度为10 mg·L-1时,B9的吸附率最高,为65.64%,其次为B2,吸附率为47.14%,其他菌株的吸附率在7.78%~30.27%之间。当液体培养基中Cd2+初始浓度为100 mg·L-1时,各菌株Cd2+的吸附率均低于初始浓度10 mg·L-1。其中B9的Cd2+吸附率最高,为 44.30%,其次为 B2(26.02%),其他菌株的Cd2+吸附率均较低,在5%左右。根据本实验的目的,选取Cd2+吸附率最高的B9菌株进行深入研究。
菌株B9菌落为黄色,呈圆形,有凸起,边缘平整,光滑湿润(图1a),扫描电镜下菌体呈杆状(图1b)。葡萄糖发酵试验、柠檬酸盐试验为阳性,淀粉水解试验、明胶水解试验、吲哚试验、V-P试验为阴性,革兰氏染色阴性,全部与D.acidovorans生理生化特征一致。16S rRNA序列比对结果表明,B9与D.acidovorans的序列具有99%的同源性(图1c),结合菌株形态观察、生理生化试验,可以确定目标菌株为Delftia sp.,基因登录号为MF679148。
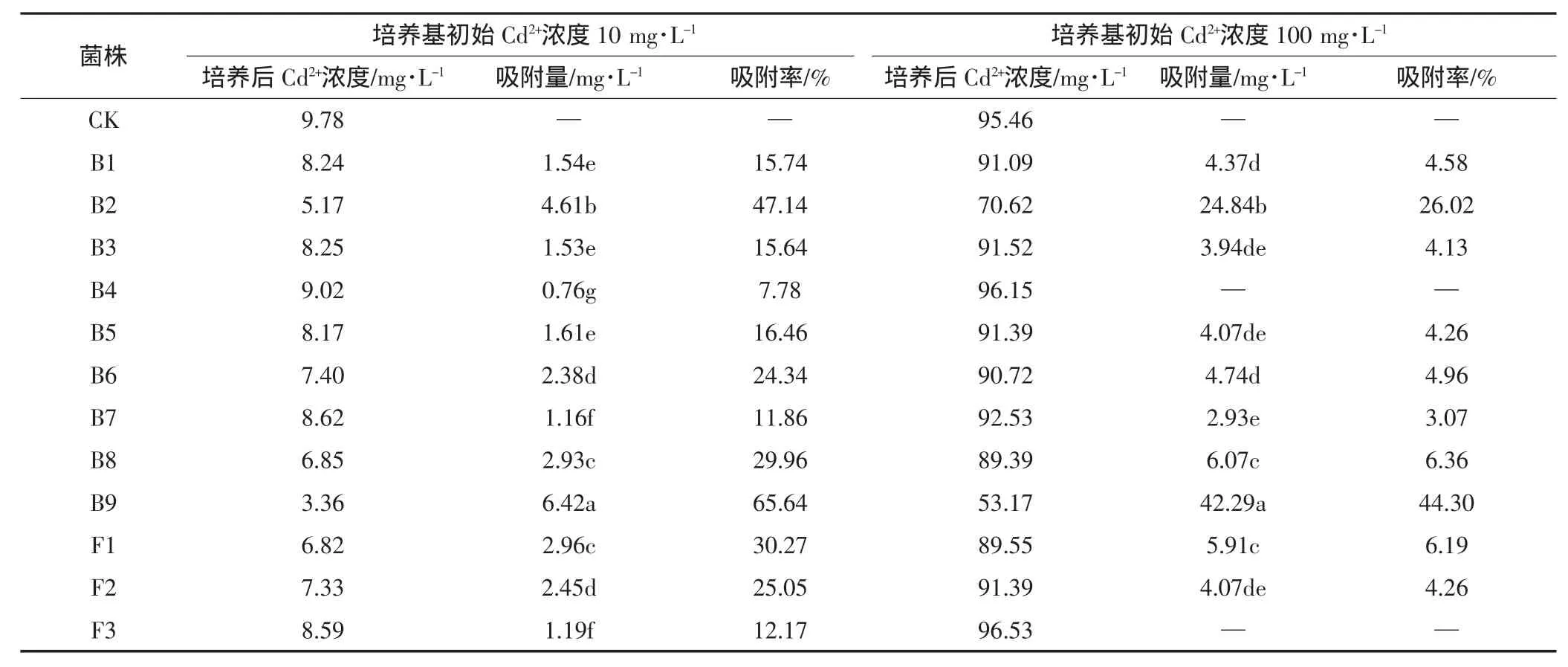
表2 耐Cd菌株处理后液体培养基中Cd浓度的变化Table2 Variation of cadmium concentration in medium after treatment with cadmium-resistant bacteria
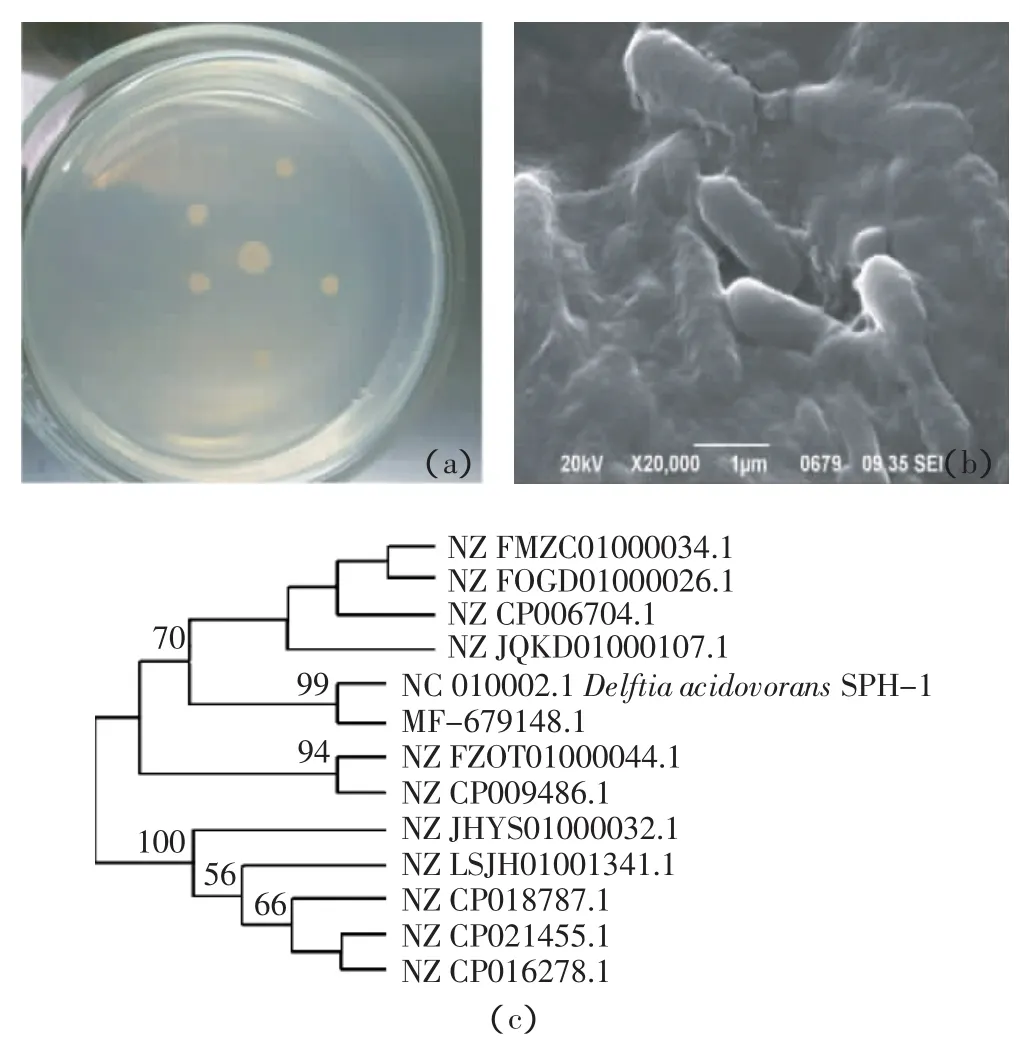
图1 菌株B9的形态学特征(a)、扫描电镜图(b)及其16S rRNA基因序列的系统进化树分析(c)Figure1 Morphological characteristic(a),scanning electron microscopy image(b)and the phylogenetic tree of 16S rRNA(c)of strain B9
2.2 不同Cd2+浓度下的生长曲线
图2是 Cd2+浓度分别为 0、10、100 mg·L-1下,培养54 h后菌株B9的生长曲线。由图2可见,Cd2+浓度为10 mg·L-1时B9对数期后的生长量降低,与CK都是在培养的36 h进入稳定期。Cd2+浓度为100 mg·L-1时延长了B9生长的延滞期,B9延迟12 h后进入对数期,且进入对数期后生长量降低,进入稳定期后OD600在2.5左右,表明B9对Cd2+有较强的耐受性。
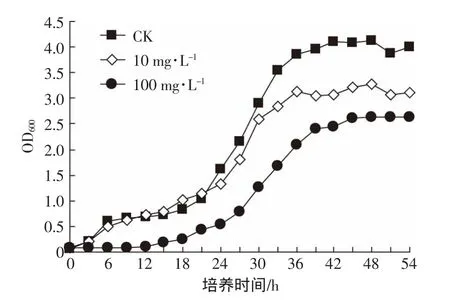
图2 菌株B9生长曲线Figure2 Growth curve of strain B9
2.3 不同培养条件对目标菌株B9去除Cd2+效果的影响
由图3a可见,在培养温度为30℃、Cd2+初始浓度为 10 mg·L-1时,当 pH 值从 5 增加到 8,B9 对 Cd2+的吸附量和吸附率均显著增加;当pH=8时,Cd2+的吸附量和吸附率达到最大值6.73 mg·L-1和69.85%;当pH值继续增加时,B9对Cd2+的吸附量和吸附率均明显降低。当pH=9时,B9对Cd2+的吸附率为42.39%,比pH=8 低 2.64 mg·L-1。可见,pH 是影响 B9 吸附 Cd2+的一个因素。根据实验结果可知,B9在pH=8的环境中对Cd2+的吸附效果最好。
由图3b可见,在培养温度为30℃、pH=7、Cd2+初始浓度为 10 mg·L-1时,0~48 h 时,B9 随着培养时间的增加对Cd2+的吸附量和吸附率显著增加,到48 h时Cd2+的吸附量和吸附率达到最大值8.13 mg·L-1和84.37%;培养时间达到72 h时,吸附量比48 h时有所减少,但差异不显著。
由图 3c可见,在 pH=7、Cd2+初始浓度为 10 mg·L-1时,当温度从10℃增加到30℃,B9对Cd2+的吸附量和吸附率均显著增加;当温度从30℃增加到40℃,两者吸附量和吸附率均没有显著差异,均保持在较高的水平,吸附量在8 mg·L-1以上,吸附率在85%以上。
由图3d可见,在培养温度为30℃、pH=7、Cd2+初始浓度在10 mg·L-1以下时,吸附率都在60%以上,浓度越低吸附率越高,初始Cd2+浓度为1 mg·L-1时,吸附率达到87.07%;初始Cd2+浓度为50 mg·L-1时,吸附率下降到31.8%。而B9对Cd2+的吸附量随着Cd2+浓度的增加而不断增加,B9对Cd2+吸附量从0.85 mg·L-1增加到 31.28 mg·L-1。
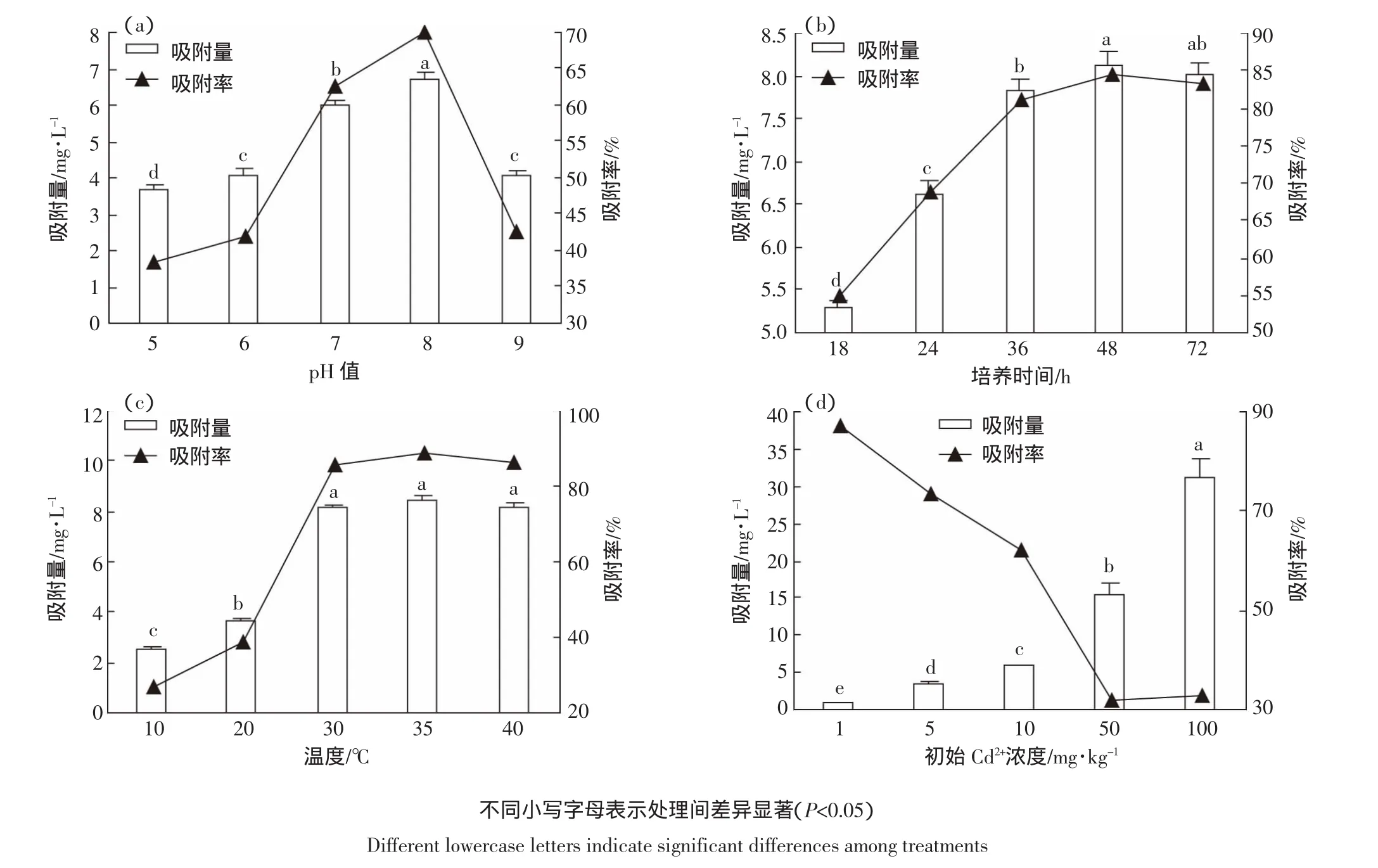
图3 不同培养条件对菌株B9吸附Cd2+效果的影响Figure3 Influence of different culture conditions on the adsorption rate of Cd from strain B9
2.4 菌株B9对土壤Cd形态的影响
添加菌株B9后土壤弱酸可溶态Cd的含量随着培养时间的增加呈现出先减少后趋于平缓的趋势。土壤培养至第10 d时,T1(添加3 mL菌悬液)和T2(添加10 mL菌悬液)处理土壤样品中弱酸可溶态Cd的含量均显著减少,分别减少44.40 mg·kg-1和45.33 mg·kg-1(表3);在培养的第10 d到第30 d,T1、T2土壤样品的弱酸可溶态Cd的含量随着时间的推移有所变化,但没有出现显著差异。T1、T2处理与CK相比,在培养的30 d内弱酸可溶态Cd的含量均具有显著性差异,T1与T2两个处理之间除了第30 d,其他时间无显著差异,因此添加菌株B9对土壤中弱酸可溶态Cd含量影响较大,B9两种不同添加量影响较小。
添加菌株B9后,CK处理中可还原态Cd含量随着培养时间的增加呈现出先减少后增加的趋势(表3),培养至第 10d 可还原态 Cd 含量减少 2.89 mg·kg-1;第10 d到第30 d内可还原态Cd含量增加14.72 mg·kg-1,这可能与培养时保持加水有关。T1和T2处理中可还原态Cd含量随培养时间的增加呈现出先增加后趋于稳定的趋势,T1、T2处理培养到第10 d时,可还原态Cd含量均显著增加,比开始土壤样品的可还原态 Cd 含量分别增加 13.71、17.60 mg·kg-1;T1在培养的第10 d到第30 d土壤中可还原态Cd含量虽有所变化,但没有显著性差异,培养至第30 d时,比开始增加了15.17 mg·kg-1。T2在培养的第10 d到第20 d土壤中可还原态Cd含量虽有所变化,但与第10 d相比,没有显著差异;培养到第30 d时,可还原态Cd含量上升到 38.06 mg·kg-1,比开始增加了 20.69 mg·kg-1。T1、T2和CK三个处理之间在培养的30 d内可还原态Cd的含量均具有显著性差异,因此,添加菌株B9及其添加量对土壤中可还原态Cd含量影响均较大。
添加菌株B9后,CK、T1和T2三个处理可氧化态Cd含量随着培养时间的增加均呈现出减少的趋势(表3)。CK处理的可氧化态Cd在培养的前5 d内显著减少,之后含量虽然有变化,但差异不显著,培养至第 30 d 时,比开始减少了 1.81 mg·kg-1。T1处理在培养前10 d内可氧化态Cd含量显著减少,减少量为2.44 mg·kg-1;培养的第 10 d 到第 30 d 差异不显著。T2处理在培养的第30 d比开始时可氧化态Cd含量显著减少,减少量为 1.08 mg·kg-1。T1、T2和 CK 三个处理之间在培养的30 d内可氧化态Cd的含量均无显著性差异,因此,添加菌株B9及其添加量对土壤中可氧化态Cd含量没有显著影响。
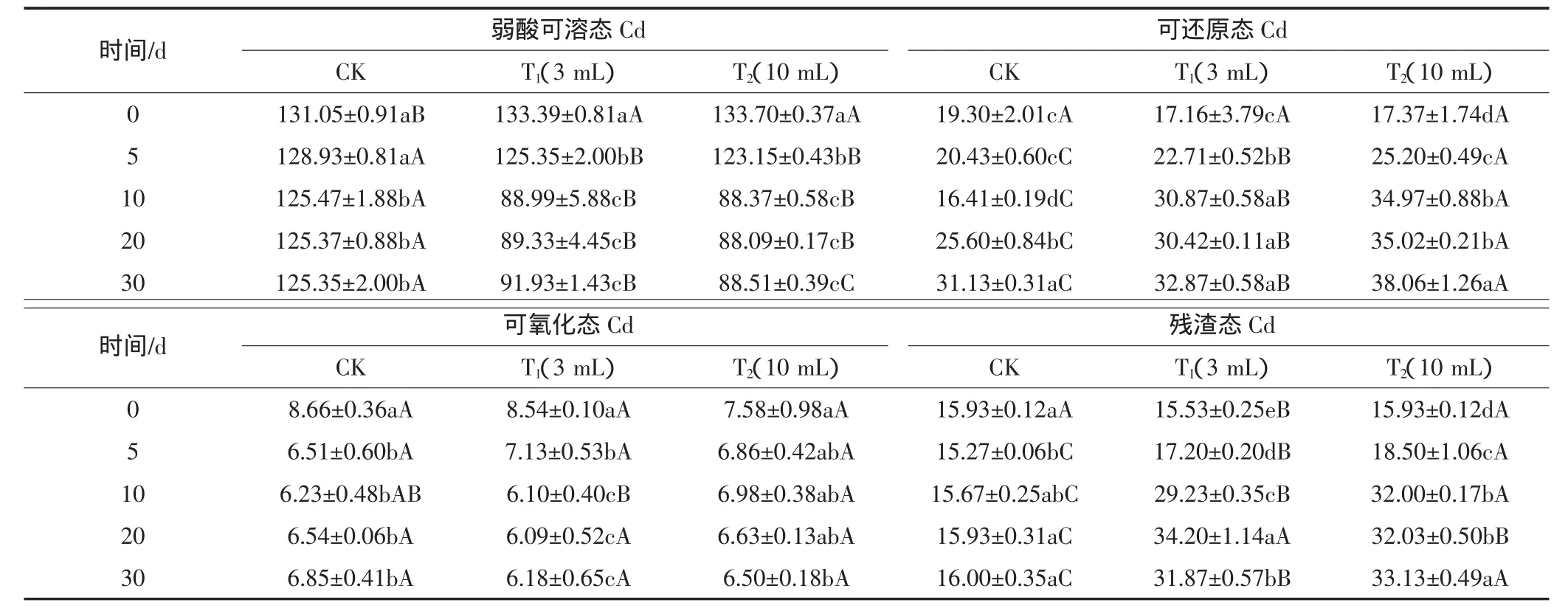
表 3 菌株 B9 对土壤 Cd 形态的影响(mg·kg-1)Table3 Effect of strain B9 on the speciation of Cd in the soil(mg·kg-1)
土壤样品中镉的残渣态含量变化如表3所示,CK处理中残渣态Cd含量随着时间的变化没有显著差异,T1、T2处理残渣态Cd含量随着培养时间的增加呈现出显著增加的趋势。T1处理培养至第20 d时,残渣态Cd含量达到最大值34.20 mg·kg-1,比开始增加了 18.67 mg·kg-1,之后含量减少;T2处理土壤样品中Cd的残渣态含量持续增加,培养至第30 d时,残渣态Cd含量达到最大值33.13 mg·kg-1,比开始增加了17.20 mg·kg-1。T1、T2和 CK 三个处理之间在培养的30 d内残渣态Cd的含量均具有显著性差异,因此,添加菌株B9及其添加量对土壤中可还原态Cd含量影响均较大。
图4为经过30 d培养Cd形态百分比的变化情况,可见随着培养时间的延长,添加B9菌悬液的处理能显著降低土壤中弱酸可溶态Cd含量,增加可还原态和残渣态Cd含量,可氧化态Cd含量变化不明显。CK处理中弱酸可溶态Cd含量在培养30 d后降至最小值,减少了4.64%。T1处理中弱酸可溶态Cd含量在培养10 d后降至最小值,减少了22.17%。T2处理中的酸可溶态Cd含量在培养20 d后降至最小值,减少了25.06%。在整个培养过程中,T2土壤中弱酸可溶态Cd的减少量一直大于T1。CK处理的可还原态Cd含量在培养的第10 d降至10.02%,培养至第30 d上升到17.45%。T1、T2处理中可还原态Cd含量增加明显,培养至第30 d时分别达到19.47%和22.10%,比开始增加了9.66%和12.17%。CK、T1、T2处理中可氧化态Cd含量由4.95%、4.88%、4.33%分别降至3.84%、3.66%、3.77%,但 T1、T2与 CK 相比,减少量都没有明显差异。T1、T2处理中残渣态Cd含量明显增加,由8.88%、9.11%分别升至22.43%、22.72%,增加了13.55%、13.61%。CK中残渣态Cd含量变化不明显。
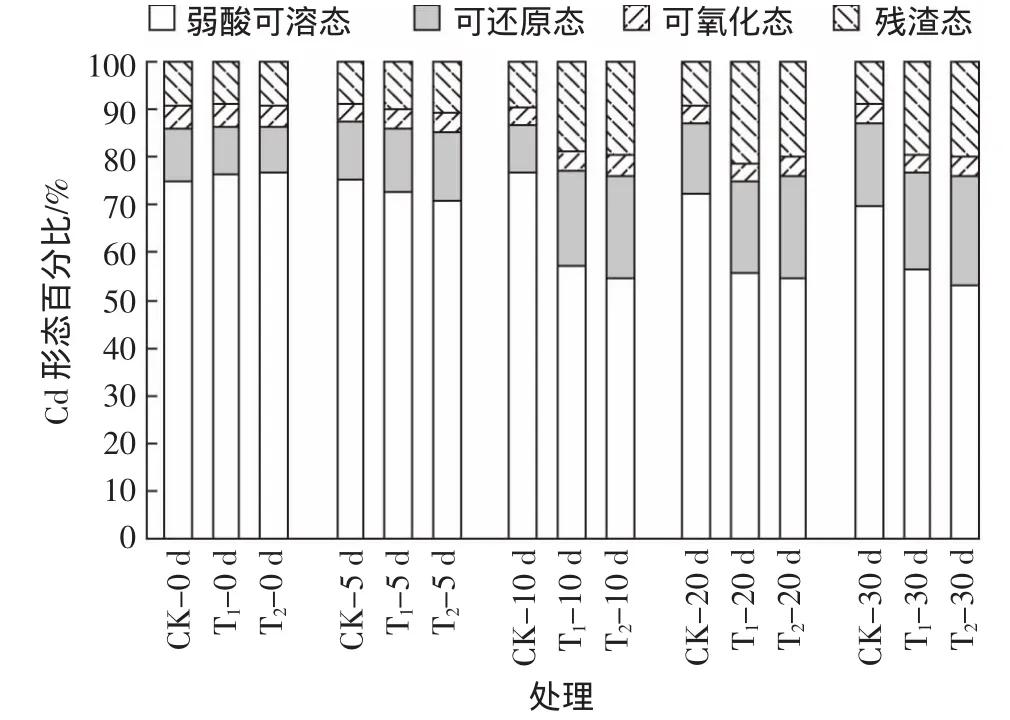
图4 添加菌株B9后各形态Cd百分比动态变化Figure4 Dynamic changes of percentage of Cd under exogenous addition strain B9
3 讨论
微生物对重金属离子的吸附,不仅因微生物种类的不同而异,还受微生物生长和吸附条件的限制,如pH、温度、吸附时间、初始重金属浓度等。为了达到B9对Cd2+的最佳吸附效果,研究了B9吸附培养液中Cd2+的环境条件。培养液的pH值是影响菌株B9吸附Cd2+的一个重要因素(图3a),较低的pH值不利于重金属Cd2+的吸附,这可能是由于在较低的pH值下,液体培养基中的H+与Cd2+竞争表面吸附位点。而pH较高时B9对Cd的吸附率也减少,可能是Cd2+主要以氢氧化物沉淀的形式存在,氢氧化物沉积于菌体细胞表面,影响了Cd2+与吸附位点的结合,使得吸附率下降[21]。培养时间也会影响B9对Cd2+的吸附效果(图3b),72 h时的吸附率略低于48 h时的吸附率,这可能是由于菌株生长消耗营养物质,使菌株生长速率降低或生物量不再增加,随着时间的延长出现了解吸现象;或者菌株在生长代谢过程中产生有生物毒性的产物,这些产物随着时间积累,对菌株的生长繁殖造成影响,从而导致B9对Cd2+的吸附量减少[22]。温度对B9吸附Cd2+的影响(图3c)主要表现在菌体的吸附活性上,温度过高或过低都会降低B9对Cd2+吸附过程所需的活化能,进而对吸附能力造成影响。很多研究[23-24]显示Delftia.sp生长的适宜温度在37℃左右,与本研究结果相近。Cd2+浓度变化过程中(图3d),吸附量比吸附率更能体现出B9对Cd2+的吸附作用,研究表明,微生物对重金属离子的吸附能力与细胞表面的吸附位点的饱和度有关,Cd2+初始浓度较低时,B9表面带负电荷的活性吸附位点多,能与培养液中Cd2+充分结合,使吸附量增加。Cd2+初始浓度的增加导致吸附位点逐渐被占用,从而导致吸附率减少[25],同时,Cd2+浓度高时,会对菌体生长量产生影响(图2),使菌体OD600值下降,这也会减少其对Cd2+的吸附量。
虽然土壤中重金属元素的总量可以作为评价该土壤污染水平的关键因素,但不能真正反映其潜在的生态危害性,重金属元素的不同存在形态的环境行为和生态效应不同,所以分析土壤中重金属的不同形态很有必要[26]。本试验研究显示,B9接种到土壤后能够使Cd的形态发生变化,且各种形态在培养的第10 d几乎达到平衡,即弱酸可溶态Cd含量减少,可还原态和残渣态Cd含量显著增加,而可氧化态Cd含量变化不显著,这与曹霞[27]和范文宏等[18]得出的结论类似。添加菌株B9前,土壤中Cd形态百分比表现为弱酸可溶态>可还原态>残渣态>可氧化态,处理后土壤中Cd形态百分比表现为弱酸可溶态>可还原态≈残渣态>可氧化态。土壤中Cd的弱酸可溶态虽然一直占比最高,但添加B9后Cd的形态还是由有效态向难溶态转化,这能有效降低Cd在土壤中的毒性。添加B9能使Cd的形态发生变化可能是由于B9的生命活动的分泌物或代谢产物使重金属形态发生了转化,如曹裕松等[28]发现细菌能将Cd2+还原成难溶的CdS。B9使Cd形态发生变化也可能是由于B9对重金属Cd的吸附富集作用,微生物可通过带电荷的细胞表面吸附重金属离子,或通过摄取必要的营养元素主动吸收重金属离子,将重金属离子富集在细胞表面或内部,一些微生物能产生胞外聚合物(如多糖、糖蛋白、脂多糖等),其带有大量的阴离子基团,能与金属离子结合;某些微生物产生的代谢产物(如柠檬酸)也是一种很好的金属螯合剂。有关B9对土壤中Cd形态变化的影响机理还需进一步研究。
4 结论
(1)从重金属污染的土壤中分离得到对Cd2+具有较高吸附率的菌株为B9,经鉴定该菌种为Delftia sp.。
(2)通过对不同培养条件下菌株吸附Cd2+效果的试验,发现B9在pH=8、温度为35℃、培养时间为48 h条件下,对Cd2+的吸附效果最好,并且Cd2+浓度在10 mg·L-1及以下时,吸附率在60%以上。
(3)目标菌株B9能影响土壤中Cd的形态,Cd从弱酸可溶态向可还原态和残渣态转化。不同添加量处理下,弱酸可溶态 Cd含量减少 44.40、45.33 mg·kg-1,可还原态Cd含量增加15.71、20.69 mg·kg-1,可氧化态Cd含量无明显变化,残渣态Cd含量增加18.67、17.2 mg·kg-1。
[1]王京文,李 丹,柳 俊,等.耐镉菌株对土壤镉形态及土壤微生物群落结构的影响[J].农业环境科学学报,2015,34(9):1693-1699.
WANG Jing-wen,LI Dan,LIU Jun,et al.Effects of cadmium tolerant bacteria on soil cadmium forms and microbial community structure[J].Journal of Agro-Environment Science,2015,34(9):1693-1699.
[2]王 维.水稻镉吸收的区域模型及其调控研究[D].南京:南京林业大学,2012.
WANG Wei.Rice cadmium uptake by regional model and its regulation[D].Nanjing:Nanjing Forestry University,2012.
[3]安红敏,郑 伟,高 扬.镉的健康危害及干预治疗研究进展[J].环境与健康杂志,2007,24(9):739-742.
AN Hong-min,ZHENG Wei,GAO Yang.Research progress in cadmium toxicity[J].J Environ Health,2007,24(9):739-742.
[4]凌 辉,谢水波,唐振平,等.重金属污染土壤的修复方法及其在几类典型土壤修复中的应用[J].四川环境,2012,31(1):118-122.
LING Hui,XIE Shui-bo,TANG Zhen-ping,et al.Remediation of heavy metal polluted soil and application for typical soils[J].Sichuan Environment,2012,31(1):118-122.
[5]余天红,黎华寿.砷污染土壤微生物修复机制及其研究进展[J].环境污染与防治,2014,36(12):77-82.
YU Tian-hong,LI Hua-shou.Mechanism of bioremediation in aresenic contaminated soil and its research progress[J].Environmental Pollution&Control,2014,36(12):77-82.
[6]Paqnanelli F,Cruz V C,Toro L.Isolation and quantification of cadmium removal mechanisms in batch reactors inoculated by sulphate reducing bacteria:Biosorption versus bioprecipitation[J].Bioresource Technology,2010,101(9):2981-2987.
[7]晋银佳,刘 文,朱 跃,等.荧光假单胞菌产铁载体对油麦菜吸收砂基和水基中Cd的影响[J].环境工程学报,2016,10(1):415-420.
JIN Yin-jia,LIU Wen,ZHU Yue,et al.Effects of siderophore produced by pseudomonas fluorescence on cadmium uptake from sand-base and water-base systems by lettuces[J].Chinese Journal of Environmental Engineering,2016,10(1):415-420.
[8]Wen A,Fegan M,Hayward C,et al,Phylogenetic relationships among members of the Comamonadaceae,and description of Delftia acidovorans(den Dooren de Jong 1926 and Tamaoka et al.1987) gen.nov.,comb.nov[J].Int J Syst Bacteriol,1999,49(2):567-576.
[9]Zhang T,Zhang J L,Liu S J,et al.A novel and complete gene cluster involved in the degradation of aniline by Delftia sp.AN3[J].Journal of Environmental Sciences,2008,20(6):717-724.
[10]梁泉峰.生物降解菌株Delftia tsuruhatensis AD9中染色体编码的苯胺代谢基因簇的克隆和功能研究[D].北京:中国农业科学院,2005.
LIANG Quan-feng.Cloning and functional analysis of chromosomeencoded gene cluster for aniline metabolic pathway in Delftia tsturuhatensis AD9[D].Beijing:Chinese Academy of Agricultural Science,2005.
[11]Xiao C B,Ning J,Yan H,et al.Biodegradation of aniline by a newly isolated Delftia sp.XYJ6[J].Chinese Journal of Chemical Engineering,2009,17(3):500-505.
[12]González A J,Gallego A,Gemini V L,et al.Degradation and detoxification of the herbicide 2,4-dichlorophenoxyacetic acid(2,4-D)by an indigenous Delftia sp.strain in batch and continuous systems[J].International Biodeterioration&Biodegradation,2012,66(1):8-13.
[13]叶杰旭,林彤晖,骆煜昊,等.1株氯苯高效降解菌的分离鉴定及降解特性[J].环境科学,2017,38(2):802-808.
YE Jie-xu,LIN Tong-hui,LUO Yu-hao,et al.Isolation and identification of a chlorobenzene-degrading bacterium and its degradation characteristics[J].Environmental Science,2017,38(2):802-808.
[14]Prakash D,Pandey J,Tiwary B N,et al.Physiological adaptations and tolerance towards higher concentration of selenite(Se4+)in Enterobacter sp.AR-4,Bacillus sp.AR-6 and Delftia tsuruhatensis,AR-7[J].Extremophiles,2010,14(3):261-272.
[15]Garavaglia L,Cerdeira S B,Vullo D L.Chromium(Ⅵ)biotransformation by β-and γ-proteobacteria from natural polluted environments:A combined biological and chemical treatment for industrial wastes[J].Journal of Hazardous Materials,2010,175(1/2/3):104-110.
[16]Morel M A,Ubalde M C,Braña V,et al.Delftia sp.JD2:A potential Cr(Ⅵ)-reducing agent with plant growth-promoting activity[J].Archives of Microbiology,2011,193(1):63-68.
[17]Ubalde M C,Braña V,Sueiro F,et al.The versatility of Delftia sp.isolates as tools for bioremediation and biofertilization technologies[J].Current Microbiology,2012,64(6):597-603.
[18]范文宏,姜 维,王 宁.硫酸盐还原菌修复污染土壤过程中镉的地球化学形态分布变化[J].环境科学学报,2008,28(11):2291-2298.
FAN Wen-hong,JIANG Wei,WANG Ning.Changes of cadmium geochemical speciation in the process of soil bioremediation by sulfate-reducing bacteria[J].Acta Scientiae Circumstantiae,2008,28(11):2291-2298.
[19]韩春梅,王林山,巩宗强,等.土壤中重金属形态分析及其环境学意义[J].生态学杂志,2005,24(12):1499-1502.
HAN Chun-mei,WANG Lin-shan,GONG Zong-qiang,et al.Chemical forms of soil heavy metals and their environmental significance[J].Chinese Journal of Ecology,2005,24(12):1499-1502.
[20]Rauret G,López-sánchez J F,Sahuquillo A,et al.Improvement of the BCR three step sequential extraction procedure prior to the certification of new sediment and soil reference materials[J].J Environ Monit,1999,1(1):57-61.
[21]吴 涓,李清彪,邓 旭,等.重金属生物吸附的研究进展[J].离子交换与吸附,1998,14(2):180-187.
WU Juan,LI Qing-biao,DENG Xu,et al.Research advances in biosorption of heavy metals[J].Ion Exchange and Adsorption,1998,14(2):180-187.
[22]郑晓丹.变形假单胞菌吸附镉的机制及其吸附条件的研究[D].福州:福建师范大学,2010.
ZHENG Xiao-dan.Research on the mechanism and the conditions of cadmium adsorpted by Pseudomonas Plecoglossicida[D].Fuzhou:Fujian Normal University,2010.
[23]吕晶华,段云霞,许丹宇,等.高效苯胺降解菌的分离鉴定及其降解特性[J].城市环境与城市生态,2016,29(1):32-34.
LÜ Jing-hua,DUAN Yun-xia,XU Dan-yu,et al.Isolation and identification of bacteria degrading aniline[J].Urban Environment&Urban Ecology,2016,29(1):32-34.
[24]侯 颖,王 飞,李静泉,等.Delftia sp.T3-6菌株及其粗酶液对2′,6′-甲乙基-2-氯乙酰苯胺的降解[J].环境科学学报,2014,34(6):1396-1402.
HONG Ying,WANG Fei,LI Jing-quan,et al.Degradation characteristics of 2′,6′-methylethyl-2-chloroacetanilide by strain Delftia sp.T3-6 and its crude enzyme[J].Acta Scientiae Circumstantiae,2014,34(6):1396-1402.
[25]Vecchio A,Finoli C,Simine D D,et al.Heavy metal biosorption by bacterial cells[J].Analytical and Bioanalytical Chemistry,1998,361(4):338-342.
[26]郭朝晖,朱永官.典型矿冶周边地区土壤重金属污染及有效性含量[J].生态环境学报,2004,13(4):553-555.
GUO Zhao-hui,ZHU Yong-guan.Contamination and availabile contents of heavy metals in soils in the typical mining and smelting circumjacent districts[J].Ecology and Environment,2004,13(4):553-555.
[27]曹 霞.耐铅镉微生物的筛选及其对污染土壤铅镉化学形态的影响[D].武汉:华中农业大学,2009.
CAO Xia.Screening of lead and cadmium-resistant microorganism and their effect on chemical form of Pb and Cd in contaminated soil[D].Wuhan:Huazhong Agricultural University,2009.
[28]曹裕松,李志安,邹 碧.根际环境的调节与重金属污染土壤的修复[J].生态环境,2003,12(4):493-497.
CAO Yu-song,LI Zhi-an,ZOU Bi.Regulation of rhizospherre and remediation of polluted soil by heavy metal[J].Ecology and Environment,2003,12(4):493-497.
