组蛋白赖氨酸转移酶KAT6B基因shRNA慢病毒载体的构建与鉴定
2018-03-12靳俊杰曹涤非宋爱利赵丽丽刘兆良
靳俊杰 安 静 曹涤非,3 宋爱利 赵丽丽 刘兆良
KAT6B/MORF基因是MYST家族的一员,是一种组蛋白修饰酶[1-3],能特异地乙酰化组蛋白H3的23位赖氨酸(H3K23),而对14和16位的赖氨酸不起作用。有研究表明细胞内H3K23的乙酰化(H3K23ac)总体水平高度依赖于组蛋白乙酰转移酶(HAT)活性,主要取决于KAT6B/MORF[1,3]基因。尽管组蛋白乙酰化通常与活性基因表达相关,但是H3K23ac的确切功能尚不清楚。H3K23ac在乳腺癌Ⅲ期患者中的表达水平明显升高[4],其表达水平高低和TNM分期之间存在线性趋势。另外,H3K23ac表达水平高的乳腺癌患者的总生存期更短[4]。这一结果揭示了H3K23ac在乳腺癌中的重要作用。
KAT6B基因的突变与多种遗传疾病相关,包括努南综合症(Noonan syndrome)、Say-Barber-Biesecker-Young-Simpson综合症[5]、髌骨综合症(Genitopatellar syndrome)和小脸裂综合症(Blepharophimosis-ptosis-epicanthus inversus syndrome)。这些疾病多与神经和生殖系统的发育有关,说明了KAT6B基因和H3K23ac在发育中的重要作用[6-9]。此外,KAT6B基因还与多种肿瘤的发生有关。在急性髓细胞性白血病(Acute myelocytic leukemia,AML)中,KAT6B基因频繁与其它基因发生重排,产生新的融合蛋白[1]。在基因组水平上的研究还表明KAT6B基因在包括前列腺癌、胃癌、卵巢癌、子宫颈癌、肺腺癌、结肠和直肠腺癌以及成神经管细胞瘤在内的多种实体瘤中频繁发生扩增[10-13],与此同时,研究数据还表明KAT6B基因在非小细胞肺癌中发挥着肿瘤抑制作用[1-2]。然而,KAT6B基因在不同肿瘤中作用尚不明确,作为一个H3K23位点特异的乙酰化转移酶[14],揭示KAT6B基因在肿瘤中的作用可以进一步增加我们对H3K23ac在肿瘤中作用的了解。
本研究在乳腺癌细胞T47D中构建了KAT6B基因沉默载体并对重组慢病毒载体的基因沉默效果进行了鉴定。为进一步确定KAT6B基因和H3K23ac在肿瘤中的作用,以及开发以组蛋白乙酰化为靶点的抗肿瘤药物打下基础。
1 材料与方法
1.1 试剂与仪器
DNA纯化回收试剂盒(TIANGEN)、高保真Prime STAR酶、Premix Taq、限制性核酸内切酶(TaKaRa公司),慢病毒包装系统质粒、载体质粒pENTR/pSM2(CMV/GFP)和pLenti X1 Puro DEST(Addgene),HEK293T细胞与乳腺癌细胞系T47D(上海细胞库),质粒DNA小提试剂盒(Axygen公司),Gateway LR clonaseII(Invitrogen公司),Clon Express MultiS(Vazyme公司),牛胚胎血清、DMEM培养基、胰蛋白酶、兔源的KAT6B一抗(Abcam公司),兔源的Actin一抗(Gene Tex),山羊抗兔二抗(博士德),引物合成与测序由生工生物工程(上海)股份有限公司完成;DNA电泳槽、稳压电泳仪、琼脂糖凝胶成像分析仪(Thermo公司),超微量分光光度计、冷冻高速离心机、PCR仪(BIO-RAD公司)。
1.2 基因沉默载体的构建
1.2.1 KAT6B基因沉默载体shRNA的设计与合成 根据参考文献[15]中的方法和文献中KAT6B基因的shRNA序列,设计并合成2对单链的shRNA序列,以此为模板设计一对PCR扩增引物。在上游引物引入XhoI酶切位点,下游引物引入EcoRI酶切位点。PCR扩增后,将PCR扩增产物溶液回收。shRNA及引物的序列见表1。
1.2.2 入门载体的构建与鉴定 用限制性核酸内切酶EcoRI与XhoI将入门载体pENTR/pSM2(CMV/GFP)酶切,从琼脂糖凝胶回收。将该线性化载体与回收得到的shRNA序列通过一步法克隆进行重组连接[16]。连接产物转化感受态细胞DH5α。所得的单克隆菌落提取质粒后首先用XhoI与EcoRI酶切鉴定,随后测序进一步验证。
1.3 pLPG慢病毒沉默载体的构建与鉴定
将上述含有目的片段、测序完全正确的入门质粒与pLenti X1 Puro DEST质粒进行LR克隆反应。转化后得到的阳性克隆菌落进行测序验证。测序正确的目的质粒用于进一步实验。因为入门载体为pENTR/pSM2(CMV/GFP),目的载体为pLenti X1 Puro DEST,最终获得的载体缩写为pLPG。
1.4 病毒包装及细胞转导
将2×106个HEK293T细胞接种至含有10%牛胚胎血清的高糖DMEM培养基的25cm2细胞培养瓶中。在37℃、5%CO2的培养箱中常规培养24 h,细胞生长达到80%~90%融合时,将目的载体质粒与慢病毒包装质粒(pMD2和pPAX2)用Lipo-2000(pPAX2,目的载体质粒,和pMD2比例分别为10∶10∶1)共转染HEK293T细胞进行病毒包装。转染18 h后换为完全培养基并观察荧光。换液后分别在48 h和72 h收取病毒上清并用0.45 μM滤器过滤。将过滤后的病毒上清与病毒浓缩液Lenti-X concentrator按3∶1比例混合,4℃过夜。次日,将混合物于1500 xg,4℃离心45 min。弃上清,用 120 μL的无血清RPMI-1640培养基重悬病毒。将前一天接种好的T47D细胞(6孔板,4×105/孔)用1.2 mL含有polybrene(终浓度为8 μg/mL)的无血清RPMI-1640换液,将重悬的病毒120 μL加入6孔板中,32℃,2000 rpm离心2 h。在37℃培养箱培养5 h后,补入1 mL完全培养基。继续培养48 h,观察荧光,收蛋白。
1.5 统计学方法
采用SPSS 16.0软件进行统计学分析,采用Kaplan-Meier法分析总体生存率和中位生存时间,采用Log-rank检验比较两组生存曲线,P<0.05为差异具有统计学意义。

表1 构建慢病毒载体的shRNA序列
Note:The underlined sequences are sequences of the Scramble shRNAs and corresponding shRNAs.The italic sequences represent the restriction sites used for cloning.The boldfaced sequences are the primers sequences used for amplifying the shRNAs and scrambe shRNAs.
2 结果
2.1 KAT6B基因与乳腺癌的关系
为了研究KAT6B基因在乳腺癌中的作用,本研究利用在线数据库(www.kmplot.com)分析了KAT6B基因的表达水平对乳腺癌患者生存期的影响。该数据库包含3 554个乳腺癌样本,随访时间从1994年—2014年。分析发现KAT6B基因高表达的乳腺癌患者具有较长的生存期。反之,KAT6B基因低表达的患者具有较短的生存期(HR=0.83,95%CI:0.74~0.93,P<0.05),具有统计学意义。因此,本研究认为KAT6B基因在乳腺癌中是一个潜在的抑癌基因(图1)。
2.2 pLPG慢病毒基因沉默载体的构建和鉴定结果
为了研究KAT6B基因在乳腺癌中的作用,本研究构建了pLPG慢病毒基因沉默载体。首先,以Scrambled 5,shRNA5,Scrambled 8和shRNA8的单链序列为模板,用miR-30 PCRXhoIF和miR-30 PCREcoRIR为引物,扩增大小约100 bp的PCR产物(图2A)。入门载体pENTR/pSM2(CMV/GFP)用XhoI和EcoRI进行双酶切,酶切产物大小约3 850 bp(图2B)。将回收后的PCR产物与线性化载体用一步法重组连接,转化感受态细胞DH5α。重组质粒经酶切鉴定与实际质粒大小相符,测序鉴定显示基因序列完全正确,无突变与缺失(图2D,图2E)。
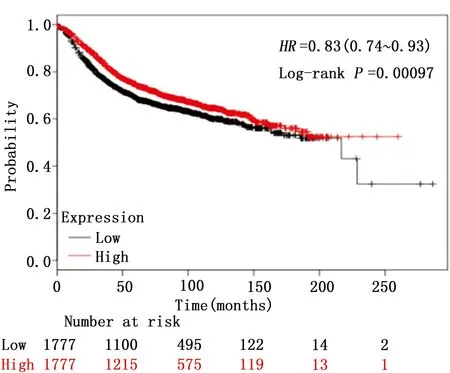
图1 KAT6B基因在3554位乳腺癌患者中总生存期的分析Figure 1 Survival analysis of KAT6B expression in 3554 patients with breast cancer
将所得的正确质粒与目的载体pLenti X1 Puro DEST进行LR克隆反应。重组质粒分别用EcoRI和XhoI单酶切(图3),酶切结果与预期结果相符,表明KAT6B基因沉默载体构建成功。
2.3 KAT6B基因沉默载体效果检测
将KAT6B慢病毒基因沉默载体与病毒包装质粒共转染HEK293T细胞48 h、72 h后,分别收取病毒上清。将浓缩后的病毒加入T47D细胞中,48 h后观察荧光(图4A)。收取蛋白,Western blot结果如图4B所示,与对照组Scramble5、Scramble8相比,shRNA5、shRNA8转染的实验组KAT6B基因的蛋白表达水平明显降低。说明构建的pLPG-shRNA载体在乳腺癌细胞系中能够对KAT6B基因起到沉默作用。

图3 KAT6B基因沉默载体的鉴定Figure 3 Identification of KAT6B gene silencing vectorNote:Recombinant plasmids were digested with EcoRI or XhoI,respectively,and subjected to agarose gel electrophoresis(Lanes 1,3,5 and 7 were digested by EcoRI;lanes 2,4,6 and 8 were digested by XhoI).
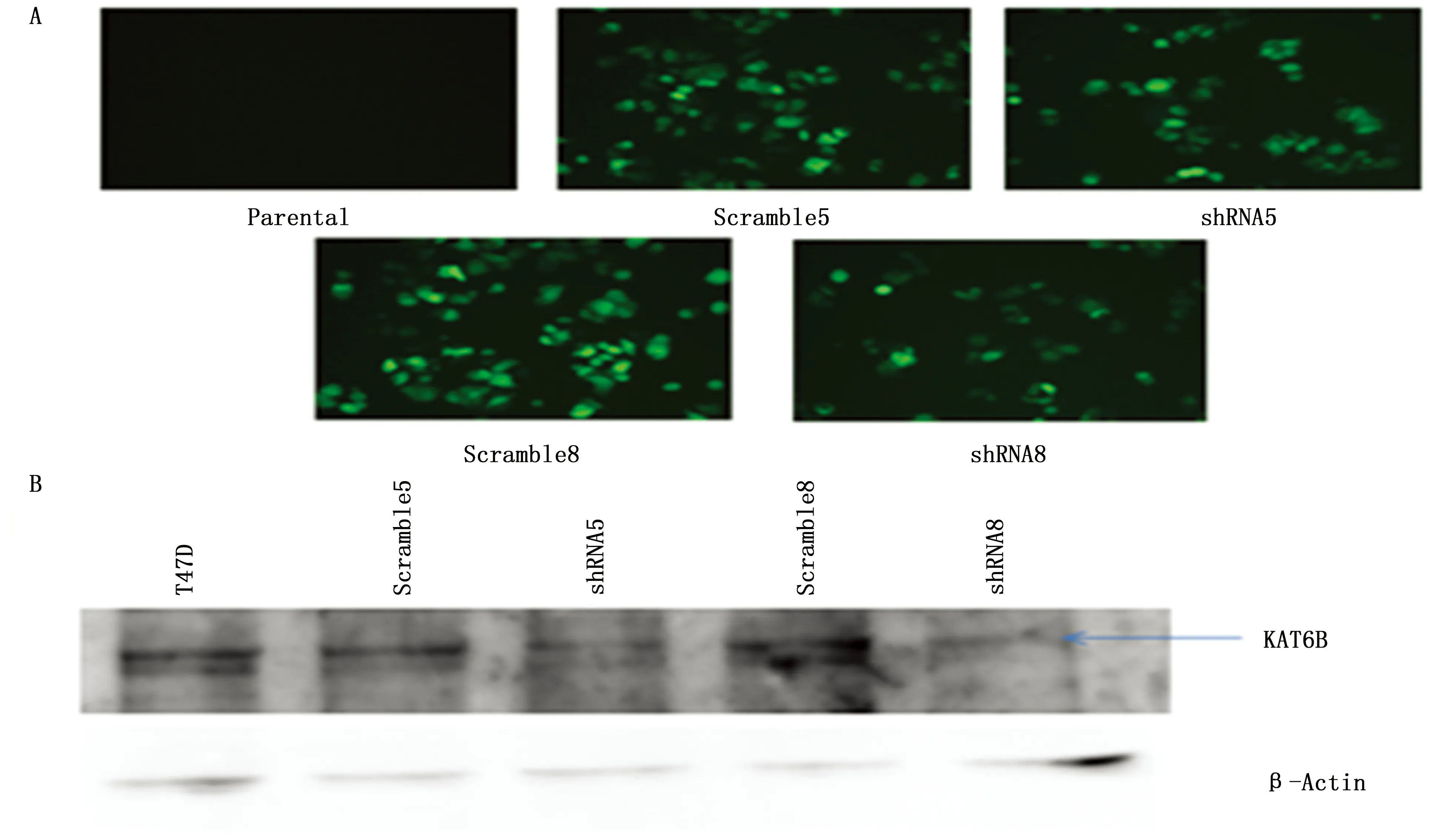
图4 KAT6B慢病毒基因沉默载体效果检测Figure 4 Effects of KAT6B gene silencing vectors on T47 cellsNote:A.GFP expression after lentiviral infection in T47D cells(200×);B.After shRNA5 and shRNA8 lentiviral infection,the expression of KAT6B protein was determined in T47D cells by Western blot.
3 讨论
RNAi是细胞生物学研究中的一个重要工具[17-18],是由大约20个碱基构成的siRNA介导的基因转录后沉默。RNA干扰有2种方式,一种方法是可以直接转染小干扰RNA,另一种方法是以质粒或病毒作为载体来表达短发夹RNA。直接转染的方法受到细胞株的转染效率的限制,应用性受到局限。利用病毒载体表达shRNA则具有转染效率高的优点,大大减少了转染效率低而带来的不便[19]。其中慢病毒载体由于转导效率稳定,得到了广泛地应用。慢病毒载体包装系统是在HIV-I病毒的基础上进行改造的病毒载体包装系统,可以高效率地将目的基因片段导入到人和动物的原代细胞或细胞系中,将目的基因片段整合到宿主细胞基因组中。慢病毒可以有效的感染并整合进入非分裂细胞,具有高效率、高稳定性,而且很少诱发宿主免疫反应的优点。因此,慢病毒载体介导的RNAi已经成为多数研究者的首选。
本研究应用慢病毒载体包装系统将KAT6B基因沉默载体转染到乳腺癌细胞T47D中,检测KAT6B基因在蛋白水平的表达变化。首先设计了2对基因沉默靶序列,经PCR扩增后与酶切后的入门载体连接,转化到大肠杆菌后提取质粒,经基因测序证明插入片段的序列大小、方向均与设计的序列一致,然后将得到的测序正确的入门载体与目的载体经LR克隆发生重组,得到所需的慢病毒基因沉默载体,该载体经EcoR I和Xho I单酶切验证,证明入门载体与目的载体发生重组,表明该慢病毒基因沉默载体构建成功。经慢病毒载体包装系统包装后,转导T47D细胞。Western blot检测KAT6B基因蛋白水平的表达量,证明设计的shRNA对KAT6B基因有一定的沉默效果。在乳腺癌患者中H3K23ac表达水平与TNM分期呈线性关系,H3K23ac表达水平高的患者的生存期短。说明H3K23ac水平高低与乳腺癌患者生存期长短有关[4]。又有研究发现KAT6B基因的突变可能与多种遗传疾病有关,还可能与某些肿瘤的发生、发展、转移与预后有着密切关系。因为KAT6B基因是一种组蛋白修饰酶,能特异地乙酰化H3K23。而H3K23ac表达水平又依赖于HAT活性,取决于KAT6B基因。所以KAT6B基因作为一个H3K23位点特异性乙酰化转移酶与肿瘤之间的关系可能是通过H3K23ac来完成。有研究显示KAT6B基因作为一个肿瘤抑制基因,可以调控肿瘤细胞的生长和转移,通过与生长抑制因子5(ING5)共同作用发挥肿瘤抑制作用[20]。因此揭示KAT6B基因与肿瘤的发生、发展的关系,也可以进一步增加了我们对H3K23ac在肿瘤作用的了解。这一结果为今后进一步研究KAT6B基因在乳腺癌中的作用奠定了基础。
1 Huang F,Abmayr SM,Workman JL.Regulation of KAT6 acetyltransferases and their roles in cell cycle progression,stem cell maintenance,and human disease[J].Mol Cell Biol,2016,36(14):1900-1907.
2 Simó-Riudalbas L,Pérez-Salvia M,Setien F,et al.KAT6B is a tumor suppressor histone H3 lysine 23 acetyltransferase undergoing genomic loss in small cell lung cancer[J].Cancer Res,2015,75(18):3936-3945.
3 Mattioli F,Schaefer E,Magee A,et al.Mutations in histone acetylase modifier BRPF1 cause an autosomal-dominant form of intellectual disability with associated aptosis[J].Am J Hum Genet,2017,100(1):105-116.
4 Li M,Yuan L,Jing A,et al.Histone H3 lysine 23 acetylation is associated with oncogene TRIM24 expression and a poor prognosis in breast cancer[J].Tumour Biol,2016,37(11):14803-14812.
5 Lundsgaard M,Le VQ,Ernst A,et al.De novo KAT6B mutation identified with whole-exome sequencing in a girl with say-barber/biesecker/young-simpson syndrome[J].Mol Syndromol,2017,8(1):24-29.
6 Szakszon K,Salpietro C,Kakar N,et al.De novo mutations of the gene encoding the histone acetyltransferase KAT6B in two patients with say-barber/biesecker/young-simpson syndrome[J].Am J Med Genet A,2013,161(4):884-888.
7 Desh H,Gray SL,Horton MJ,et al.Molecular motor MYO1C,acetyltransferase KAT6B,and osteogenetic transcription factor RUNX2,expression in human masseter muscle contributes to development of malocclusion[J].Arch Oral Biol,2014,59(6):601-607.
8 Campeau PM,Kim JC,Lu JT,et al.Mutations in KAT6B,encoding a histone acetyltransferase,cause genitopatellar syndrome[J].Am J Hum Genet,2012,90(2):282-289.
9 Clayton-Smith J,O′Sullivan J,Daly S,et al.Whole-exome-sequencing identifies mutations in histone acetyltransferase gene KAT6B in individuals with the say-barber-biesecker variant of ohdo syndrome[J].Am J Hum Genet,2011,89(5):675-681.
10 He W,Zhang MG,Wang XJ,et al.KAT5 and KAT6B are in positive regulation on cell proliferation of prostate cancer through PI3K-AKT signaling[J].Int J Clin Exp Pathol,2013,6(12):2864-2871.
11 Du P,Zhao J,Wang J,et al.Sine oculis homeobox homolog 1 regulates mitochondrial apoptosis pathway via caspase-7 in gastric cancer cells[J].J Cancer,2017,8(4):636-645.
12 Panagopoulos I,Gorunova L,Bjerkehagen B,et al.Novel KAT6B-KANSL1 fusion gene identified by RNA sequencing in retroperitoneal leiomyoma with t(10;17)(q22;q21)[J].PLoS One,2015,10(1):e0117010.
13 You L,Yan K,Zou J,et al.The lysine acetyltransferase activator Brpf1 governs dentate gyrus development through neural stem cells and progenitors[J].PLoS Genet,2015,11(3):e1005034.
14 Yang H,Pinello CE,Luo J,et al.Small-molecule inhibitors of acetyltransferase p300 identified by high-throughput screening are potent anticancer agents[J].Mol Cancer Ther,2013,12(5):610-620.
15 Campeau E,Ruhl VE,Rodier F,et al.A versatile viral system for expression and depletion of proteins in mammalian cells[J].PLoS One,2009,4(8):e6529.
16 Fussenegger M,Moser S,Mazur X,et al.Autoregulated multicistronic expression vectors provide one-step cloning of regulated product gene expression in mammalian cells[J].Biotechnol Prog,2010,13(6):733-740.
17 Novina CD,Sharp PA.The RNAi revolution[J].Nature,2004,430(6996):161-164.
18 Hannon GJ.RNA interference[J].Nature,2002,418(6894):244-251.
19 Ni JQ,Zhou R,Czech B,et al.A genome-scale shRNA resource for transgenic RNAi in Drosophila[J].Nat Methods,2011,8(5):405-407.
20 Meter TEV,Khan A,Fitzmartin K,et al.Eg-16aberrant myst4/brpf1 signaling misdirects regional neurogenesis programs,sustaining expression of self-renewal genes in pediatric brain cancers[J]. Neuro Oncology,2014,16(5):78.
