循环式腹腔内热灌注化疗对进展期胃癌的临床疗效研究
2018-03-07田华
田华
胃癌是发病率排名第五的恶性肿瘤,全球每年新发病例约95.1万,死亡病例约72.3万[1]。中国胃癌发病例数约占全球的42%,死亡例数约占全球的45%,严重影响着人群的生命健康。临床诊治患者中,约有70%为进展期胃癌,根治性治疗是其首选治疗方式,但术后选择合适的化疗方法对降低复发、提升生存率至关重要。传统全身化疗药物到达疾病部位的浓度较低,难以彻底消灭肿瘤细胞阻碍其转移,因此远期疗效并不理想。循环式腹腔内热灌注化疗使药物直接作用于腹腔,可对肿瘤细胞进行直接、高效的杀伤,改善患者的复发和生存状况。本研究观察胃癌根治术后早期循环式腹腔内热灌注化疗对进展期胃癌的治疗效果,旨在为该病的临床治疗提供依据。
1 资料与方法
1.1 一般资料 选择2013年1月—2015年1月在我院进行手术治疗的进展期胃癌患者96例作为研究对象,随机分为观察组和对照组各48例。纳入标准:①肿瘤分期为Ⅱ期及Ⅲa期;②无其他脏器转移;③无化疗禁忌症者;④适合进行腹腔热灌注治疗者;⑤未患有严重肝肾疾病、心血管疾病及糖尿病等。所有患者均已知情同意加入本研究。观察组男28例、女20例;年龄30~76岁,中位年龄53岁;Ⅱ期27例、Ⅲa期21例;高分化腺癌11例、中分化腺癌18例、低分化腺癌14例、黏液腺癌及黏液细胞癌5例。对照组男31例、女18例;年龄29~78岁,中位年龄56岁;Ⅱ期25例、Ⅲa期23例;高分化腺癌9例、中分化腺癌20例、低分化腺癌13例、黏液腺癌及黏液细胞癌6例。两组患者性别、年龄、肿瘤分期、分型等基线资料差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法 对照组采用单纯全身化疗。术后2~3周应用紫杉醇(PTX)135 mg/m2,静脉滴注,D1~5;替加氟0.8~1.0 g,静脉滴注,D1~5;顺铂(DDP)80 mg/m2,静脉滴注,D1~5。每4周重复1次该方案,共治疗6个周期。观察组术后早期采用循环式腹腔热灌注化疗联合全身化疗组。胃癌术后进行腹腔穿刺,在腹腔左、右膈下及盆腔两侧各置1条热灌注管,于术后第1、2天,应用体腔热灌注治疗系统BR-TRG-II型行腹腔热灌注化疗。灌注液配制:D1、4应用奥沙利铂100 mg/m2+地塞米松10 mg+2%利多卡因10 mL+0.9%氯化钠溶液2 000~3 000 mL进行灌注;D2~3应用氟尿嘧啶0.75 g+地塞米松10 mg+2%利多卡因10 mL+0.9%氯化钠溶液2 000~3 000 mL进行灌注。启动灌注机加热至38℃,连接各引流管,将热灌注液循环灌入腹腔,此后控制温度在41℃~43℃,持续灌注90 min。灌注过程中根据患者状况调节灌注机,保证患者的生命体征稳定,同时要求患者每15 min变体位。腹腔热灌注治疗每周1次,连续治疗4周后开始全身化疗,方案与对照组一致。
1.3 疗效评价 定期进行门诊及电话随访,并复查胃镜及胸腹部CT等,记录患者1年和3年的复发和生存情况及两组患者胃肠道反应、血小板减少、粒细胞减少、切口感染及口腔炎等不良反应的发生情况。
1.4 统计分析 采用SPSS 19.0软件进行数据分析,计量资料比较根据资料类型采用非参数检验,计数资料比较采用χ2检验,Kaplan-Meier法绘制生存曲线,Log-rank法检验两组生存时间,检验水准α=0.05。
2 结果
2.1 复发及生存情况比较 观察组1年复发率为8.3%,对照组1年复发率为6.3%,差异无统计学意义(χ2=0.000,P=1.000);观察组3年复发率为31.3%,对照组3年复发率为52.1%,差异无统计学意义(χ2=4.286,P=0.038)。观察组1年生存率为91.7%,对照组1年生存率为87.5%,差异无统计学意义(χ2=447,P=0.504);观察组3年生存率为70.8%,对照组3年生存率为45.8%,差异无统计学意义(χ2=6.171,P=0.013);两组生存差异经log-rank检验有统计学意义(χ2=6.453,P=0.011)。见图1(封二)。
2.2 不良反应 两组患者胃肠道反应、血小板减少、粒细胞减少、切口感染及口腔炎的发生率差异无统计学意义(P>0.05)。见表1。
3 讨论
近年来,随着人口老龄化不断加重,我国胃癌的发病呈逐年上升趋势,且发病越来越年轻化,2015年我国胃癌新发病例约为67.9万例,死亡病例约为49.8万例,发病率和死亡率在全球均处于较高水平,给社会和个人带来了沉重的健康和经济负担[2]。由于胃癌的疾病特征,其早期检出率<20%,患者发现时往往已处于进展期,临床上也将进展期胃癌作为诊治和研究重点。根治性手术是治疗进展期胃癌的最有效的手段,但术后的局部复发率较高,远期生存状况并不理想[3]。为了降低胃癌术后的局部复发及远处转移,提高生存率,选择合适的化疗方法具有重要的临床意义。
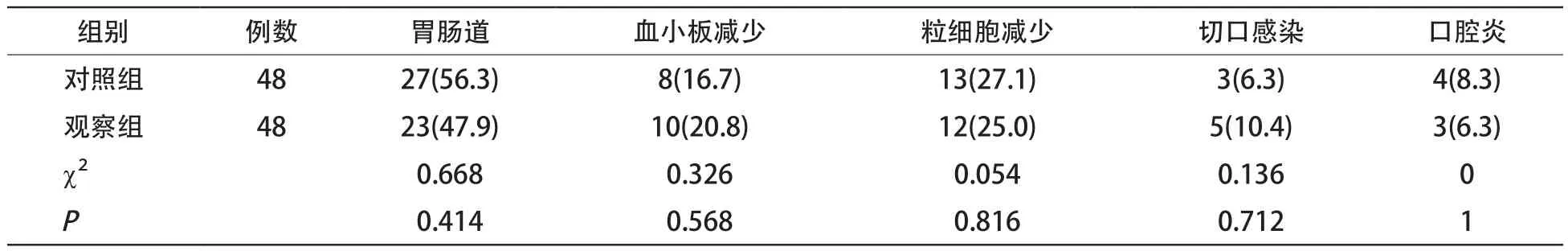
表1 观察组不良发生情况[例(%)]
本研究结果显示,两组患者1年复发率及生存率差异无统计学意义,但观察组3年复发率低于对照组,生存率高于对照组。这说明相较于单纯全身化疗,肿瘤根治术后早期应用循环式腹腔内热灌注化疗可改善患者长期复发和生存状况,这与国内外研究一致。李明辉等[4]的一项应用康莱特腹腔热灌注联合XELOX方案化疗治疗进展期胃癌的研究显示,研究组3年局部复发率为41.9%,肝转移率为22.6%,均低于对照组。姚路斌等[5]研究也显示,应用腹腔热灌注治疗,患者的癌胚抗原、基质金属蛋白酶及血清血管内皮生长因子等肿瘤标志物均较对照组低,5年生存率观察组(23.08%)高于对照组(3.85%)。腹腔热灌注化疗综合利用了区域化疗、热疗和大容量液体对腹腔的机械灌洗作用,一方面其可以通过腹腔内长时间灌注,使药物与肿瘤进行充分接触,保持药物在局部的高浓度,加强化疗药物向肿瘤细胞的渗透,增强其细胞毒性作用,有效杀灭游离细胞和微小病灶,未着床的游离肿瘤细胞也会因为机械冲洗作用被带出[6];另一方面将化疗药物加热,可以增加肿瘤细胞对化疗药物的摄取及转运,增加化疗敏感度,进一步提高化疗效率,因此其可以改善进展期胃癌的长期预后[7]。
此外,腹膜-血浆屏障具有调节化疗药物在腹腔组织和血浆中比例的作用,腹腔热灌注化疗时腹腔内组织的药物浓度高于血浆浓度,药物直接通过肝脏进行代谢,可减弱化疗药物的全身循环毒性,减少不良反应的发生[8]。本研究结果显示,两组患者胃肠道反应、血小板减少、粒细胞减少、切口感染及口腔炎等不良反应的发生率差异无统计学意义,与其他研究一致[9]。
综上所述,早期循环式腹腔内热灌注化疗可改善进展期胃癌肿瘤患者术后的长期预后,未增加不良反应的发生,具有较高的临床应用价值。
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources,Methodsand major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015, 136(5): 359-386.
[2] 左婷婷,郑荣寿,曾红梅,等.中国胃癌流行病学现状[J].中国肿瘤临床,2017,44(1):52-58.
[3] De Vita F, Sforza V, Lieto E, et al. Treatment of gastric cancer[J]. Onkologie, 2014, 75(5): 32-39.
[4] 李明辉,刘红波,冯运章.康莱特腹腔热灌注联合XELOX方案化疗治疗进展期胃癌的疗效观察[J].现代肿瘤医学,2017,25(2):266-269.
[5] 姚路斌,洪波.进展期胃癌术后早期循环式腹腔热灌注化疗联合全身化疗的疗效[J].中国现代医学杂志,2015,25(31):58-61.
[6] Roviello F, Caruso S, Neri A, et al. Treatment and prevention of peritoneal carcinomatosis from gastric cancer by cytoreductive surgery and hyperthermic intraperitoneal chemotherapy: overview and rationale[J].Eur J Surg Oncol, 2013, 39(12): 1309-1316.
[7] Saladino E, Fleres F, Mazzeo C, et al. The role of prophylactic hyperthermic intraperitoneal chemotherapy in the management of serosal involved gastric cancer[J].Anticancer Research, 2014, 34(4): 2019-2022.
[8] Rudloff U, Langan RC, Mullinax JE, et al. Impact of maximal cytoreductive surgery plus regional heated intraperitoneal chemotherapy (HIPEC) on outcome of patients with peritoneal carcinomatosis of gastric origin:Resultsof the GYMSSA trial[J]. J Surg Oncol, 2014,110(3): 275-284.
[9] Chia CS, You B, Decullier E, et al. Patients with peritoneal carcinomatosis from gastric cancer treated with cytoreductive surgery and hyperthermic intraperitoneal chemotherapy: is cure a possibility[J]. Ann Surg Oncol,2016, 23(6): 1971-1979.
