不同消毒方式和工艺条件对碘代三卤甲烷生成的影响
2018-03-06李明阳
李明阳
(沈阳化工研究院设计工程有限公司,辽宁沈阳 110021)
饮用水消毒是保障饮用水安全必不可少的工艺环节,可以有效地预防肠胃炎、霍乱、伤寒等水传播疾病[1-2]。但在消毒过程中,消毒剂(氯、氯胺、臭氧、二氧化氯、高锰酸钾等)会与水体中天然有机物(NOM)、溴离子、碘离子等发生反应,生成对人体有潜在危害的消毒副产物(DBPs)[3-4]。目前研究的DBPs广泛集中于三卤甲烷(THMs)和卤乙酸(HAAs)等具有较强“三致”特性的常规消毒副产物,各国饮用水标准均对其加以严格控制[5-11]。研究人员也开始采用氯胺、臭氧和二氧化氯等新型消毒剂代替氯消毒[12-13]来降低常规消毒副产物的生成,以满足日益严格的水质标准,但与此同时,这些消毒剂会产生如二甲基亚硝胺、卤代硝基甲烷、卤代乙酰胺、卤乙腈、碘代三卤甲烷、碘代酸等三致性更强、毒性更大的消毒副产物[13-22]。其中碘代类消毒副产物(碘代三卤甲烷和碘代乙酸,I-DBPs)由于具有强烈的毒性和臭味[23]而引起人们的广泛关注,对它们的特性分析、生成与控制等相关研究已成为领域热点[24-26]。然而目前对 I-DBPs的生成机制及影响因素的认识还不够深入,对其控制措施的总结仍不够全面,缺乏系统性。在天然饮用水水源中,I-是碘的主要存在形态。如在海洋环境中I-浓度一般可达 45~65 μg/L;在淡水环境中,I-浓度在 0.5~10 μg/L,当海水入侵或地质条件发生变化时,其浓度可超过 50 μg/L[4,27],因此存在 I-DBPs的生成风险。本文以京密引水渠原水为研究对象,研究不同消毒方式和工艺条件下碘代三卤甲烷(I-THMs)的生成规律,为I-DBPs的控制提供一定的理论支持。
1 材料与方法
1.1 主要试剂和仪器
碘 代 三 卤 甲 烷 (CHClBrI、CHBrI2、CHClI2、CHBr2I、CHCl2I和 CHI3)标准样品购自 Orchid Cellmark;三卤甲烷混合标样(Trihalomethanes Mix)、溴氯甲烷(CH2BrCl)、1,2-二溴丙烷购自 J&K Scientific;甲基叔丁基醚(MTBE)、甲醇、正己烷均是色谱纯,购自J.T.Baker化学试剂公司;无水硫酸钠(Na2SO4)优级纯、无水亚硫酸钠(Na2SO3)优级纯、硫代硫酸钠(Na2S2O3)、重铬酸钾(K2Cr2O7)优级纯、次氯酸钠(NaClO)分析纯、次溴酸钠(NaBrO)分析纯、硫酸铵((NH4)2SO4)、氯化铵(NH4Cl)、硫酸(H2SO4)、氢 氧 化 钠 (NaOH)、磷 酸 二 氢 钠(NaH2PO4)、磷酸氢二钠(Na2HPO4)、碘化钾(KI)、淀粉、葡萄糖等化学试剂购自国药集团化学试剂有限公司。溶液采用超纯水制备(18.2 Ω/cm),无水硫酸钠使用前在马弗炉中以450℃烧制2 h去除杂质。
采用棕色样品瓶避免样品见光分解,2、20、40 mL棕色样品瓶购自安捷伦公司。样品瓶用洗涤剂清洗后,分别用自来水和去离子水各冲洗至少3遍,在马弗炉中以450℃烧制2 h。带刻度玻璃器具用洗涤剂清洗后用自来水冲洗干净,并在铬酸洗液中浸泡至少1 h,后用去离子水冲洗干净,室温下晾干。
I-THMs的定量测定参考 Cancho等的方法[27],所 用 仪 器 为 气 相 色 谱 仪 GC-ECD(HP6890),毛细管柱为 DB-1非极性毛细管柱(30 m×0.25 mm×1.00 μm,胶联为 100%聚二甲基硅氧烷)。毛细管进样口温度为175℃,检测器温度为300℃。升温程序为35℃开始保持9 min,然后以1℃/min升至40℃,然后以6℃/min升至220℃保持10 min。采用不分流进样,载气为高纯氮气。
Cl/Br-THMs的定量测定参照美国标准方法[28],所 用 仪 器 为 气 相 色 谱 仪 GC-ECD(HP6890),毛细管柱为 DB-5非极性毛细管柱(30 m×0.25 mm×0.25 μm,(5%-苯基)-甲基聚硅氧烷)。毛细管进样口温度为200℃,检测器温度为350℃。升温程序为35℃开始保持12 min,然后以8℃/min升至190℃,保持3 min。采用分流进样方式,分流比为10∶1,载气为高纯氮气。
1.2 试验方法
试验水样取自京密引水渠,经过0.45 μm的膜过滤后于4℃下保存备用。经测定,水样的TOC为2.36 mg/L,UV254为 0.160 cm-1,pH 值为 7.3,I-浓度为 9.48 μg/L,Br-浓度为 147.30 μg/L。
研究采用四种消毒方式(氯消毒、氯胺消毒、HOBr消毒和 HOBr+(NH4)2SO4消毒),对水样在不同pH条件和不同碘离子浓度条件下生成的I-THMs种类和总量进行探讨。试验加入的碘离子(KI)浓度分别为 0、100、200、350、500、750、1 000、1 250、1 500、2 000 μg/L;pH 值分别调至 6.5、7.5 和8.5;按照消毒剂(以Cl2计)与TOC的质量比为4∶5加入消毒剂。充分反应24 h后,用Na2SO3进行脱氯,随后进行I-THMs和THMs的定量分析。
2 结果与讨论
2.1 氯胺消毒
如图1所示(以pH值=7.5为例),从I-THMs的生成种类来看,氯胺消毒主要生成CHI3,在不同碘离子浓度下CHI3所占比例都接近1。较低碘离子浓度下有少量 CHBrClI、CHClI2和 CHBrI2的生成;随着碘离子浓度的增大,CHI3的增加量超过CHBrClI、CHClI2和 CHBrI2,所占比例随之增大。原因可能是碘离子浓度较低时,氯胺是过量的,过量的氯胺会分解成次氯酸,Br-在次氯酸的氧化作用下生成次溴酸,次氯酸和次溴酸再与水中NOM反应生成含氯和含溴的I-THMs;随着碘离子浓度的增大,过量的碘离子能与全部氯胺反应生成HOI,所以没有氯胺分解,CHI3生成较多,而含氯和溴的I-THMs相对较少。在碘离子浓度相同的情况下,pH值从6.5升高到8.5,CHI3在 I-THMs中所占的比例逐渐增大。因为在较低的pH下,氯胺不稳定,易分解为次氯酸。
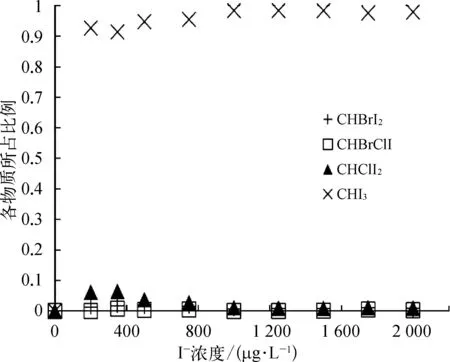
图1 pH值为7.5时氯胺消毒生成的I-THMs种类Fig.1 Varieties of I-THMs Formed after Chloramination at pH Value of 7.5
如图2所示,从生成总量来看,氯胺消毒过程中,I-THMs的生成量随碘离子浓度增大呈先增多后减少。当碘离子浓度 C(I-)= 1 500 μg/L 时,三种pH条件下,I-THMs的生成量都达到峰值,分别为 75.53 μg/L(pH 值 = 6.5)、98.70 μg/L(pH 值 =7.5)和 120.06 μg/L(pH 值= 8.5),原因可能是碘离子在过量时更易生成除I-THMs之外的其他种类的I-DBPs,抑制了 I-THMs的生成。

图2 不同pH条件下氯胺消毒生成的I-THMs总量Fig.2 Total Amount of I-THMs Formed after Chloramination under Different pH Values
氯胺消毒生成的I-THMs总量随pH升高而增加。因为在低pH条件下,氯胺不稳定,会水解产生次氯酸,次氯酸能氧化部分I-生成IO-3,IO-3不能与水中的NOM反应,因此生成的I-THMs较少;而在高pH条件下,氯胺水解反应受到抑制,I-容易被氯胺直接氧化为次碘酸,较多的次碘酸与水中NOM反应,生成了较多的I-THMs。因此建议采用氯胺消毒的水厂,在运行过程中可以将pH控制在较低的范围内(pH值≤7最佳),以减少ITHMs的生成。
2.2 氯消毒
如图3所示(以pH值=7.5为例),氯消毒过程中,六种I-THMs(CHCl2I、CHClI2、CHBr2I、CHBrI2、CHClBrI和CHI3)均有生成。在碘离子浓度较低时,CHCl2I、CHClI2和CHBrClI是主要产物;随着碘离子浓度的增大,CHI3逐渐成为主要产物,其他五种ITHMs所占的比例逐渐减小。对于生成I-THMs中CHI3所占的比例,pH的影响较为明显。当pH值=6.5、7.5和8.5时,CHI3的占比超过其他五种 ITHMs成为主要产物,所对应的碘离子浓度分别为750、500 μg/L 和 350 μg/L。

图3 pH值为7.5时氯消毒生成的I-THMs种类Fig.3 Varieties of I-THMs Formed after Chlorination at pH Value of 7.5
如图4所示,从I-THMs生成总量来看,随着碘离子浓度增大,I-THMs生成量逐渐增加。当碘离子浓度增大到2 000 μg/L时,三种pH条件下,I-THMs的生成量分别增加到 72.48 μg/L(pH 值 = 6.5)、83.00 μg/L(pH 值=7.5)和 92.97 μg/L(pH 值=8.5)。
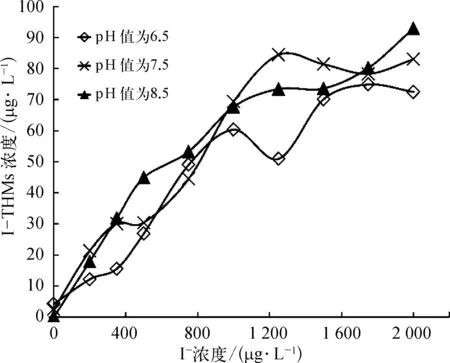
图4 不同pH条件下氯消毒生成的I-THMs总量Fig.4 Total Amount of I-THMs Formed after Chlorination under Different pH Values
pH对于氯消毒产生I-THMs总量的影响小于氯胺消毒。对于不同的碘离子浓度范围,pH会产生不同的影响。在碘离子浓度为 0~500 μg/L和1 500~2 000 μg/L,I-THMs的生成量随pH的升高而增加;而在 500~1 500 μg/L,I-THMs的产量受pH的影响不明显。由于一般水源水中碘离子的浓度在 0~500 μg/L,在此范围内,pH 值=6.5 时 ITHMs的生成量小于 pH值=7.5和8.5;而在 pH值=7.5和8.5时,I-THMs的生成量无太大差别。因此建议采用氯消毒的水厂,在运行过程中可以将pH控制在较低的范围内(pH值≤7最佳)以减少I-THMs的生成。
2.3 HOBr消毒
如图5所示(以pH值=7.5为例),在HOBr消毒过程中,含Br的I-THMs(CHBr2I和 CHBrI2)生成量明显增加。在 pH值=6.5时,有 CHBr2I、CHBrI2和CHI3这三种I-THMs生成。当 C(I-)≤1 250 μg/L 时,CHBr2I和 CHBrI2是主要产物。其中,CHBr2I生成量最多,但其占比随着碘离子浓度增大而减小;CHBrI2所占比例则随碘离子浓度的增大而增大。原因是 CHBrI2中碘的含量大于CHBr2I,高碘离子浓度条件更有利于CHBrI2的生成。当 C(I-)≥1 250 μg/L 时,CHI3是主要的 ITHMs。在pH值=7.5和8.5的条件下,除了上述三种I-THMs外,还生成了少量的CHBrClI。
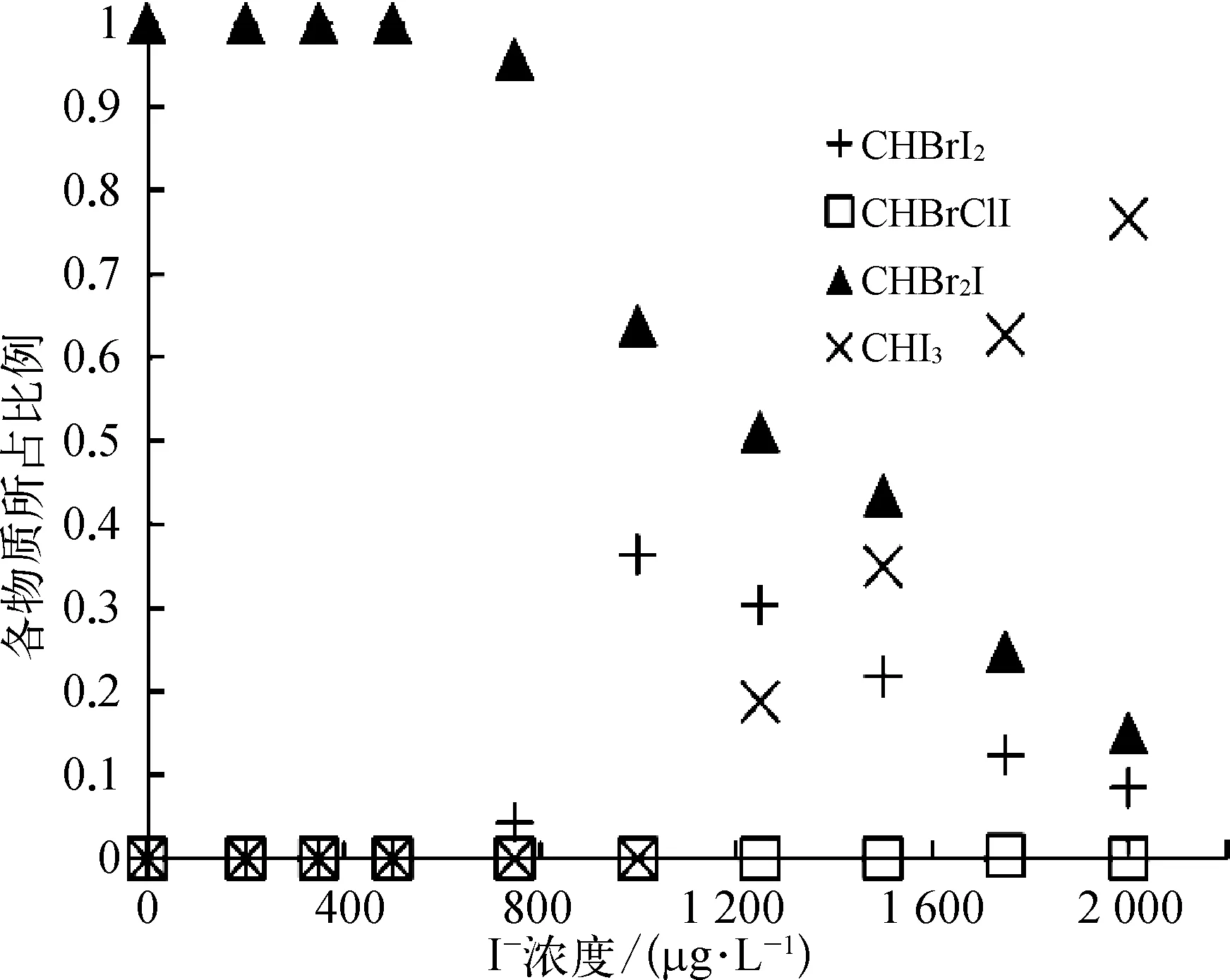
图5 pH值为7.5时HOBr消毒生成的I-THMs种类Fig.5 Varieties of I-THMs Formed after HOBr Disinfection at pH Value of 7.5
如图6(a)所示,对于含Br的I-THMs而言,其生成量随碘离子浓度先增大后减小,峰值出现在C(I-)= 1 500 μg/L 时,分别为 31.80 μg/L(pH 值=6.5)、32.46 μg/L(pH 值= 7.5)和 35.63 μg/L(pH值=8.5)。主要是由于过高的碘离子浓度有助于CHI3的生成,而CHI3的大量生成抑制了含Br的ITHMs生成。当 C(I-)≤1 000 μg/L 时,含 Br的 ITHMs的生成量随着pH的升高而减少;当C(I-)≥1 000 μg/L 时,含 Br的 I-THMs的生成量随pH无明显变化规律。
如图6(b)所示,从I-THMs的生成总量来看,随着碘离子浓度的增大,I-THMs的生成量逐渐增加。当碘离子浓度增大到2 000 μg/L时,三种pH条件下,I-THMs 的生成量分别增加至 67.77 μg/L(pH值= 6.5)、75.90 μg/L(pH 值 = 7.5)和 99.96 μg/L(pH 值=8.5)。当 C(I-)≤75 μg/L 时,随着 pH 的升高,I-THMs的生成量减少,而继续提高碘离子的浓度,I-THMs的生成量则随着pH的升高而增加。
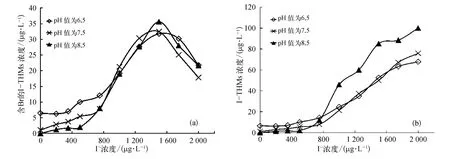
图6 不同pH条件下HOBr消毒生成的(a)含Br的I-THMs总量;(b)I-THMs总量Fig.6 Total Amount of(a)I-THMs Containing Br and(b)I-THMs Formed after HOBr Disinfection under Different pH Values
2.4 HOBr+(NH4)2SO4消毒
如图7所示(以 pH值=7.5为例),在 HOBr+(NH4)2SO4消毒的过程中,同样有含Br的I-THMs(CHBr2I和CHBrI2)生成,但其生成量少于HOBr消毒,主要是由于氨的加入,促使更多的I-被氧化为HOI,生成了更多的CHI3。随着碘离子浓度的增大,CHBr2I和CHBrI2所占比例逐渐减小。
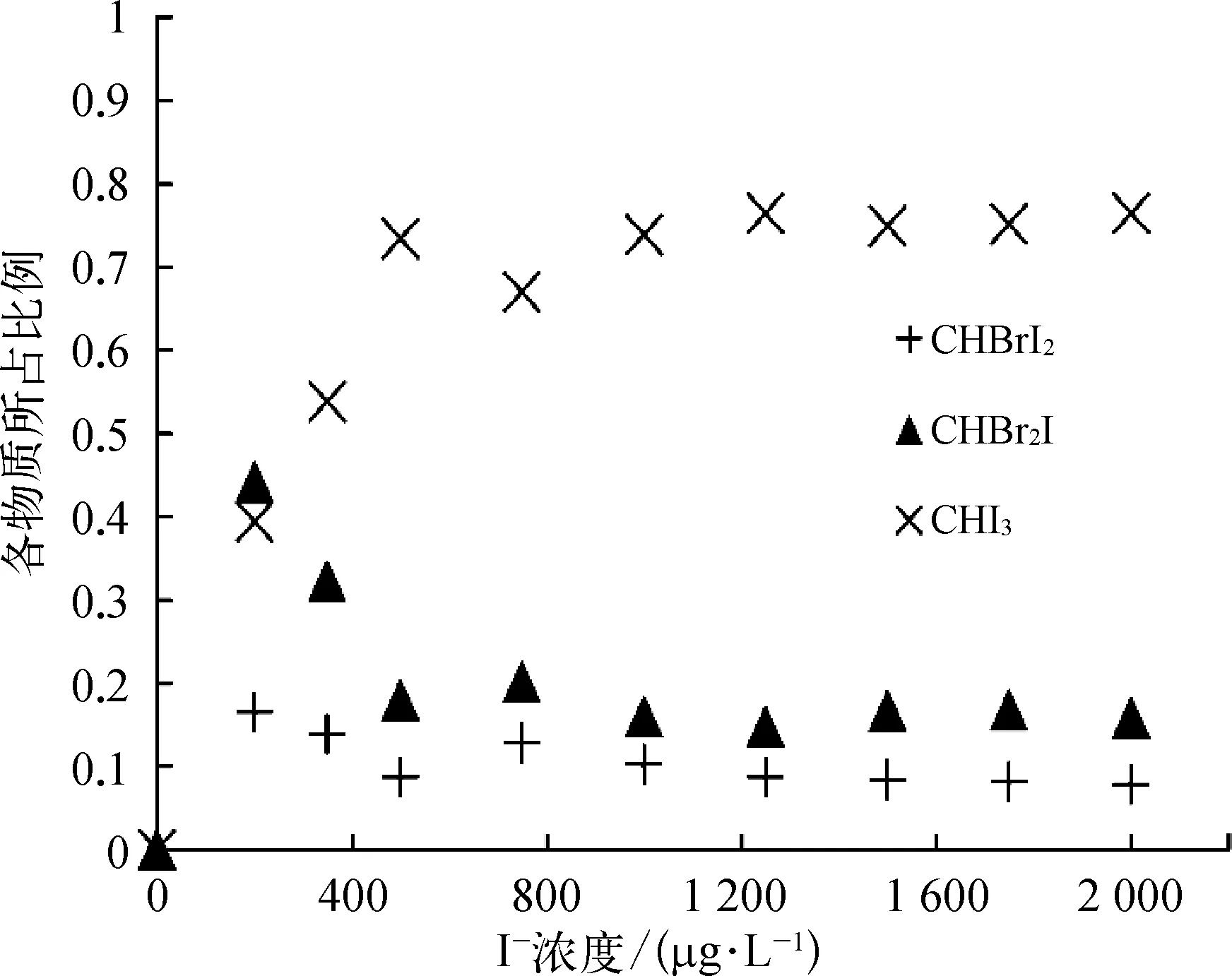
图7 pH值为7.5时HOBr+(NH4)2SO4消毒生成的I-THMs种类Fig.7 Varieties of I-THMs Formed after HOBr+(NH4)2SO4Disinfection at pH Value of 7.5
如图8(a)所示,对于含Br的I-THMs而言,随着碘离子浓度的增大,含Br的I-THMs的生成量逐渐增加。当碘离子浓度增大到2000 μg/L时,在三种pH条件下,I-THMs的生成量分别增加到32.80 μg/L(pH 值=6.5)、29.91 μg/L(pH 值=7.5)和 28.30 μg/L(pH 值=8.5)。当 C(I-)≤1 250 μg/L 时,pH 对含Br的I-THMs生成量的影响不大;而当C(I-)≥1 250 μg/L 时,pH 越高,CHI3的生成量越多,所以含Br的I-THMs的生成量随pH的升高而减少。
如图8(b)所示,从I-THMs的生成总量来看,随着碘离子浓度的增大,I-THMs的生成量逐渐增加。当碘离子浓度增大到2 000 μg/L时,三种pH条件下,I-THMs 的生成量分别增至 128.40 μg/L(pH值=6.5)、126.92 μg/L(pH 值=7.5)和 128.77 μg/L(pH 值=8.5)。I-THM的生成量受pH的影响不大,总体上I-THMs的生成量随pH升高略有增加。
2.5 I-THMs 和 Cl/Br-THMs生成总量的对比

图8 不同pH条件下HOBr+(NH4)2SO4消毒生成的(a)含Br的I-THMs总量;(b)I-THMs总量Fig.8 Total Amount of(a)I-THMs Containing Br and(b)I-THMs Formed after HOBr+(NH4)2SO4Disinfection under Different pH Values
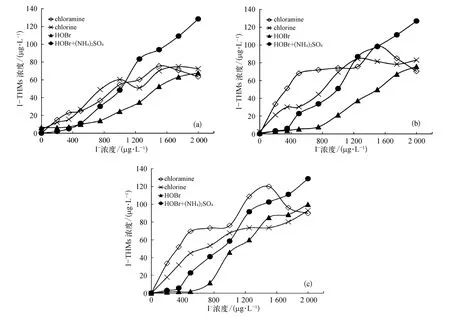
图9 不同pH条件下四种消毒方式生成I-THMs的总量对比 (a)pH 值=6.5;(b)pH 值=7.5;(c)pH值=8.5Fig.9 Comparison of Total Amount of I-THMs Formed after the Application of Four Disinfectants under Different pH Values(a)pH Value=6.5;(b)pH Value=7.5;(c)pH Value=8.5
如图 9 所示,氯、HOBr和 HOBr+(NH4)2SO4消毒过程中,I-THMs的生成量随碘离子浓度的增大而增加;而氯胺消毒过程中,I-THMs的生成量随碘离子浓度先增大而后减少。当碘离子浓度在0~1 000 μg/L时,四种消毒方式变化规律明显。pH值=6.5时,HOBr消毒产生的I-THMs最少,其次是HOBr+(NH4)2SO4消毒,而氯胺和氯消毒产生的I-THMs相近,这主要是由于在较低pH条件下氯胺不稳定,会分解产生次氯酸,它能氧化部分 I-生成IO-3,但 IO-3不能与水中NOM反应,减少了I-THMs的生成。而当pH值=7.5和8.5时,当碘离子浓度在0~1 000 μg/L时,不同消毒方式生成I-THMs的量由大到小依次为氯胺消毒>氯消毒>HOBr+(NH4)2SO4消毒>HOBr消毒。氯胺消毒产生的ITHMs明显多于氯消毒,因为在高pH条件下,氯胺能稳定存在。I-容易被氯胺直接氧化为次碘酸,较多的次碘酸与水中NOM反应,生成了较多的ITHMs。由此可见,HOBr消毒可以有效减少 ITHMs的生成,而氨的加入会促进I-THMs的生成。
对于 Cl/Br-THMs而言,总体上随着碘离子浓度的增大,Cl/Br-THMs的生成量逐渐减少。因为NOM首先与碘离子反应生成I-THMs,抑制了 Cl/Br-THMs的生成。由于实际水体中含碘量较低,所以选取 C(I-)= 100 μg/L 时的数据进行分析。由图10可知,四种消毒方式产生Cl/Br-THMs的量均随pH的升高而增加。氯消毒产生的Cl/Br-THMs最多,其次是HOBr消毒,产生最少的是氯胺消毒,再次证明氯胺消毒可以有效降低Cl/Br-THMs的生成。但考虑到氯胺消毒会产生更多的I-THMs,所以水厂在选择消毒剂时要慎重。对于类似于京密引水渠的水源而言,当TOC在2.5 mg/L左右时,HOBr消毒的效果更好,同时将pH控制在较低范围内(pH值≤7.5),既能有效减少I-THMs的生成,又不会生成更多的Cl/Br-THMs。
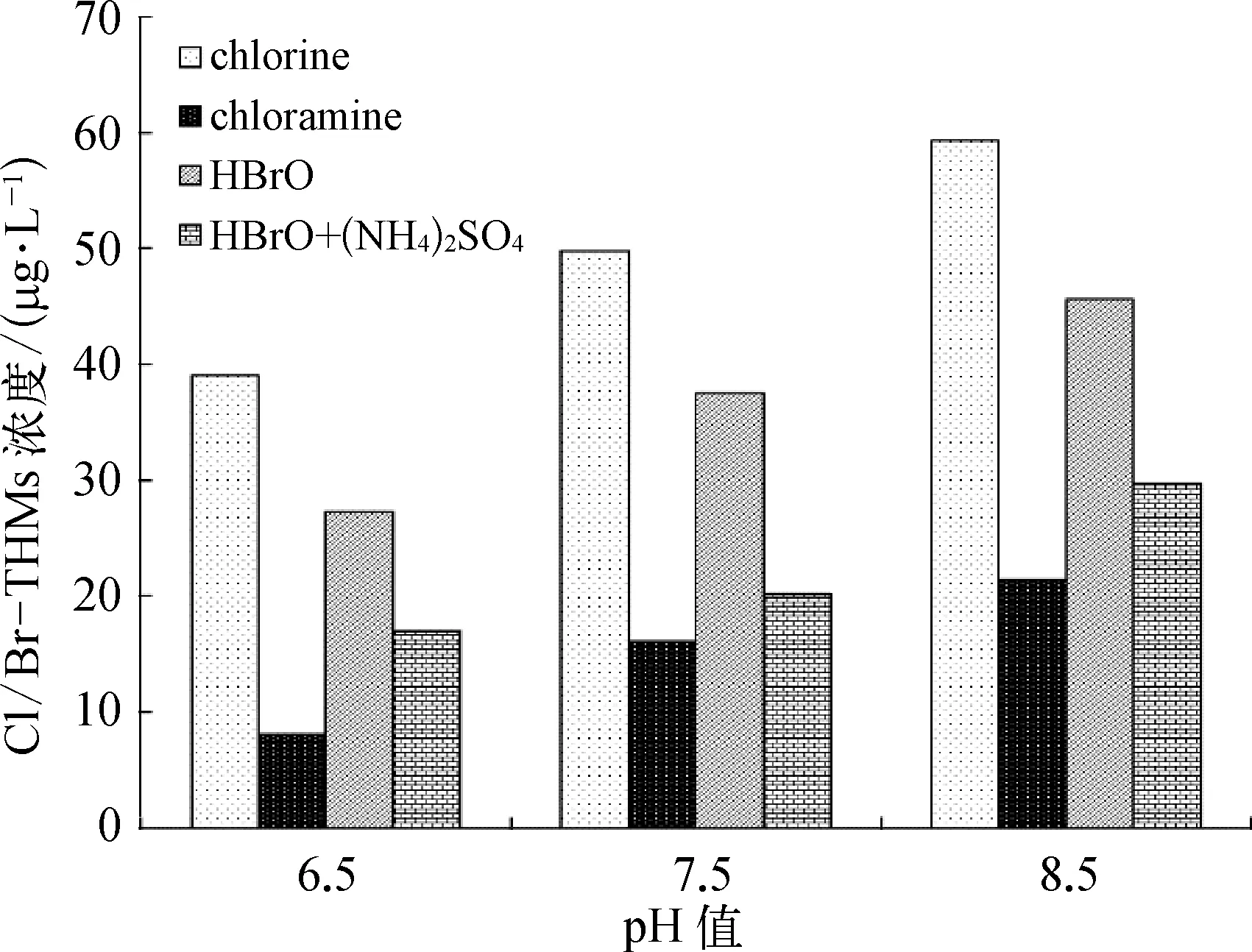
图10 不同pH条件下四种消毒方式生成Cl/Br-THMs的总量对比Fig.10 Comparison of Total Amount of Cl/Br-THMs Formed after the Application of Four Disinfectants under Different pH Values
3 结论
(1)在任何消毒方式下,较高的碘离子浓度都有利于CHI3的生成,且pH越高,越易生成 CHI3。在碘离子浓度适当的情况下,氯胺消毒主要生成CHI3;氯消毒均生成六种 I-THMs,但主要生成CHCl2I;HOBr消毒主要生成含 Br的 I-THMs(CHBr2I 和 CHBrI2),尤 其 是 CHBr2I;HOBr+(NH4)2SO4消毒,也主要生成含 Br的 I-THMs(CHBr2I和CHBrI2),由于氨的加入,其生成量没有HOBr消毒时多,但CHI3的生成量增多。
(2)四种消毒方式产生的I-THMs总量随pH的升高而增加,氯胺受pH的影响最为明显,氯胺消毒在高碘离子浓度下出现I-THMs生成量减少的现象;含Br的I-THMs的产生量随pH的升高而减少;Cl/Br-THMs的产生量随pH的升高而增加。
(3)对于京密引水渠水样,HOBr消毒可有效减少I-THMs的生成,而不会导致Cl/Br-THMs的生成量明显增加,具有一定的应用前景,值得深入研究。
[1]Akin E W,Hoff J C,Lippy E C.Waterborne outbreak control:Which disinfectant?[J].Environmental Health Perspectives,1982,46(12):7-12.
[2]Richardson S D.Disinfection by-products and other emerging contaminants in drinking water [J].TrAC Trends in Analytical Chemistry,2003,22(10):666-684.
[3]Krasner S W,McGuire M J,Jacangelo J G,et al.The occurrence of disinfection by-products in US drinking water [J].Journal-American Water Works Association,1989,81(8):41-53.
[4]魏源源,刘燕,刘东银,等.饮用水消毒碘代副产物的毒理学研究及其形成过程[J].癌变·畸变·突变,2010,22(5):404-408.
[5]Tokmak B,Capar G,Dilek F B,et al.Trihalomethanes and associated potential cancer risks in the water supply in Ankara,Turkey [J].Environmental Research,2004,96(3):345-352.
[6]Costet N,Villanueva C M,Jaakkola J J K,et al.Water disinfection by-products and bladder cancer:Is there a European specificity?A pooled and meta-analysis of European case-control studies[J].Occupational and Environmental Medicine,2011,68(5):379-385.
[7]Villanueva C M,Cantor K P,Cordier S,et al.Disinfection byproductsand bladdercancer: A pooled analysis [J].Epidemiology,2004,15(3):357-367.
[8]Bove G E,Rogerson P A,Vena J E.Case-control study of the effects of trihalomethanes on urinary bladder cancer risk [J].Archives of Environmental& Occupational Health,2007,62(1):39-47.
[9]King W D,Marrett L D,Woolcott C G.Case-control study of colon and rectal cancers and chlorination by-products in treated water[J].Cancer Epidemiology and Prevention Biomarkers,2000,9(8):813-818.
[10]Rahman M B,Driscoll T,Cowie C,et al.Disinfection by-products in drinking water and colorectal cancer:A meta-analysis [J].International Journal of Epidemiology,2010,39(3):733-745.
[11]Nieuwenhuijsen M J,Grellier J,Smith R,et al.The epidemiology and possible mechanisms of disinfection by-products in drinking water[J].Philosophical Transactions of the Royal Society of London A:Mathematical,Physical and Engineering Sciences,2009,367(1904):4043-4076.
[12]Richardson S D,Plewa M J,Wagner E D,et al.Occurrence,genotoxicity,and carcinogenicity ofregulated and emerging disinfection by-products in drinking water:A review and roadmap for research [J]. Mutation Research/Reviews in Mutation Research,2007,636(1):178-242.
[13]Krasner S W,Weinberg H S,Richardson S D,et al.Occurrence of a new generation of disinfection byproducts [J].Environmental Science& Technology,2006,40(23):7175-7185.
[14]Hua G,Reckhow D A,Kim J.Effect of bromide and iodide ions on the formation and speciation of disinfection byproducts during chlorination [J].Environmental Science& Technology,2006,40(9):3050-3056.
[15]Yang M,Zhang X.Comparative developmental toxicity of new aromatic halogenated DBPs in a chlorinated saline sewage effluent to the marine polychaete Platynereis dumerilii[J].Environmental Science& Technology,2013,47(19):10868-10876.
[16]Liu J,Zhang X.Comparative toxicity of new halophenolic DBPs in chlorinated saline wastewater effluents against a marine alga:Halophenolic DBPs are generally more toxic than haloaliphatic ones[J].Water Research,2014,65(18):64-72.
[17]Kimura S Y,Komaki Y,Plewa M J,et al.Chloroacetonitrile and N,2-dichloroacetamide formation from the reaction of chloroacetaldehyde and monochloramine in water [J].EnvironmentalScience & Technology, 2013, 47 (21):12382-12390.
[18]Wagner E D,Hsu K M,Lagunas A,et al.Comparative genotoxicity of nitrosamine drinking water disinfection byproducts in Salmonella and mammalian cells [J].Mutation Research/Genetic Toxicology and Environmental Mutagenesis,2012,741(1):109-115.
[19]Plewa M J,Wagner E D,Muellner M G,et al.Comparative mammalian cell toxicity of N-DBPs and C-DBPs[M].Washington DC:American Chemical Society,2008.
[20]Shah A D, Mitch W A. Halonitroalkanes, halonitriles,haloamides,and N-nitrosamines:A critical review of nitrogenous disinfection byproduct formation pathways [J].Environmental Science & Technology,2011,46(1):119-131.
[21]Bichsel Y,Von Gunten U.Formation of iodo-trihalomethanes during disinfection and oxidation of iodide-containing waters [J].EnvironmentalScience & Technology, 2000, 34 (13):2784-2791.
[22]Ding G,Zhang X.A picture of polar iodinated disinfection byproducts in drinking water by (UPLC/)ESI-tqMS [J].EnvironmentalScience & Technology, 2009, 43 (24):9287-9293.
[23]Hansson R C,Henderson M J,Jack P,et al.Iodoform taste complaints in chloramination [J].Water Research,1987,21(10):1265-1271.
[24]Karpel Vel Leitner N,Vessella J,Dore M,et al.Chlorination and formation of organoiodinated compounds:The important role of ammonia [J].Environmental Science & Technology,1998,32(11):1680-1685.
[25]Richardson S D,Fasano F,Ellington J J,et al.Occurrence and mammalian cell toxicity of iodinated disinfection byproducts in drinking water[J].Environmental Science & Technology,2008,42(22):8330-8338.
[26]Plewa M J,Wagner E D.Quantitative comparative mammalian cell cytotoxicity and genotoxicity of selected classes of drinking water disinfection by-products[C].Denver CO:American Water Works Research Foundation,2009.
[27]Cancho B,Ventura F,Galceran M T,et al.Determination,synthesisand survey ofiodinated trihalomethanesin water treatment processes [J].Water Research,2000,34(13):3380-3390.
[28]Method 552.3:Determination of haloacetic acids and dalapon in drinking water by liquid-liquid microextraction,derivatization,and gas chromatography with electron capture detection:EPA 815-B-03-002 [S].
