黄连素抑制直肠癌SW480细胞增殖的实验研究*
2018-03-06彭洪林中超彭明沙祝秀华刘娟南充市中心医院中西医结合肛肠科四川南充637000
彭洪 林中超 彭明沙 祝秀华 刘娟(南充市中心医院中西医结合肛肠科, 四川 南充 637000)
结直肠癌是亚太地区最常见的恶性肿瘤之一, 死亡率较高[1], 其病因尚不明确。目前外科手术是直肠癌的主要治疗方式, 但是30%的患者术后可出现复发或转移[2]。因此探索新的治疗方式, 已成为治疗直肠癌的热点。
黄连素是一种喹啉生物碱, 很多重要的药用植物比如刺芒和紫叶小檗都含有黄连素, 并且黄连素还具有止泻、降压、降血糖和抗炎等作用[3-5]。近年的研究发现黄连素对多种肿瘤细胞均表现出抗肿瘤效果, 如神经胶质瘤、食管癌、肺癌、前列腺癌和卵巢癌[6-10]。黄连素可通过诱导细胞凋亡, 抑制肿瘤细胞增殖和阻止肿瘤侵袭、转移来发挥抗癌作用, 这些研究结果提示黄连素未来在临床上有望作为一种化疗药物而加以使用。但黄连素抗肿瘤的具体作用机制却知之甚少。本研究的目的是观察黄连素对直肠癌SW480细胞增殖的抑制效果并探讨其可能的作用机制。
1 材料与方法
1.1 细胞培养与试剂 人直肠癌SW480细胞株购自重庆医科大学基础研究所, 在含有10%胎牛血清, 1%青霉素和1%链霉素的RPMI-1640培养基里培养。黄连素(C20H18ClNO4)购自圣元公司(郑州, 河南)。Ang-2 ELISA试剂盒购自晶美生物工程有限公司(深圳, 中国)。
1.2 方法
1.2.1 细胞增殖检测 直肠癌SW480细胞株以每孔1×105个接种于96孔板, 培养24小时后分别加入浓度为0mol/L、25μmol/L、50μmol/L、100μmol/L、150μmol/L、200μmol/L的黄连素, 继续培养48小时。每孔加MTT 20ul, 4小时后弃上清液。然后每孔加二甲基亚砜(DMSO)150ul, 震荡10分钟后于490nm处测定吸光度(A)值。实验重复进行3次。抑制率公式: 抑制率(%)=(对照组A值-治疗组A值)/对照组A值×100%。治疗组黄连素浓度分为6个亚型, 分别为0mol/L 、25μmol/L、50μmol/L、100μmol/L、150μmol/L、200μmol/L, 并计算不同亚型的抑制率。结果示黄连素作用48小时后的最佳抑制浓度为150μmol/L, 因此在后续实验中我们选用150μmol/L的黄连素作为治疗组用药。
1.2.2 细胞周期检测 直肠癌SW480细胞株以每孔2×105个接种于6孔板过夜, 当细胞80%融合时治疗组用150μmol/L黄连素干预48小时, 对照组用RPMI-1640培养基。48小时后收集各组细胞, 按照说明进行流式细胞分析。
1.2.3 细胞凋亡检测 直肠癌SW480细胞株以每孔2×105个接种于6孔板过夜, 当细胞80%融合时治疗组用150μmol/L黄连素干预48小时, 对照组用RPMI-1640培养基。48小时后收集各组细胞, 参照说明书, 按照Annexin V凋亡分析法进行染色(碧云天生物技术有限公司, 上海, 中国)。然后凋亡指数通过计算Annexin V阳性细胞(红染色)数进行分析, 每组10个样本。
1.2.4 免疫印迹分析 直肠癌SW480细胞株以每孔2×105个接种于6孔板过夜, 当细胞80%融合时用不同方式进行处理。治疗组用150μmol/L黄连素干预48小时, 对照组用RPMI-1640培养基。48小时后收集各组细胞, 按照说明进行免疫印迹分析。Livin、Ykl-40、AKT and Cyclin D1蛋白的表达用Quantity One图像分析软件进行吸光度分析。
1.2.5 Ang-2 表达的检测 直肠癌SW480细胞株以每孔2×105个接种于24孔板过夜, 当细胞80%融合时治疗组用150μmol/L黄连素作用48小时, 对照组用RPMI-1640培养基。48小时后按照说明进行酶联免疫吸附测定。于450nm处测定吸光度(A)值。以标准品浓度为横坐标、A值作纵坐标绘制标准曲线。通过标准品的A值可在标准曲线上查出Ang-2的浓度。

2 结果
2.1 细胞增殖比较 随着黄连素作用浓度的增高(0~200μmol/L), SW480细胞增殖率明显降低。但是当黄连素作用浓度在150~200μmol/L之间时, 抑制率无明显差异(P>0.05), 说明黄连素作用于SW480细胞48小时后最佳抑制浓度为150μmol/L, 因此在后续实验中选用150μmol/L的黄连素作为治疗组的用药, 见表1。
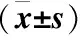
Table1CellproliferationafterculturewithdifferentBBRconcentration
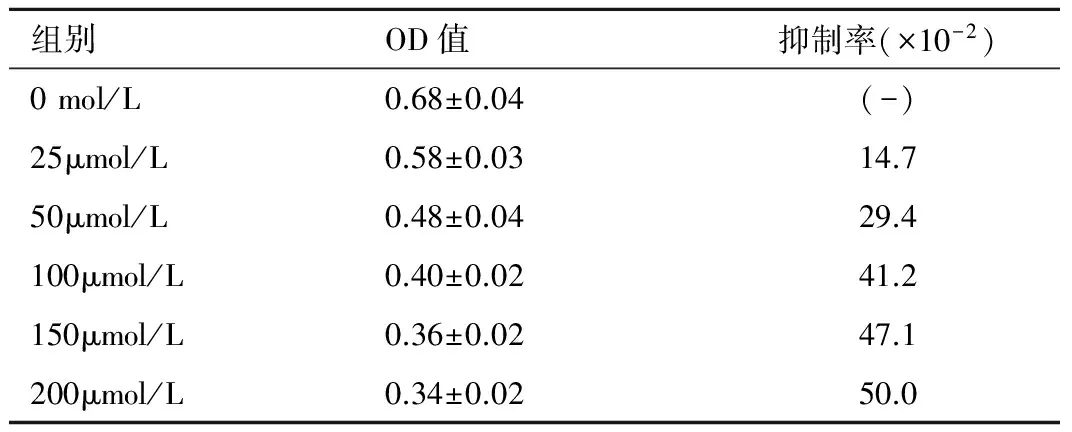
组别OD值抑制率(×10-2)0mol/L0.68±0.04(-)25μmol/L0.58±0.0314.750μmol/L0.48±0.0429.4100μmol/L0.40±0.0241.2150μmol/L0.36±0.0247.1200μmol/L0.34±0.0250.0
2.2 两组细胞周期比较 结果显示治疗组中78.98%的细胞被阻滞在G1期, 而对照组有65.76%的细胞被阻滞在G1期。说明黄连素可通过阻滞细胞周期在G1期而抑制SW480细胞增殖, 见表2、图1。
表2 细胞周期分析Table 2 Cell cycle analysis
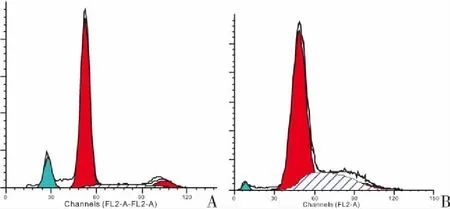
图1 细胞周期分析Figure 1 Cell cycle analysis注:A.治疗组;B.对照组
2.3 两组细胞凋亡比较 结果显示, 与对照组相比, 治疗组细胞存在更大比例的凋亡。结果说明黄连素对SW480细胞具有明显的抑制作用, 见表3、图2。
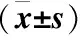
表3 SW480细胞凋亡率Table 3 Apoptpsis index of SW480 cells
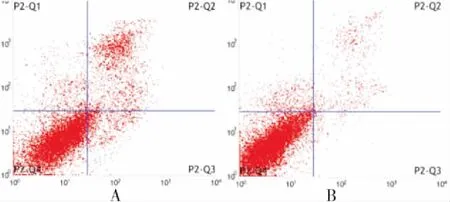
图2 SW480细胞凋亡Figure 2 Apoptpsis of SW480 cells注: A.治疗组; B.对照组
2.4 两组YKL-40、AKT、Cyclin D1蛋白表达比较 进一步研究是否YKL-40/AKT/Cyclin D1信号通路参与黄连素介导的细胞周期阻滞, 结果显示与对照组相比, 治疗组中YKL-40(几丁质酶-3样蛋白-1)、pAKT(phosphorylated protein kinase B, 磷酸化蛋白激酶B, 为AKT的活性形式)、Cyclin D1(特异性周期蛋白D1)在SW480细胞内的表达明显下降, 但是总AKT(protein kinase B, 蛋白激酶B)表达无明显变化。结果说明YKL-40/AKT/Cyclin D1信号通路参与黄连素介导的SW480细胞周期阻滞及抑制细胞增殖,见图3。
图3 YKL-40 表达AKT及pAKT、Cyclin D1 表达
Figure3YKL-40expression,AKTexpressionandCyclinD1expression
注:A、C、F为对照组;B、D、E为治疗组
2.5 两组Livin蛋白表达比较 为进一步研究黄连素诱导细胞凋亡的机制, 检测凋亡相关基因表达。结果显示与对照组相比, 抗凋亡基因Livin(凋亡抑制蛋白)在治疗组细胞中的表达明显下降。说明黄连素可通过抑制Livin蛋白的表达而诱导细胞凋亡,见图4。

图4 Livin 表达Figure 4 Livin expression注:A.治疗组.B.对照组
2.6 两组Ang-2表达水平比较 用ELISA方法检测两组Ang-2(血管生成素-2)表达情况, 结果显示治疗组中Ang-2表达水平(28.9±2.47)ng/mL明显较对照组(40.2±2.35)ng/mL下降(t=10.49,P<0.05), 上述结果证实抑制肿瘤血管的生成是黄连素抗肿瘤的作用机制之一。
3 讨论
既往研究证实黄连素对多种肿瘤均具有明显的抑制作用。但其抑制直肠癌SW480细胞的具体作用机制却罕见。本研究结果显示随着黄连素作用浓度的增加(25~200μmol/L), SW480细胞增殖率明显降低, 其部分原因可能是因为78.98%的SW480细胞被阻滞在G1期。接下来我们研究了导致细胞周期阻滞的具体机制。YKL-40是哺乳动物甲壳质酶样蛋白家族的一员, 现有研究证实其与多种肿瘤(包括直肠癌)的发病密切相关[11-15]。近来有研究发现Brp-39(小鼠YKL-40基因所编码的蛋白)能直接作用于管状细胞启动PI 3-K/Akt信号通路, 同时有研究证实在结肠上皮细胞中YKL-40的几丁质结合域可特异性激活AKT信号通路[16-17]。并且沉默YKL-40基因可通过阻滞细胞在G1期而抑制细胞增殖[18]。所以我们推测是否YKL-40/AKT信号通路参与了黄连素介导的SW480细胞周期阻滞。本实验中黄连素可明显抑制YKL-40、AKT和它的靶基因Cyclin D1蛋白的表达, 其结果证实了黄连素可通过抑制YKL-40/AKT/Cyclin D1信号通路阻滞SW480细胞周期。有研究发现低剂量的YKL-40作用于SW480细胞可导致明显的β-catenin核转位并激活c-Myc和cyclin D1等靶基因的转录, 随后通过调节细胞周期G0/G1期从而促进SW480细胞的增殖[19]。总的说来, 我们的研究证实黄连素可抑制SW480细胞增殖, 其机制可能部分通过抑制YKL-40/AKT/Cyclin D1信号通路和诱导细胞周期阻滞而实现的。
诱导细胞凋亡是肿瘤治疗的重要方法之一。在本实验中我们发现黄连素作用后的SW480细胞凋亡率明显高于对照组, 其作用机制可能归因于Livin基因表达的下调。Livin是凋亡抑制蛋白(IAP)家族的新成员, 其可选择性的和凋亡调节因子比如caspase-3, caspase-7, 和caspase-9等结合最后阻止细胞凋亡[20-21]。Livin在多种肿瘤组织中高表达, 但在正常组织中却几乎不表达, 并且它和细胞的增殖、侵袭及运动密切相关[22-25]。既往研究发现在体内和体外实验中siRNA介导的livin表达下调可诱导结肠癌细胞的凋亡, 不仅如此, 沉默Livin基因还可以增强结肠癌细胞的化疗敏感性[26-27]。但是黄连素与livin表达之间的关系尚却未见报道。本研究证实黄连素诱导SW480细胞凋亡, 至少部分是通过Livin所介导的。这些研究结果说明Livin在直肠肿瘤的发病中扮演着重要的角色, 增加Livin的表达可作为直肠肿瘤治疗的新策略之一。
血管生成是结直肠癌发生发展所必需的[28]。Ang-2是血管生成素家族的一员, 其可与内皮特异性受体酪酸激酶2(Tie2)结合, 通过调节血管稳定性来维持正常血管功能[29]。Ang-2在肺癌、口腔癌、鼻咽癌和肾癌等多种肿瘤中均呈明显的高表达[30-33]。Ang-2的表达在结肠癌患者及结直肠动物模型中均明显升高, 并且血清中Ang-2水平对于预测转移性结直肠癌不良预后具有重要意义[34-35]。Ang-2在肿瘤进展期能够诱导无序血管重新组织, 并且还可以快速增加毛细血管直径, 重构基底膜, 促进内皮细胞的增殖和转移和刺激新生血管的生成[36-37]。同时Ang-2还可通过诱导异常上皮-间质转化促进肿瘤的迁移和侵袭[38]。Ang-2在多种人类恶性肿瘤中均高表达, 但是在正常人群中却没有明显表达, 这为抗肿瘤治疗提供了新的靶向目标。在动物模型中阻断Ang/Tie2信号通路可以防止髓细胞的招募, 而阻断Ang-2的功能则可限制肿瘤的转移[39-40]。目前一种阻断Ang-2的功能用于治疗卵巢癌的抗体目前已进入第三期临床试验[41]。近来研究证实黄连素是一种抗血管生成因子, 它不仅可降低乳腺肿瘤的血管密度, 并且还可以通过抑制PI-3K/AKT信号通路阻止TPA诱导的血管内皮生长因子(VEGF)的生成[42-43]。但是关于黄连素和Ang2之间相互作用机制的研究却未见报道。本实验结果显示黄连素能明显下调SW480细胞中Ang2的表达水平, 证实了抑制肿瘤血管的生成是黄连素抗肿瘤的作用机制之一。
4 结论
本文资料显示, 黄连素具有抗肿瘤作用, 不仅能够抑制SW480细胞的增殖, 还可以阻滞细胞周期, 诱导细胞凋亡及抑制肿瘤血管生成。抑制YKL-40/AKT/Cyclin D1信号通路, 下调Livin和Ang-2的表达可能是黄连素抗肿瘤的重要作用机制。但还需要采用动物实验评价黄连素的抑癌效果, 其具体的作用机制也有待进一步研究。
[1]Zhiqin W, Palaniappan S, Raja AR.Inflammatory Bowel Disease-related Colorectal Cancer in the Asia-Pacific Region: Past, Present, and Future[J].Intestinal Res, 2014, 12(3): 194-204.
[2]Aklilu M, Eng C.The current landscape of locally advanced rectal cancer[J].Nat Rev Clin Oncol, 2011, 8(11): 649-659.
[3]Amripal S, Sanjiv D, Navpreet K,etal.Berberine: alkaloid with wide spectrum of pharmacological activities[J].J Nat Prod, 2010, 3: 64-75.
[4]Abd El-Wahab AE, Ghareeb DA, Sarhan EE,etal.In vitro biological assessment of Berberis vulgaris and its active constituent, berberine: antioxidants, anti-acetylcholinesterase, anti-diabetic and anticancer effects[J].BMC Complement Altern Med, 2013, 9(13): 218.
[5]Qadir SA, Kwon MC, Han JG,etal.Effect of different extraction protocols on anticancer and antioxidant activities of Berberis koreana bark extracts[J].J Biosci Bioeng, 2009, 107(3): 331-339.
[6]Chen Q, Qin R, Fang Y,etal.Berberine Sensitizes Human Ovarian Cancer Cells to Cisplatin Through miR-93/PTEN/Akt Signaling Pathway[J].Cellular physiology and biochemistry, 2015, 36(3): 956-965.
[7]Liu Q, Xu X, Zhao M,etal.Berberine induces senescence of human glioblastoma cells by downregulating the EGFR-MEK-ERK signaling pathway[J].Molecular cancer therapeutics, 2015, 14(2): 355-363.
[8]Lu JJ, Fu L, Tang Z,etal.Melatonin inhibits AP-2beta/hTERT, NF-kappaB/COX-2 and Akt/ERK and activates caspase/Cyto C signaling to enhance the antitumor activity of berberine in lung cancer cells[J].Oncotarget, 2016, 7(3): 2985-3001.
[9]Mishan MA, Ahmadiankia N, Matin MM,etal.Role of Berberine on molecular markers involved in migration of esophageal cancer cells[J].Cellular and molecular biology (Noisy-le-Grand, France), 2015, 61(8): 37-43.
[10] Tian Y, Zhao L, Wang Y,etal.Berberine inhibits androgen synthesis by interaction with aldo-keto reductase 1C3 in 22Rv1 prostate cancer cells[J].Asian journal of andrology, 2015, 18(4): 607-612.
[11] Chiang YC, Lin HW, Chang CF,etal.Overexpression of CHI3L1 is associated with chemoresistance and poor outcome of epithelial ovarian carcinoma[J].Oncotarget, 2015, 6(37): 39740-39755.
[12] Zheng X, Xing S, Liu XM,etal.Establishment of using serum YKL-40 and SCCA in combination for the diagnosis of patients with esophageal squamous cell carcinoma[J].BMC Cancer, 2014, 7(14): 490.
[13] K rankaya Güne A, Gül , Tutar N,etal.The place of YKL-40 in non-small cell lung cancer[J].Tuberk Toraks, 2014, 62(4): 273-278.
[14] Vom Dorp F, Tschirdewahn S, Niedworok C,etal.Circulating and Tissue Expression Levels of YKL-40 in Renal Cell Cancer[J]. J Urol, 2016, 195(4): 1120-1125.
[15] Johansen JS, Christensen IJ, J rgensen LN,etal. Serum YKL-40 in risk assessment for colorectal cancer: a prospective study of 4, 496 subjects at risk of colorectal cancer[J].Cancer Epidemiol Biomarkers Prev, 2015, 24(3): 621-626.
[16] Schmidt IM1, Hall IE, Kale S,etal.Chitinase-Like Protein Brp-39/YKL-40 Modulates the Renal Response to Ischemic Injury and Predicts Delayed Allograft Function[J].J Am Soc Nephrol, 2013, 24(2): 309-319.
[17] Chen CC, Llado V, Eurich K,etal.Carbohydrate-binding motif in chitinase 3-like 1 (CHI3L1/YKL-40) specifically activates Akt signaling pathway in colonic epithelial cells[J].Clin Immunol, 2011, 140(3): 268-275.
[18] Zhang W, Kawanishi M, Miyake K,etal.Association between YKL-40 and adult primary astrocytoma[J].Cancer, 2010, 116(11): 2688-2697.
[19] .Eurich K, Segawa M, Toei-Shimizu S,etal.Potential role of chitinase 3-like-1 in inflammation-associated carcinogenic changes of epithelial cells[J].World J Gastroenterol, 2009, 15(42): 5249-5259.
[20] Chang H, Schimmer AD.Livin/melanoma inhibitor of apoptosis protein as a potential therapeutic target for the treatment of malignancy[J].Mol Cancer Ther, 2007, 6(1): 24-30.
[21] Salvesen GS, Duckett CS.IAP proteins: blocking the road to death’s door[J].Nat Rev Mol Cell Biol, 2002, 3(6): 401-410.
[22] Xi RC, Sheng YR, Chen WH,etal.Expression of survivin and Livin predicts early recurrence in non-muscle invasive bladder cancer[J].J Surg Oncol, 2013, 107(5): 550-554.
[23] Choi J, Hwang YK, Sung KW,etal.Expression of Livin, an antiapoptotic protein, is an independent favorable prognostic factor in childhood acute lymphoblastic leukemia[J].Blood,2007, 109(2): 471-477.
[24] Xiang Y, Yao H, Wang S,etal.Prognostic value of Survivin and Livin in nasopharyngeal carcinoma[J].Laryngoscope, 2006, 116(1): 126-130.
[25] Liu H, Wang S, Sun H,etal.Inhibition of tumorigenesis and invasion of hepatocellular carcinoma by siRNA-mediated silencing of the livin gene[J].Mol Med Rep, 2010, 3(6): 903-907.
[26] Oh BY, Lee RA, Kim KH.siRNA targeting Livin decreases tumor in a xenograft model for colon cancer[J].World J Gastroenterol, 2011, 17(20): 2563-2571.
[27] Ding ZY, Liu GH, Olsson B,etal.Upregulation of the antiapoptotic factor Livin contributes to cisplatin resistance in colon cancer cells[J].Tumour Biol, 2013, 34(2): 683-693.
[28] Mihalache A, Rogoveanu I.Angiogenesis factors involved in the pathogenesis of colorectal cancer[J].Curr Health Sci J, 2014, 40(1): 5-11.
[29] Hu B, Cheng SY.Angiopoietin-2: Development of inhibitors for cancer therapy[J]. Curr Oncol Rep, 2009, 11(2): 111-116.
[30] Fawzy A, Gaafar R, Kasem F,etal.Importance of serum levels of angiopoietin-2 and survivin biomarkers in non-small cell lung cancer[J].J Egypt Natl Cancer Inst, 2012, 24(1): 41-45.
[31] Li C, Sun CJ, Fan JC,etal. Angiopoietin-2 expression is correlated with angiogenesis and overall survival in oral squamous cell carcinoma[J].Med Oncol, 2013, 30(2): 571.
[32] Chen HH, Weng BQ, Cheng KJ,etal. Effect of the vascular endothelial growth factor expression level on angiopoietin-2-mediated nasopharyngeal carcinoma growth[J].Vasc Cell, 2014, 6(1): 4.
[33] Rautiola J, Lampinen A, Mirtti T,etal.Association of Angiopoietin-2 and Ki-67 Expression with Vascular Density and Sunitinib Response in Metastatic Renal Cell Carcinoma[J].PloS One, 2016, 11(4) : e0153745.
[34] Goede V, Coutelle O, Neuneier J,etal.Identification of serum angiopoietin-2 as a biomarker for clinical outcome of colorectal cancer patients treated with bevacizumab-containing therapy[J].Br J Cancer, 2010, 103(9): 1407-1414.
[35] Liu WX, Gu SZ, Zhang S,etal.Angiopoietin and vascular endothelial growth factor expression in colorectal disease models[J].World J Gastroenterol, 2015, 21(9): 2645-2650.
[36] Falcon BL, Hashizume H, Koumoutsakos P,etal.Contrasting actions of selective inhibitors of angiopoietin-1 and angiopoietin-2 on the normalization of tumor blood vessels[J].Am J Pathol, 2009, 175(5): 2159-2170.
[37]Lobov IB, Brooks PC and Lang RA.Angiopoietin-2 displays VEGF-dependent modulation of capillary structure and endothelial cell survival in vivo[J].Proc Natl Acad Sci U S A, 2009, 99(17): 11205-11210.
[38] Li C, Li Q, Cai Y,etal.Overexpression of angiopoietin 2 promotes the formation of oral squamous cell carcinoma by increasing epithelial-mesenchymal transition-induced angiogenesis[J].Cancer Gene Ther, 2016, 23(9): 295-302.
[39] Huang H, Lai J-Y, Do J,etal.Specifically targeting angiopoietin-2 inhibits angiogenesis, Tie2-expressing monocyte infiltration, and tumor growth[J].Clin Cancer Res, 2011, 17(5): 1001 - 1011.
[40] Mazzieri R, Pucci F, Moi D,etal.Targeting the ANG2/TIE2 axis inhibits tumor growth and metastasis by impairing angiogenesis and disabling rebounds of proangiogenic myeloid cells[J].Cancer cell, 2011, 19(4): 512-526.
[41] Monk BJ, Poveda A, Vergote I,etal.Anti-angiopoietin therapy with trebananib for recurrent ovarian cancer (TRINOVA-1): a randomised, multicentre, double-blind, placebo-controlled phase 3 trial[J].Lancet Oncol, 2014, 15(8): 799 - 808.
[42] Pierpaoli E, Damiani E, Orlando F,etal.Antiangiogenic and antitumor activities of berberine derivative NAX014 compound in a transgenic murine model of HER2/neu-positive mammary carcinoma[J].Carcinogenesis, 2015, 36(10): 1169-1179.
[43] Kim S, Oh SJ, Lee J,etal.Berberine suppresses TPA-induced fibronectin expression through the inhibition of VEGF secretion in breast cancer cells[J].Cell Physiol Biochem, 2013, 32(5): 1541-1550.
