例析“电子得失守恒法”配平氧化还原反应方程式的技巧和策略
2018-03-05金宇
金 宇
(浙江省兰溪市第三中学)
氧化还原反应是在日常生活、工农业生产和现代科技中经常遇到的一类重要的化学反应。它贯穿中学化学学习的全过程,是学习中学化学的主线和关键之一。其中,氧化还原方程式的配平问题在化学教学中既是重点,也是难点,还是高考常考的热点问题。在众多的配平方法中,电子得失守恒法配平是最基本的配平方法之一,学生掌握得好坏,将直接影响到氧化还原方程式配平的学习。下面笔者结合自己多年的教学经验,就其配平方法谈谈技巧和策略,供参考。
一、电子得失守恒法配平步骤
用氧化剂得电子总数与还原剂失电子的总数相等来进行配平的方法,叫电子得失法。以C+HNO3——CO2↑+NO2↑+H2O为例,其配平步骤为:
(一)标变价
根据化合价升降规律只标出变价元素的化合价。
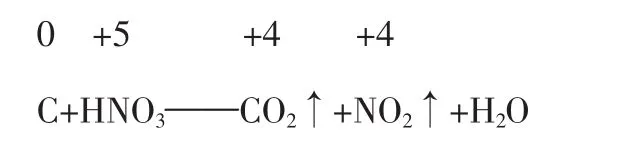
(二)调整系数
反应物和产物中变价原子数不同时,可以先添加系数。
(三)求转移电子数
根据得失电子数的最小公倍数确定标准物的系数。通常选用化合价变化情况单一的1mol的氧化剂(或还原产物)和1mol的还原剂(或氧化产物)作标准,根据元素的变价求出1mol的氧化剂(或还原产物)和1mol的还原剂(或氧化产物)中所有变价元素的得失电子数。该步是电子得失守恒法配平氧化还原反应方程式的关键,配平技巧就是如何确定得失电子数的方法。

(四)根据得失电子数的最小公倍数求标准物的系数
确定 C、HNO3、CO2、NO2的系数分别为 1、4、1、4。
C+4HNO3——CO2↑+4NO2↑+H2O
(五)依据元素守恒,配平方程式
利用观察法配平未参加反应的元素原子个数,使反应方程式满足质量守恒规律。通常在配平未变价的原子时,先确定氧化剂、还原剂、氧化产物、还原产物的系数,再确定其他物质的系数(通常先配H,然后配O)。
(六)检查所配方程式,将短线改为等号
C+4HNO3=CO2↑+4NO2↑+2H2O
检查氧化还原反应方程式是否配平,要看是否满足得失电子守恒、质量守恒和电荷守恒,若是离子型氧化还原反应,检查电子得失守恒最稳妥,检查电荷守恒最方便。
二、电子得失守恒法的具体分类
由于氧化还原反应类型的不同,利用电子得失守恒法配平时常选用不同的方法进行。这些方法包括:正向配平法、逆向配平法、左右同时配平法、平均价态配平法、零价配平法等,其本质都是得失电子总数相等。
(一)正向配平法
即先确定氧化剂和还原剂系数的方法。
例1配平Pt+HNO3+HCl——H2PtCl6+NO↑+H2O
解析:本题属于“一对一”(即一种氧化剂对应一种还原产物,一种还原剂对应一种氧化产物)的简单类型,在确定系数时,常由左至右便能较快地配平。
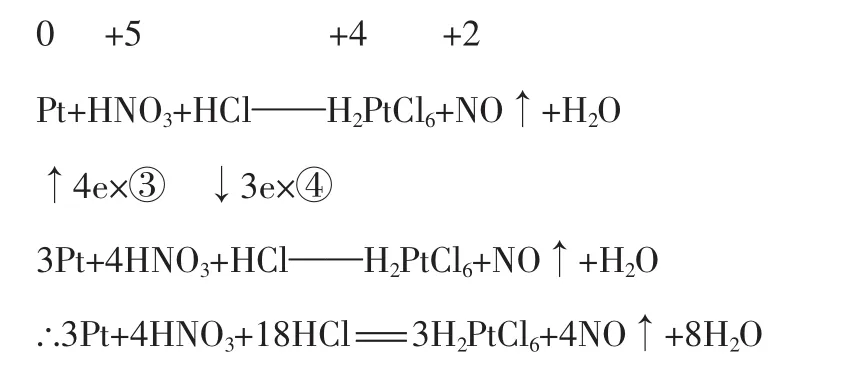
例2配平FeS2+O2——Fe2O3+SO2
解析:本题属于“一对二”(即一种还原剂被氧化成两种氧化产物)的类型,在确定系数时,先左后右较为方便。
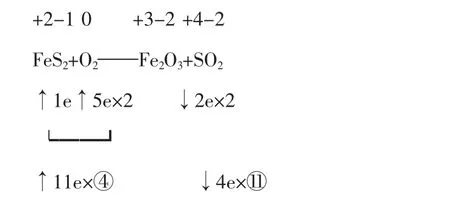
即4FeS2+11O2——Fe2O3+SO2
所以有4FeS2+11O2=2Fe2O3+8SO2
(二)逆向配平法
有时,以反应物作为配平的起点物质,往往难以解决问题,但若从生成物中确定首先配平的物质,可使问题迎刃而解,这就是“逆向法”(即在确定系数时,先右后左)。这种方法适用的类型有:①歧化反应;②还原剂(或氧化剂)中只有一种元素变价,而氧化剂(或还原剂)中某元素只有部分变价的反应。
例3配平KMnO4+HCl——MnCl2+KCl+Cl2↑+H2O
解析:氧化剂中只有锰元素变价,而还原剂的氯元素有一部分变价,另一部分没有变价。配平时,先确定MnCl2和Cl2的系数。
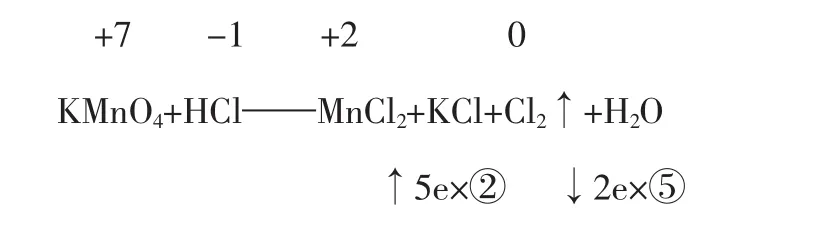
即KMnO4+HCl——2MnCl2+KCl+5Cl2↑+H2O
配平得:2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O
(三)左右同时配平法
当还原剂(或氧化剂)转化为多种产物,氧化剂(或还原剂)中某种元素只有一部分变价,则选取还原剂和还原产物(或氧化剂和氧化产物)同时确定系数,即左右两边同时各确定一种物质的系数。
例4配平Cu2S+HNO3——Cu(NO3)2+NO↑+H2SO4+H2O
解析:还原剂Cu2S氧化后转化为两种产物(硝酸铜和硫酸),而氧化剂HNO3中的氮元素只有一部分转化为NO,配平时先确定Cu2S和NO的系数。
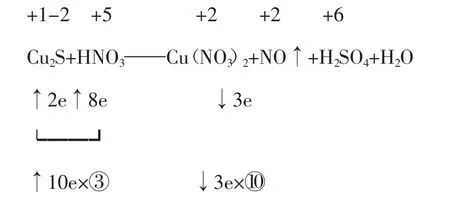
即3Cu2S+HNO3——Cu(NO3)2+10NO↑+H2SO4+H2O
配平得:3Cu2S+22HNO3=6Cu(NO3)2+10NO↑+3H2SO4+8H2O
(四)平均价态配平法
即对某元素取化合价平均值进行配平的方法。当反应物(或产物)中某种元素化合价难确定的时候,采用此法较为方便。
例5配平K2Cr2O7+H2C2O4+H2SO4——K2SO4+Cr2(SO4)3+CO2↑+H2O
解析:草酸中碳元素的化合价,可根据氢、氧化合价取其平均值+3进行配平。先确定氧化剂和还原剂的系数。
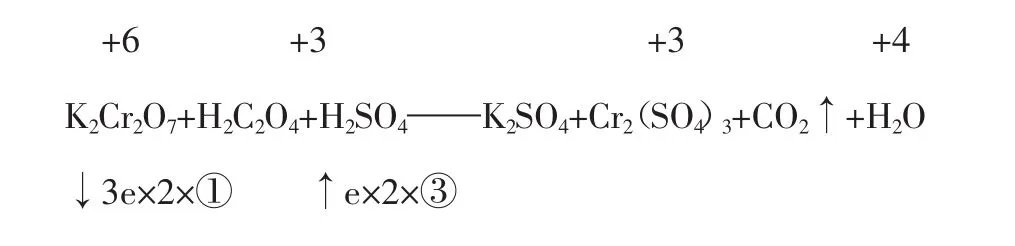
即K2Cr2O7+3H2C2O4+H2SO4——K2SO4+Cr2(SO4)3+CO2↑+H2O
配平得:K2Cr2O7+3H2C2O4+4H2SO4=K2SO4+Cr2(SO4)3+6CO2↑+7H2O
(五)零价配平法
即把整个氧化剂或还原剂总体的化合价归为零进行配平的方法。当元素化合价难以确定或无法确定的时候,此法很灵。
例6配平Fe3C+HNO3——Fe(NO3)3+CO2↑+NO2↑+H2O
解析:Fe3C化合价难确定,采用零价配平法。配平时,先确定还原剂和还原产物的系数。
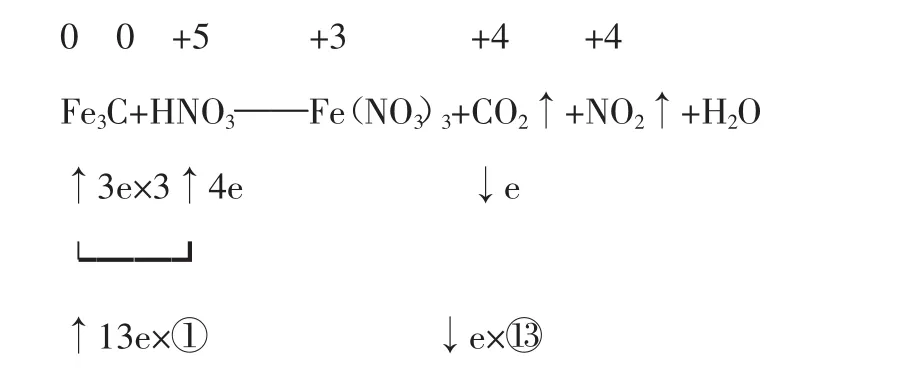
即Fe3C+HNO3——Fe(NO3)3+CO2↑+13NO2↑+H2O
配平得:Fe3C+22HNO3=3Fe(NO3)3+CO2↑+13NO2↑+11H2O
说明:使用零价法配平时,在一个反应的方程式中,只能对一种化合物作这种假设,而无论该化合物是反应物或产物均适应;除了所选化合物中各元素价态虚拟为零外,方程式中其余各物质中所含元素的价态要尊重事实。
事实上,近几年浙江省高中化学选考试题中,氧化还原反应方程式的配平往往在选择题和无机推断题中较为常见,做题时认真审题,按照电子得失守恒法的配平步骤和技巧,选择合适的方法即可。
[1]刘子远.例谈复杂氧化还原反应方程式配平方法[J].中学化学,2016(6).
[2]张庆.巧用“电子得失守恒法”配平氧化还原反应方程式[J].中学教学参考,2014(194).
