拉曼光谱技术在仿制药一致性评价研究中的应用
2018-03-04许晓辉邱国玉王小乔朱天虹李晨曦
许晓辉,邱国玉,初 明,王小乔,朱天虹,李晨曦, 闫 君,赵 波
(1兰州市食品药品检验所,甘肃兰州730050;2北京大学医学部基础医学院,北京100191)
0 引言
仿制药与原研药只是主药成分的分子结构相同,而仿制药与原研药中辅料、处方工艺等不同,由此两者存在疗效差异,因此,仿制药需开展一致性评价研究。仿制药一致性评价,是《国家药品安全“十二五”规划》中的一项药品质量要求,旨在提高仿制药质量,要求仿制药质量和疗效方面要与原研药品保持一致,达到在临床上可替代原研药的疗效,其一致性评价具体要求是仿制药与原研药杂质谱一致、稳定性一致、体内外溶出规律等一致。为了提高我国仿制药质量,推进仿制药事业发展,2016年2月,国务院正式发布了《关于推进仿制药质量和疗效一致性评价的意见》,部署了企业开展仿制药质量和疗效一致性评价工作,明确要求各药品生产企业在2018年底之前完成2007年10月1日前批准的国家基本药物目录中化学药品仿制药口服固体制剂共289个品种的一致性评价。而拉曼光谱技术作为一种绿色的定性定量分析方法,《中国药典》2010年版已将其收录入附录。目前,对于应用拉曼光谱技术对仿制药进行研究主要集中在原料药/辅料结构、晶型、粒度、组分分析、处方工艺等方面。
1 拉曼光谱技术概述
拉曼散射现象最早由印度科学家拉曼发现,它是基于拉曼散射原理的分子振动光谱,是研究化合物分子受到光照射后所产生的散射光、入射光的能级差与化合物振动频率、转动频率相互关系的分析方法,通过测量拉曼散射光中特定谱成分的相对强弱,可以获得被测分子或者体系的相关信息。拉曼散射实际上就是非弹性散射,分为斯托克斯散射和反斯托克斯散射两种,斯托克斯散射为光经过散射后频率减小,反斯托克斯散射为光经过散射后频率增大。斯托克斯散射和反斯托克斯散射的强度远小于瑞利散射,这也是在之前的实验中未被发现的原因。这其中斯托克斯散射要强于反斯托克斯散射,拉曼散射主要由斯托克斯散射构成。待测分子本身具有特定的不同的振动模式,因此入射光在经过待测分子后会发生不同程度的改变,通过对这些波长的改变进行测定,我们可以得到对特定分子唯一的拉曼光谱,从而对待测物质进行定性的研究。
目前研究分子振动的主要方法有红外光谱和拉曼光谱。与红外光谱相比,拉曼光谱在很多领域具有其特有的优势。比如拉曼光谱是一种无损检测技术,对样品状态几乎没有要求,不需要样品预处理,样品可通过光纤探头或者通过玻璃、石英直接测量;其次,水分子对拉曼散射几乎没有吸收,可用作水溶液中分子的检测,是一种理想工具用来研究水溶液中的化学化合物;同时,拉曼信号不受入射光激光波长的影响,只取决于待测分子的振动转动能级;再者,拉曼光谱可以一次同时覆盖4000~50波数区间,可对有机物化合物进行定性定量分析,所得谱图具有清晰尖锐的谱峰,比较适合通过差异分析来进行定性研究、定量研究以及数据库搜索[1-3]。另外,高度可极化的官能团是拉曼信号的主要来源,非对称的、具有高偶极矩的基团不能产生强的拉曼散射,而大多数药物分子都具有可极化的官能团,因此有着很好的拉曼散射效应。拉曼光谱能够反映多晶型药物分子的结构信息,拉曼光谱的展宽小、分辨率高、峰形尖锐,可降低大分子辅料的干扰而实现对原辅料制剂的直接分析,同时,拉曼光谱对结构变化非常灵敏,细微的分子间作用力的改变也能在谱图中体现。图1为拉曼光谱仪的基本结构,主要包括光源、滤光系统、光波处理系统、样品装置和检测器[4]。

2 拉曼光谱在仿制药一致性评价研究中的应用
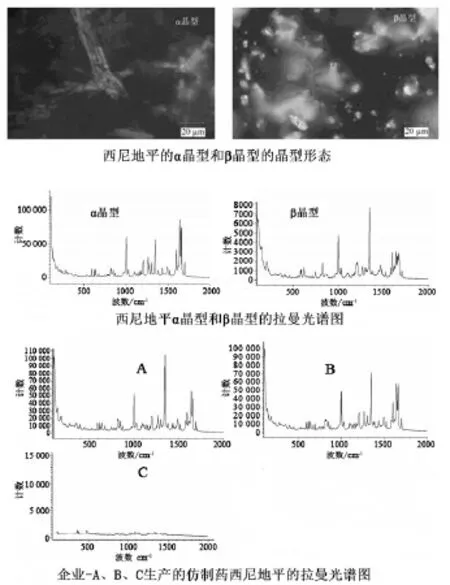
2.1 药物制剂中主药晶型研究 仿制药研究首先要找到原研制剂的处方、工艺、质量标准等,若实在找不到,可通过反向工程进行研究,既对原研药进行逆向分析,从而得出定性配方、原料药的晶型、辅料的含量及制备工艺等要素,因此原辅料的物理性质研究是处方前研究的重要内容,而晶型又影响着原辅料的理化性质,直接影响药物的溶解性、生物利用度与疗效。而原研药公司为了使自己研发的药品具有更长时间的市场独享权而对药物分子的晶型都申请专利,这样可以延长药物的专利保护。对仿制药公司来说,为了确保仿制药和原研药具有生物等效性,也需要对原料药的晶型进行研究,以确保原料药和制剂的质量能够替代原研药,正因为如此美国药监局在ANDA申报中也对仿制药多晶型控制有明确的指南。另外,仿制药公司只有开发出药物的新晶型才能够打破原研药公司对晶型的专利保护,提早将仿制药推向市场,因此,晶型筛选是突破原研专利最有效的方式之一,更够直接或间接带来巨大的经济效益。如果能找到在生物利用度、稳定性以及生产工艺等方面具有优越性的药物新晶型,通过晶型筛选可以发现有利于发挥药效作用的药物优势晶型,改善药物的溶出和生物利用度,减小药物毒性或根据晶型特点确定制剂工艺等,还可以申请晶型专利保护仿制药制剂处方工艺研究。另一方面,有些药物晶型很不稳定,需要考虑晶型的稳定性,严格控制操作过程和环境条件确保晶型不发生改变。而制剂中晶型检测主要通过X射线粉末衍射和拉曼光谱进行检测分析,通过对制剂中检测到的活性成分(API)的X射线粉末衍射图谱与参照图谱对比,分析活性成分特征峰来判断制剂中晶型归属,但是通常受到辅料干扰较大,比较难区分化学原料药晶型之间的特征峰。另外,对于活性成分为无定形的药物且制剂中同样含有无定形辅料或者半水合物的情况下,X射线粉末衍射就比较局限了。而拉曼光谱法适用于制剂中低含量活性成分晶型检测,其光斑直径小,且通常情况下活性成分拉曼信号要强于辅料信号,因此,可以很大程度上的避免辅料的干扰。应用拉曼光谱技术,可以研究原研药与仿制药的拉曼光谱图,通过拉曼光谱信号可以确定原研药与仿制药中化学原料药晶型不一致,这将可能提示仿制药与原研药生物不等效。因此,拉曼技术为原研药制剂中晶型分析,尤其是对无定形化学原料药和低含量剂型等复杂条件下的晶型分析提供了解决之道,是一致性评价工作中的一大利器。近年来,计算机辅助预测药物晶型在开发仿制药新晶型方面有了较大应用进展,基于商业程序Polymorph Predictor,在固体药物结构明知的前提下,通过计算点阵能量最小化方法探索药物结构能量上可能存在的晶体结构和分子排列规律,并将它们按能量大小排列,计算出不同能量条件下最可能生成的晶型,但该方法目前在研究药物晶型中的成功率还较低。另一方面,拉曼光谱技术也被应用到固体药物制剂分散体结晶动力学研究,如有研究者采用实时拉曼光谱法对卡维地洛的溶剂介导多态转变和冷却结晶进行了研究,论证了在线拉曼光谱技术在原位药物结晶分析中的优势[5],也有研究者应用拉曼光谱研究了不同活性药物成分/聚乙二醇(API/PEG)固体分散体的结晶动力学,与纯原料药相比,苯佐卡因/聚乙二醇(BZC/PEG)(20/80 wt%)固体分散体中的苯佐卡因结晶速率明显降低,而PEG基体对氟哌啶醇(HLP)的结晶行为没有影响[6],当然这些拉曼光谱在这些领域的探索,都可以应用到仿制药一致性评价研究中。石云峰等人[7]采用激光共聚焦显微拉曼光谱仪测定西尼地平片两种可能的α、β晶型(已经X-衍射鉴定)、原研药、国内仿制药的拉曼图谱,确定国内仿制药和原研药的晶型情况,结果显示结果国内A、B 2家企业产品为α晶型,原研药和国内C企业产品为无定型,国内仿制药和原研药晶型存在一定差异,其结果见图2。
2.2 药物制剂中粒度分析 在仿制药一致性评价研究过程中,粒度是API、辅料和制剂中间体的粉体学研究的重要技术指标。原辅料的粒度会影响药物制剂的物理、化学、生物行为,决定药物的含量均匀度、溶出速率,体内生物利用度。对于难溶性药物制剂,粒度分布的控制非常关键。全球在售药物中难溶性药物占40%,而这一数字在在研药物中高达90%。因此,如何提高难溶性药物的溶解性是制剂工艺的重点和难点,也是仿制药一致性评价研究中处方工艺研究的重要内容。目前,有多种粒度测量仪器,如激光衍射粒度分析仪、库尔特计数仪、颗粒图像处理仪器等,而拉曼光谱技术应用于药物粒度分析是近年来发展起来的一个新研究领域,甚至可以将拉曼光谱与光学显微镜和光学捕获耦合起来,实现显微长度的测量,对于一些高空间分辨率的无荧光表征的有机样品和复杂样品,利用近红外激发光源照射上述样品,在该波长上能够发出强烈的荧光,能够分析荧光强度大于1064 nm 的粒子[8]。 赵海云等人[9]基于图像导向的拉曼光谱技术,研究了国产仿制药来氟米特片与参比制剂(SANOFI)的粒度,作者先用拉曼光谱光学成像系统测量来氟米特片崩解液中颗粒的粒径和形状参数,然后采用拉曼光谱区分崩解液中API颗粒和辅料颗粒,获得API颗粒的粒度和粒形分布结果,并比较国产来氟米特片和参比制剂在崩解后的粒径和粒形差异。结果显示,国产仿制药来氟米特片崩解液中来氟米特API粒径D(v,50)为79.8μm,参比制剂崩解液中API粒径D(v,50)为17.6μm,且国产来氟米特片崩解液中发现较多API颗粒与辅料呈包结大颗粒状态,因此在开展来氟米特片仿制药质量一致性评价时,应进一步优化处方、生产工艺。
2.3 药物制剂中成分分析 在原研药制剂中,如何准确判断某些含量极低组分的存在性则成为逆向工程分析的关键点。基于拉曼成像,可通过多种数学运算转换为样品组分图像从而得到图谱结果。将在制剂上测得的所有拉曼图谱与每个单独组分的特征光谱相对比是鉴定制剂中各成分最简单的方法,如果某组分至少有一个不与其他组分重叠的特征峰能够被检测到,就能判断出该组分的存在,如下图3研究结果所示,研究者首先用来氟米特原料药和辅料纯物质建立拉曼光谱数据库,选择扫描区域内的颗粒自动进行拉曼光谱分析,将所分析颗粒的拉曼谱图与数据库进行比对,从而确定原料药与辅料的拉曼光谱峰[9],但实际情况中这种现象很少出现。通常,由不同的API及辅料组成的制剂,并且,这些成分颗粒小,混合均匀,因此这种制剂的拉曼成像光谱是多种成分信号的重叠。通过多变量分析法可以有效区分不同成分的特征峰,例如主成分分析法(PCA),直接经典最小二乘法(DCLS)等,可以提取有效信息,从而进行分析。拉曼显微光谱作为固体制剂无损分析手段已经应用于药学领域,与传统技术相比,拉曼显微光谱的最大优势在于它不破坏固体制剂的空间结构可以“无损性”地分析其化学成分,还能通过对被分析物不同横截面的表征,分析不同规格、形状样品的内部信息,得到API及辅料在制剂不同区域的分布,这种“无损性”分析技术所带来的“表面”分析信息是常规的破坏性溶液分析技术如薄层色谱、分子排阻色谱、高效液相色谱所无法实现或替代的。如共聚焦拉曼显微镜也可以对药物进行化学成像,主要是对剂型中的活性成分和赋形物进行空间成像,在低浓度配方中,根据空间成像快速鉴别主药和辅料[10]。对于包衣、多层次等复杂制剂,当不同厂家同一药品中的API分布区域不同时,可能说明不同厂家同一药品所采用的生产工艺不一样,而分布状态和制备工艺的差别也可能直接暗示着不同厂家所生产的制剂在溶出行为方面存在差异,生物等效性方面存在差异。拉曼光谱仪也可与其他仪器联用用于仿制药成分分析,如液相色谱-表面增强拉曼光谱联用仪(LC-SERS),尽管目前仅限于等速洗脱。虽然一些有机分析物可用于LC和LC-MS分析,但是LC-SERS方法的一个主要优点是它适用于分析没有紫外线吸收或不能够电离碎裂的分析物[11]。
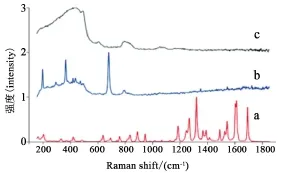
图3 来氟米特原料药与辅料的拉曼光谱
2.4 溶出度研究 溶出度试验在评价仿制药与原研药生物等效性方面发挥着重要的作用,其是模拟固体口服制剂在胃肠道中崩解和溶出的理想体外试验法,是评价和控制药品固体口服制剂质量的重要指标。目前药典中提供的传统溶出度测定方法仅能有限地反映药物在体内的动态溶出过程,常用的溶出度测定方法是紫外光谱法和液相色谱法[12]。由于拉曼光谱可用于测定水中的目标化合物,其已被应用到药物溶出度测定领域,无损快捷的优点使拉曼光谱有望成为溶出度测定的可选方法之一,美国药典中已收录了拉曼光谱法测定林可霉素溶出度的方法[13]。
3 总结
目前,拉曼光谱及其与其他技术相结合越来越多应用到仿制药一致性评价研究中,其表现出一定的优越性。研究表明,拉曼光谱技术在仿制药一致性评价研究中,小分子药物的拉曼光谱特征很明显,拉曼峰分布较广,对其进行光谱识别简单易行;而大分子都表现出较弱的光谱特征峰,常常伴随复杂的包络,不仅导致了对其光谱识别的困难,也很难准确确定特征峰位置[14]。鉴于仿制药一致性评价中,制剂成分的复杂性所得拉曼光谱数据的复杂性,因此将拉曼光谱分析方法、数据采集与其他新型分析方法、数据处理方法(如主成分分析法、多项式拟合和非线性最小二乘法等)相结合来解析研究对象是拉曼光谱技术待解决的问题[15]。
