对伴有静脉不对称征的急性脑梗死患者扩容治疗预后的影响
2018-03-04吴婧吴波娜
吴婧 吴波娜
磁敏感加权成像(susceptibility weighted imaging, SWI)是近年来发展起来的一种磁共振成像技术,最初被称为高分辨率血氧水平依赖(blood oxygen level dependent,BOLD)磁共振静脉成像,是一种高分辨率的三维梯度回波成像技术,它对脱氧血红蛋白、含铁血黄素及钙化等顺磁性物质具有很高的敏感性[1]。SWI对急性脑梗死研究具有较高价值,不仅可以检测脑微出血预测梗死后出血转化,并且还可显示脑梗死急性期静脉不对称征(asymmetrical vein sign,AVS)有研究显示,SWI能提示SWI-DWI不匹配,从而可能代替PWI来评估缺血半暗带[2],对静脉溶栓及血管内治疗有重要指导性意义[3]。但对于错过静脉溶栓及血管内治疗时间窗的部分患者,AVS是否具有价值指导其选择合理方法来改善神经功能预后尚有争议。因此,笔者选择伴有AVS的超时间窗脑梗死患者进行研究,探讨扩容治疗对预后的作用。
临床资料与方法
一、一般资料
对2015年2月至2018年5月在常州市武进人民医院收治住院的急性脑梗死患者进行筛选。纳入标准:(1)发病3 d内入院。(2)此次发病前mRS评分为0分。(3)入院后头颅磁共振DWI提示为新发脑梗死,并行颈颅MRA或颈颅CTA证实为患侧颈内动脉或大脑中动脉近段的狭窄大于50%。排除标准:(1)心源性栓塞。(2)大面积脑梗死、出血性脑梗死。(3)患有心、肺、肾等重要器官功能不全或恶性肿瘤,预期寿命少于3个月。(4)接受静脉溶栓治疗或血管内治疗。该项研究得到了我院伦理委员会的批准。符合标准的共有40例患者,其中男性21例,女性19例,男妇比例为1.11∶1。根据SWI结果进行分组,其中AVS组22例,无AVS组18例,AVS检测率为55.00%;两组在年龄、性别比例、高血压、糖尿病、血脂、血糖差异均无统计学意义(P>0.05)。见表1。
二、方法
收集入组患者的临床资料,包括性别、年龄、高血压病、吸烟、糖尿病、血脂、血糖等,并评估入院、出院时美国国立卫生研究院卒中量表(NIHSS)评分及门诊或电话随访出院后90 d改良Rankin量表(mRS)评分。
临床评估指标:长期神经功能改善为90 d mRS评分,0~2分为预后良好,3~6分为预后不良。影像学评估包括入院后头颅磁共振T1、T2、DWI及SWI序列,颈颅MRA或颈颅CTA检查。AVS定义为:在SWI序列上出现受累侧前循环区域显著的静脉低信号影,包括:(1)缺血半球静脉较对侧半球静脉增粗。(2)静脉的长度和可见性都比对侧半球的血管长[4]。所有影像学图像由一位有经验的影像学医师与一位神经科医师共同阅片,如有不一致则集体讨论商定,取得一致结论后记录。根据磁共振SWI检测结果将患者分为AVS组与无AVS组,在缺血性卒中规范化治疗基础上均予羟乙基淀粉500 mL静滴qd扩容治疗5~7 d。
三、统计学分析
结 果
一、两组NIHSS评分比较
入院时无AVS组NIHSS评分为(9.11±2.68)分,AVS组NIHSS评分为(8.91±2.00)分,两组入院时NIHSS评分相比较差异无统计学意义(t=0.27,P>0.05)。经扩容治疗后出院时无AVS组NIHSS评分为(6.56±2.68)分,AVS组NIHSS评分为(4.86±1.89)分,两组出院时NIHSS评分比较差异有统计学意义(t=2.26,P<0.05)。见表2。
二、两组长期神经功能的比较
无AVS组预后良好10例,预后不良8例,预后良好比例为55.56%。有AVS组预后良好19例,预后不良3例,预后良好比例为86.36%,两组长期神经功能改善率差异有统计学意义(χ2=4.71,P<0.05)。
讨 论
本研究结果显示,SWI静脉不对称征在大动脉粥样硬化性脑梗死患者中并不少见,本研究检测率为55%,比国外报道稍低[5]。可能由于本文中采用的磁共振磁场为1.5 T,而国外为3.0 T有关。
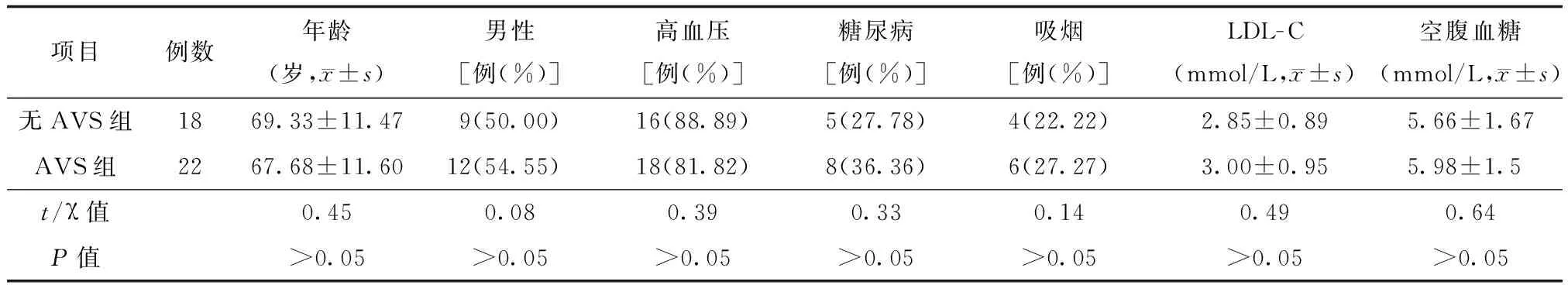
表1 两组一般资料比较

表2 两组NIHSS评分比较
AVS是基于BOLD效应原理而得到的影像学标记,在SWI表现为沿静脉分布的低信号影。由于大动脉粥样硬化导致血管狭窄或闭塞,脑灌注压(cerebral perfusion pressure,CPP)下降,正常情况下大脑自我调节机制通过血管扩张和降低血管阻力来提高脑血流量、弥补增加的氧耗需求;一旦CPP继续下降,自我调节机制失效,氧提取分数(oxygen extraction fraction,OEF)增加,从而维持足够的氧气供应给脑组织,导致静脉中脱氧血红蛋白与氧合血红蛋白比例的增加,此时脱氧血红蛋白作为一种内源性造影剂在SWI上清楚显示,这个时期被称为“贫困灌注”期。认识这个时期十分重要,因为这时脑组织缺血尚未产生不可逆性损伤,甚至可以持续很长时间,一旦经过有效治疗,大脑得到再灌注,脑组织缺血即可改善;如CPP继续下降达到失代偿,即发展为梗死核心。而界定这个时期又十分困难,因为CPP与OEF可以随大脑自动调节机制而发生改变。AVS的范围和突出度正反映了脱氧血红蛋白与氧合血红蛋白比例的增加,代表着OEF较高的阶段[6]。OEF增加预示着发生脑梗死风险的增加,但尚保留着自动调节能力[7]。因此AVS不仅反应了低灌注机制[8],也代表着尚可挽救的脑组织,对于伴有AVS但又超时间窗的脑梗死患者通过扩容增加灌注治疗可能将改善神经功能的预后。
扩容治疗在临床上广泛应用于防治低血容量及其导致的休克,学者们也将其引入到急性脑梗死的研究中。动物实验模型[9]提示扩容治疗可以改善大鼠脑卒中模型局灶性脑缺血后的神经功能,减少梗死体积。在临床研究中,一项荟萃分析[10]指出扩容治疗并不能提高急性缺血性卒中的生存率及功能结果,但这项研究并未对脑梗死进行病因分型;此外,我国指南指出对于低灌注所致的脑梗死可考虑扩容,推荐级别为Ⅲ推荐[11],推荐级别不高,可能意味在该类患者中仍需要进行筛选,并注意脑水肿及心功能不全等并发症。因此我们的研究着重于大动脉粥样硬化血管狭窄或闭塞患者;另一方面我们选择患者为非大面积脑梗死及无心肺功能障碍患者。本研究结果显示,有AVS患者经扩容治疗后出院时NIHSS(4.86±1.89)评分明显低于无AVS组NIHSS评分(6.56±2.68),差异有统计学意义;有无AVS组,90 d mRS预后良好率为86.36% vs 55.56%,差异有统计学意义,说明存在AVS的急性脑梗死经扩容治疗,能改善近期神经功能,并未见不良并发症,且这种益处持续至发病后3个月。AVS的出现提示存在低灌注及尚处于可挽救阶段;亦有文献显示AVS的出现代表侧枝循环较好[12]。我们对这部分患者进行扩容治疗,使低灌注血管得到再灌注,改善血流动力学,阻止并挽回脑组织缺血缺氧导致的生理病理进程,最终使神经功能预后得到明显改善。
本研究中采用的是一种中分子羟乙基淀粉,改善AVS预后的机制可能通过以下几个方面:(1)羟乙基淀粉具有胶体渗透活性,通过提高胶体渗透压,使组织液在短时间内迅速回流,从而增加血容量,并改善缺血脑组织的低灌注情况,使血流动力学得以迅速恢复或稳定下来并长时间维持。(2) Kaplan等[13]通过研究发现羟乙基淀粉可以减轻脑缺血后脑血管系统中白细胞粘附和血管通透性增加,从而起到抗炎、改善再灌注损伤的作用。(3)羟乙基淀粉可减轻大分子渗漏,改善微循环[14]。(4)稀释血液,降低血粘度,从而减轻红细胞“泥塞”现象,改善血液流变学[15]。
因此,对伴有AVS的超时间窗脑梗死患者,及时进行有效的扩容治疗,将改善此类患者神经功能预后。SWI序列作为一种快速无创性检查,检查时间短,费用低,在急性脑梗死患者中应常规开展,对指导治疗具有重大意义。本研究不足之处在于为单中心研究、样本量小,并且AVS为观察所得,未采取定量方法,期待有更可靠的方法对这个方向进行进一步研究。
