红枣色素的抗脂质过氧化作用
2018-03-02韩娅婷邵佩兰张丽芬郑安然
韩娅婷,谢 惠,邵佩兰,张丽芬,郑安然
(宁夏大学农学院,宁夏银川 750021)
自由基过剩可诱发许多慢性疾病,如恶性肿瘤、动脉粥样硬化、免疫失调等多种疾病,亦是机体衰老的机制之一[1]。脂质过氧化在过氧化脂质损伤细胞模型中是氧自由基损伤组织的重要方式,生物膜含有的多不饱和脂肪酸极易受活性氧进攻而发生脂质过氧化[2-3],产生的氧化产物会导致不同程度的生化代谢紊乱及病理变化,同时,红细胞膜发生脂质过氧化反应还会使血小板凝集,诱发脑血栓、心肌梗塞等[4]。研究发现,植物中天然抗氧化物可消除人体代谢过程中多余的内源性活性氧,阻断自由基对体内大分子物质如DNA的氧化和损伤,减少心脑血管疾病发生[5],因此研究和开发具有抗脂质氧化活性的物质对防治与自由基有关的疾病有重要意义。
从加工枣汁的废弃枣渣中提取的红枣色素,色泽鲜艳、安全无毒,且具有清除自由基、抗氧化、抗肿瘤、抗衰老、补血养气等功效[6],是一种较为理想的天然色素资源。目前红枣色素的研究多集中于提取[7]及稳定性[8],马奇虎[9]、郑安然[10]等研究认为该色素为水溶性色素,其主要成分是黄酮类化合物。郑安然[11]、李勇[12]等研究表明红枣红色素具有较好的体外抗氧化活性,且多酚和黄酮可能是其抗氧化作用的主要物质基础[13],但红枣色素的抗脂质过氧化能力研究未见报道,本实验通过大豆油、卵黄脂蛋白、亚油酸、小鼠肝脏匀浆、小鼠红细胞脂质过氧化体系,研究红枣色素对脂质过氧化的抑制作用,以期为红枣色素的开发利用,天然抗氧化剂的筛选及慢性退行性疾病的预防等提供理论依据。
1 材料与方法
1.1 材料与仪器
红枣色素 食品化学与分析实验室自制[7];健康雄性ICR小鼠 体重18~20 g,5周龄,宁夏医科大学实验动物中心;硫代巴比妥酸(TBA)、三氯乙酸(TCA)、硫酸亚铁、三氯甲烷(CHCl3)、磷酸二氢钠、磷酸氢二钠、亚油酸、过氧化氢(H2O2)、正丁醇、抗坏血酸(VC) 均为分析纯;大豆油(不添加任何抗氧化剂) 山东鲁花集团有限公司;鸡蛋 银川市市售。
UV-2000型紫外分光光度仪 上海尤尼柯仪器有限公司;TDL-5-A型离心机 上海安亭科学仪器厂;90型磁力搅拌器 上海亚荣生化仪器厂;玻璃组织匀浆器 沈阳玻璃仪器一厂;SHA-C水浴恒温振荡器 江苏省金坛市荣华仪器制造有限公司;HH-4数显恒温水浴锅 天津汇科仪器设备有限公司;101-3型电热鼓风恒温干燥箱 上海车星建材实验设备有限公司。
1.2 实验方法
1.2.1 红枣色素对大豆油脂质过氧化的抑制作用 称取10 mL大豆油,加入1 mL蒸馏水稀释的0.1、0.3、0.5、1.0、1.5 mg/mL红枣色素溶液,于48 ℃水浴恒温22 h,取样1 mL加入2 mL 0.67% TBA溶液,2 mL 20% TCA,沸水浴20 min,冷却至37 ℃,加入5 mL CHCl3溶液,摇匀,离心(3500 r/min,10 min),取上清液于532 nm处测吸光度[14],空白对照以蒸馏水代替红枣色素溶液,并以VC做阳性对照,计算抑制率。
抑制率(%)=(A空白-A样品)/A空白×100
1.2.2 红枣色素对Fe2+诱发卵黄脂蛋白脂质过氧化的抑制作用 新鲜鸡蛋去卵清,卵黄用等体积pH7.4,0.1 mol/L磷酸缓冲液(PBS)配制成1∶1的悬液,磁力搅拌(37 ℃)10 min,再用PBS稀释成1∶25的卵黄悬液。取卵黄悬液0.2 mL,分别加入0.1、0.3、0.5、1.0、1.5 mg/mL红枣色素溶液1 mL,再加入25 mmol/L FeSO4·7H2O溶液0.2 mL,用PBS补至2 mL,对照管除不加色素溶液外其他试剂同前,将对照管、样品管同置于37 ℃水浴4 h,取出加50% TCA溶液0.5 mL,0.8% TBA 1 mL,混匀,100 ℃水浴20 min,冷却,3500 r/min离心15 min,取上清液在532 nm处测定吸光度[15],并以VC做阳性对照,计算抑制率。
抑制率(%)=(A对照-A样品)/A对照×100
1.2.3 红枣色素对亚油酸脂质过氧化的抑制作用 将红枣色素加入2.5%亚油酸-无水乙醇溶液(1∶40)配制成0.01、0.05、0.10 mg/mL色素溶液,并以VC做阳性对照,混匀后置于40 ℃培养箱。每隔1 d(共4 d),取出1 mL待测样品,加入1 mL 25% TCA混匀,静置20 min后加入1 mL 0.67% TBA,沸水浴加热10 min。冷却后加入4 mL正丁醇,摇匀,4000 r/min,室温离心10 min,取上层液于532 nm处比色,用蒸馏水代替样品做空白,同时测定不加抗氧化物的空白管吸光度[15],计算抑制率。
抑制率(%)=(A空白-A样品)/A空白×100
1.2.4 红枣色素对Fe2+催化亚油酸脂质过氧化的抑制作用 在10 mL 0.2 mol/L pH7.4 PBS中,加入2.5%亚油酸乙醇液4.1 mL,蒸馏水4.9 mL,并加入1 mL 2.54×10-3g/L的FeSO4作催化剂形成底物溶液,加红枣色素使其成为0.01、0.05、0.10 mg/mL色素溶液,并以VC做阳性对照,混匀后置于40 ℃培养箱。定时取出1 mL待测样品,其他操作同1.2.3[15]。
抑制率(%)=(A空白-A样品)/A空白×100
1.2.5 红枣色素对小鼠肝组织自发性脂质过氧化的抑制作用 小鼠禁食过夜,次日处死。迅速取出肝脏,置于4 ℃生理盐水中反复漂洗,吸干水分,称重。剪碎,在冰浴条件下用生理盐水研磨,制成10%肝组织匀浆,4 ℃以3000 r/min离心10 min,取上清液待用。取肝匀浆1 mL于试管中,加入0.25、0.50、1.00、2.00、4.00 mg/mL红枣色素溶液1 mL,对照管以蒸馏水代替红枣色素溶液,混匀,37 ℃水浴恒温振荡(振荡速率为200 r/min)1.5 h,加10% TCA 2 mL,0.67% TBA 1 mL,混匀,沸水浴加热15 min,冷却至37 ℃,3000 r/min离心(4 ℃)15 min,取上清液在532 nm处比色[16],并以VC做阳性对照,计算抑制率。
抑制率(%)=(A对照-A样品)/A对照×100
1.2.6 红枣色素对H2O2诱导小鼠肝组织脂质过氧化的抑制作用 取1 mL肝匀浆溶液,加入0.25、0.50、1.00、2.00、4.00 mg/mL红枣色素溶液0.1 mL,加入0.1 mL 60 mmol/L H2O2,37 ℃水浴1 h,加入15% TCA 1 mL终止反应,再加0.67% TBA 1 mL,沸水浴加热15 min,冷却至37 ℃,4 ℃以3000 r/min离心10 min,于532 nm测上清液吸光度[16],空白对照以蒸馏水代替红枣色素溶液,并以VC做阳性对照,计算脂质抑制率,以丙二醛(MDA)抑制率来表示。
抑制率(%)=(A空白-A样品)/A空白×100
1.2.7 红枣色素对H2O2诱导的红细胞膜脂质过氧化 小鼠禁食过夜,眼球采血1 mL到含抗凝剂的离心管里,用生理盐水5 mL洗涤3次(3000 r/min,4 ℃),每次5 min,弃上层液,将红细胞配制成0.5%悬浮液。取红细胞悬液0.5 mL加入到对照管、加药管,各管加生理盐水1 mL,加药管加入0.4、0.8、1.2、1.6、2.0 mg/mL红枣色素溶液0.05 mL,对照管、加药管加100 mmol/L H2O20.1 mL,用生理盐水补足至2 mL,摇匀,37 ℃水浴2 h,加入20% TCA 0.3 mL,0.1 mol/L HCl 2 mL,3500 r/min离心(4 ℃)15 min,取上清液3 mL加入0.67% TBA 1 mL,沸水浴15 min,冷却后于532 nm处测吸光度[17],并以VC做阳性对照,计算抑制率。
抑制率(%)=(A对照管-A加药管)/A对照管×100
1.2.8 红枣色素对H2O2诱导红细胞溶血的抑制作用 取0.5%红细胞悬液1 mL,加入到空白管、对照管和样品管,样品管加入0.4、0.8、1.2、1.6、2.0 mg/mL红枣色素溶液0.05 mL,对照管、样品管加入100 mmol/L H2O20.05 mL,空白管、对照管加生理盐水补足至1.1 mL,摇匀37 ℃水浴1 h,各管加生理盐水4 mL,3000 r/min离心10 min,取上清液于425 nm处测吸光度[17],并以VC做阳性对照,计算抑制率。
抑制率(%)=(A对照管-A样品管)/(A对照管-A空白管)×100
1.3 数据处理
2 结果与讨论
2.1 红枣色素对大豆油脂质过氧化的抑制作用
红枣色素对大豆油脂质过氧化的抑制作用见图1。由图1可知,红枣色素具较好的抑制大豆油脂质过氧化能力,且随红枣色素浓度增加,抑制能力逐渐增强,并呈良好量效关系。低浓度时增幅较缓,高于0.5 mg/mL时增幅显著增大(p<0.01),1.5 mg/mL时抑制能力为0.5 mg/mL时的3.3倍,且稍强于VC,IC50为0.96 mg/mL(VC的IC50为1.07 mg/mL)。红枣色素含有黄酮和多酚类化合物(含量为3.2 mg/g和12.58 mg/g),其酚羟基结构中的邻位酚羟基很容易氧化成醌类结构而具有很强的供氢能力,可与脂肪酸自由基结合,终止自由基的连锁反应[18],使红枣色素具有较好的抑制大豆油脂质过氧化能力。
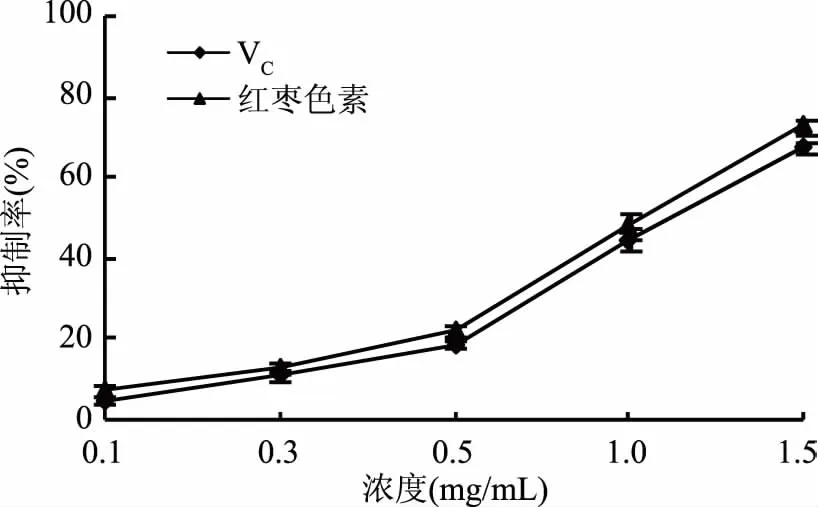
图1 红枣色素对大豆油脂质过氧化的抑制作用Fig.1 Inhibition effect of jujube pigment on the bean oil lipid peroxidation
2.2 红枣色素对Fe2+诱发卵黄脂蛋白脂质过氧化的抑制作用
红枣色素对Fe2+诱发卵黄脂蛋白脂质过氧化有一定的抑制作用(图2),且随红枣色素浓度增加抑制作用增强(p<0.05),低浓度红枣色素的抑制能力与VC相差不大,0.5 mg/mL以上时抑制能力较VC弱,1.5 mg/mL红枣色素的抑制率为45.30%±1.54%,明显低于VC(71.00%±1.00%)。卵黄磷脂C-2位上所含多不饱和脂肪酸在Fe2+催化下易发生脂质过氧化,而红枣色素中酚类物质可释放H+,破坏或终止氧化产生的过氧化物,并分解为醛、酮类低分子物质[19]而抑制脂质过氧化。

图2 红枣色素对Fe2+诱发卵黄脂 蛋白脂质过氧化的抑制作用Fig.2 Inhibition effect of jujube pigment on the yolk lipoprotein lipid peroxidation induced by Fe2+
2.3 红枣色素对亚油酸脂质过氧化的抑制作用
红枣色素对亚油酸脂质过氧化有一定的抑制作用(图3),且随红枣色素浓度的增加,抑制作用逐渐增强(p<0.05)。0.01 mg/mL红枣色素与同浓度VC的抑制率相差不大,0.10 mg/mL红枣色素在第4 d的抑制率达59.92%±1.12%,比0. 01 mg/mL红枣色素增加了19.86%,表明红枣色素对亚油酸脂质过氧化具有一定的抑制作用,可作为一种天然抗氧化剂的来源。

图3 红枣色素对亚油酸脂质过氧化的抑制作用Fig.3 Inhibition effect of jujube pigment on the linoleic acid lipid peroxidation
2.4 红枣色素对Fe2+催化亚油酸脂质过氧化的抑制作用
红枣色素具有一定抑制Fe2+催化亚油酸脂质过氧化的作用(图4),随红枣色素浓度增加,其抑制作用逐渐增强(p<0.05),且呈良好量效关系,但红枣色素的抑制作用明显弱于VC,0.10 mg/mL红枣色素在第4 d的抑制率为43.57%±1.59%。黄酮类化合物对金属离子(Fe2+)具有络合作用[20],可间接抑制脂质过氧化反应,而红枣色素富含黄酮类化合物,对Fe2+催化亚油酸脂质过氧化具有较好的抑制效果。

图4 红枣色素对Fe2+催化亚油酸脂质过氧化的抑制作用Fig.4 Inhibition effect of jujube pigment on the linoleic acid lipid peroxidation atalyzed by Fe2+
2.5 红枣色素对小鼠肝组织自发性脂质过氧化的抑制作用
红枣色素对小鼠肝组织自发性脂质过氧化具有一定抑制作用(图5),在0.25~2.0 mg/mL范围内抑制作用较弱,超过2.0 mg/mL后,抑制作用随色素浓度升高明显增强(p<0.01),4.0 mg/mL时抑制率为34.90%±1.15%,较1.0 mg/mL时增加了25.10%,但抑制效果劣于VC。丙二醛(MDA)是脂质过氧化物的主要分解产物,其含量反映组织脂质过氧化程度,也间接反映组织受自由基攻击的严重程度[21]。较高浓度红枣色素对肝组织自发性脂质过氧化具有较强的抑制能力,表明红枣色素能明显抑制小鼠肝组织脂质过氧化而保护肝脏。

图5 红枣色素对小鼠肝组织 自发性脂质过氧化的抑制作用Fig.5 Inhibition effect of jujube pigment on mice liver lipid peroxidation
2.6 红枣色素对H2O2诱导小鼠肝组织脂质过氧化的抑制作用
红枣色素对H2O2诱导小鼠肝组织脂质过氧化具有较弱的抑制作用(图6),随红枣色素浓度增加,抑制作用缓慢增强(p>0.05),4.0 mg/mL时抑制率为19.00%±2.00%,明显低于VC(51.40%±1.22%)。H2O2具强氧化性,是有效的诱导剂,能刺激肝脏产生MDA,损伤细胞功能和结构[22],促发细胞衰老和死亡,而红枣色素能抑制H2O2所致肝组织脂质过氧化的发生,对膜系统具有一定的保护作用。

图6 红枣色素对H2O2诱导小鼠肝 组织脂质过氧化的抑制作用Fig.6 Inhibition effect of jujube pigment on mice liver lipid peroxidation induced by H2O2
2.7 红枣色素对H2O2诱导红细胞膜脂质过氧化的抑制作用
红枣色素对H2O2诱导红细胞膜脂质过氧化具有较强的抑制作用(图7),且随红枣色素浓度增加抑制作用显著增强(p<0.01),并呈明显的量效关系。在0.4~1.2 mg/mL范围内,红枣色素的抑制效果劣于VC,但超过1.2 mg/mL时的抑制作用反而强于VC。2.0 mg/mL红枣色素的抑制率为80.32%±1.53%,IC50为1.25 mg/mL,其抑制作用明显强于VC(65.57%±1.69%,IC50为1.46 mg/mL)。生物体内的脂质过氧化主要发生在细胞膜上,而红细胞脂质代谢的改变,将直接影响其结构和功能,可引起人体衰老和心脏病、动脉粥样硬化、癌化、炎症、糖尿病等严重疾病[23],红枣色素可有效抑制膜质的过氧化和细胞损伤,具有良好的红细胞保护作用。

图7 红枣色素对H2O2诱导 红细胞膜脂质过氧化的抑制作用Fig.7 Inhibition effect of jujube pigment on erythrocyte membrane lipid peroxidation induced by H2O2
2.8 红枣色素对H2O2诱导红细胞溶血的抑制作用
红枣色素对H2O2诱导红细胞溶血具有较强的抑制作用(图8),其抑制作用随红枣色素浓度升高逐渐增强(p<0.05),且呈良好的量效关系,2.0 mg/mL红枣色素的抑制率达72.02%±1.70%,IC50为0.82 mg/mL,但抑制效果明显弱于VC(89.24%±2.25%,IC50为0.47 mg/mL)。H2O2可引发氧化作用导致红细胞损伤,使血红蛋白逸出[24],由此可见红枣色素能显著抑制红细胞溶血的发生,避免氧化损伤。

图8 红枣色素对H2O2诱导红细胞溶血的抑制作用Fig.8 Inhibition effect of jujube pigment on erythrocyte hemolysis induced by H2O2
3 结论
红枣色素具有一定的抗脂质过氧化能力,抑制能力随红枣色素浓度的升高而增强,且呈现良好的量效关系。红枣色素对大豆油脂质过氧化有很好的抑制作用,其IC50为0.96 mg/mL;对Fe2+诱发卵黄脂蛋白、亚油酸及Fe2+催化亚油酸脂质过氧化均具有较好的抑制作用;对小鼠肝组织自发性脂质过氧化有一定的抑制能力,但对H2O2诱导小鼠肝组织脂质过氧化的抑制能力相对较弱;红枣色素能显著抑制H2O2诱导红细胞膜脂质过氧化及H2O2诱导红细胞溶血,在2.0 mg/mL浓度下的抑制率分别为80.32%±1.53%和72.02%±1.70%。综上实验结果证实,红枣色素是很好的预防性抗氧化剂,可有效抑制脂质过氧化,其抑制程度也与浓度呈剂量关系。因此,应合理研究和开发具有预防衰老、心血管病、炎症、肿瘤作用的红枣色素抗氧化产品,这对以红枣为原料的抗氧化功能食品具有重要的指导意义。
[1]李勇,金明,尹学哲. 草苁蓉抗脂质过氧化活性研究[J]. 中国实验方剂学杂志,2010,16(15):184-185.
[2]Marnett L J. Oxy radicals,lipid peroxidation and DNA damage[J]. Toxicology,2002,181:219-222.
[3]Pan Y M,Zhang X P,Wang H S,et al. Antioxidant potential of ethanolic extract of polygomun cuspidatum and applicationin peanut oil[J]. Food Chemistry,2007,105(4):1518-1524.
[4]吕娜,李峰,张捷,等. 棉皮素和棉皮苷抗脂质过氧化活性的体外实验比较研究[J]. 毒理学杂志,2015,29(1):57-58.
[5]戴青原. 内脏脂肪素对氧化应激HUVECs的作用及其分子机制研究[D].昆明:昆明医科大学,2014.
[6]向延菊,王大伟. 利用微波技术提取红枣色素工艺研究[J].保鲜与加工,2010,10(1):45-47.
[7]邵佩兰,徐明. 正交实验优化红枣色素提取工艺[J].食品科技,2014,39(3):232-235.
[8]周华佩,邵佩兰,刘敦华,等. 常用食品添加剂对红枣色素稳定性的影响[J].中国食品添加剂,2015(11):110-115.
[9]马奇虎. 枣皮红色素的提取、纯化及稳定性研究[D].银川:宁夏大学,2014.
[10]郑安然,邵佩兰,郭晓丹,等. 枣皮红色素结构初步鉴定及抗氧化活性研究[J].食品科技,2016(11):230-235.
[11]郑安然,邵佩兰,郭晓丹,等. 提取方法对红枣色素抗氧化活性的影响[J].北方园艺,2016(23):129-133.
[12]李勇. 大枣枣皮红色素的分离、生物活性及稳定性的研究[D].郑州:郑州大学,2013.
[13]邵佩兰,徐明,郭晓丹,等. 红枣色素中活性成分含量与抗氧化活性的相关性[J]. 食品工业科技,2016,37(17):171-174.
[14]Murzakhmetova M,Moldakarimov S,Tancheva L,et al. Antioxidant and prooxidant Properties of a Polyphenol-rich Extract fromGeraniumSanguineumL.inVitroandinVivo[J]. Phytother Res,2008,22(6):746-751.
[15]吴琼. 高梁红色素抗氧化作用的研究[D]. 吉林:吉林农业大学,2004.
[16]王敏,魏益民,高锦明,等. 苦荞黄酮的抗脂质过氧化和红细胞保护作用研究[J].中国食品学报,2006,6(1):279-230.
[17]刁鹏飞,郭延生,刘宝剑,等. 当归水提液和醇提液体外抗脂质过氧化和红细胞溶血作用[J]. 天然产物研究与开发,2009(21):679-683.
[18]曹平. 天然抗氧化剂抑制油脂氧化的研究进展[J].中国油脂,2005,30(7):49-51.
[19]Cazzola R,Cestaro B. Red wine polyphenols protect n-3 more than n-6 polyunsaturated fatty acid from lipid peroxidation[J]. Food Res Int,2011,44:3065-3071.
[20]孟洁,杭瑚. 核桃仁活性成分的提取及体外抗氧化活性研究[J]. 食品科学,2001,22(12):45-47.
[21]尹学哲,李天,汪霞. 大豆皂醇抗脂质过氧化作用的研究[J].食品工业科技,2010,31(7):144-145.
[22]王丽梅,叶诚,吴晨,等. 紫苏油对衰老模型大鼠的抗衰老作用研究[J].食品科技,2013,38(1):280-284.
[23]金爱花,陈丽艳,全吉淑. 草苁蓉多糖红细胞保护作用[J].中国公共卫生,2011,27(11):1444-1446.
[24]娄翠,汤顺清. 海带岩藻多糖的抗脂质过氧化作用研究[J].中国酿造,2011(8):26-29.
