太湖不同湖区冬季沉积物细菌群落多样性
2018-03-02薛银刚江晓栋耿金菊滕加泉谢文理陈心一常州大学环境与安全工程学院江苏常州64江苏省环境保护水环境生物监测重点实验室常州市环境监测中心江苏常州00污染控制与资源化研究国家重点实验室南京大学环境学院江苏南京00
薛银刚,刘 菲,江晓栋,耿金菊,滕加泉,谢文理,张 皓,陈心一 (.常州大学环境与安全工程学院,江苏 常州 64;.江苏省环境保护水环境生物监测重点实验室,常州市环境监测中心,江苏 常州 00;.污染控制与资源化研究国家重点实验室,南京大学环境学院,江苏 南京 00)
太湖是我国第三大浅层淡水湖,富营养化是其目前存在的主要环境问题[1].湖泊沉积层对富营养化非常敏感[2],沉积物细菌群落在氮、磷等元素的矿化和循环中发挥重要作用,影响着淡水湖泊营养物质的生物化学循环[3-4].营养物质的可利用性使得沉积物细菌群落在不同营养水平湖区之间存在差异.
以往的研究利用T-RFLP[5-6]和PCRDGGE[7]等方法对太湖浮游细菌群落特征已经展开了大量的工作.随着分子生物学测序的发展,高通量测序技术被证实是识别微生物群落整体概况的高效工具[8],并被广泛应用于土壤、生物膜和沉积物等复杂环境的微生物群落结构研究[9-12].目前,关于太湖微生物群落的研究大多集中于北部藻型湖区[13-14]和浮游细菌多样性[5-7],本文基于高通量测序对不同营养水平湖区冬季沉积物细菌群落多样性展开研究.
太湖自2007年蓝藻大面积暴发后,相关部门采取了一系列治理措施,如控源截污、生态修复、引水稀释和蓝藻打捞等.对于蓝藻水华的防控主要集中在春夏两季对蓝藻的大规模打捞,对于早期的蓝藻防控工作相对缺乏.本文以太湖不同营养水平湖区表层沉积物为研究对象,利用高通量测序技术分析各个点位与不同湖区的沉积物细菌多样性,解析不同湖区沉积物细菌群落的空间差异;通过环境因子相关性分析,研究水环境因子对沉积物细菌群落的影响.通过对冬季沉积物细菌群落结构进行分析,以期为太湖沉积物细菌生物化学循环和实施早期蓝藻防控工作提供基础数据.
1 材料与方法
1.1 样品采集与理化分析
采样时间为2015年11月,采集的样品为表层沉积物,采样点为太湖不同营养水平湖区(图1).采样点依次是沙塘港(STG)、闾江口(LJK)、小湾里(XWL)、椒山(JS)、平台山(PTS)、西山西(XSX)、渔洋山(YYS)、胥湖心(XHX)、七都(QD).其中STG、LJK和XWL位于藻类主导的河口区(HK);JS、PTS和XSX位于受外部因素影响最小的湖心区(HX);YYS、XHX和QD位于水生植物主导的水草区(SC).使用便携式柱状采泥器(HYDRO-BIOS, Germany)进行沉积物样品的采集.在运输过程中,所有的样品均放置在冷藏箱中保存,并在送到实验室后立即进行预处理.将采集的沉积物样品离心后得到的固态污泥保存于-20℃条件下,用于后续分析测试.
利用YSI水质分析仪(美国,YSI 6600)现场测定上覆水的水温和pH值.每个采样点采集3份水样带回实验室测定TN、NH3-N、、、TP和水质指标,测定方法参照《水和废水监测分析方法》(第四版)[15].

图1 太湖采样点位置Fig.1 Location of sampling sites in Lake Taihu
1.2 DNA提取和PCR扩增
使用FastDNA Spin Kit for Soil试剂盒(MP bio, USA)按照试剂盒说明步骤提取基因组DNA,使用NanoDrop2000超微量蛋白质核酸分析仪(Thermo Fisher Scientific, USA)测定提取出的DNA浓度和纯度后,将DNA样品于-20℃中保存,用于后续的PCR扩增等分析.
将提取好的DNA产物利用16S rDNA V1~V2区扩增引物进行PCR扩增,引物序列(5'-3'):正向引物AGAGTTTGATYMTGGCTCAG,反向引物TGCTGCCTCCCGTAGGAGT.PCR产物以等密度比混合后使用Qiagen Gel Extraction Kit(Qiagen, Germany)纯化.
1.3 高通量测序
纯化后的产物送至江苏中宜金大分析检测有限公司,使用Illumina(USA)的Hiseq平台进行高通量测序和分析.经TruSeq®DNA PCR-Free样品制备试剂盒(Illumina, USA)生成测序文库.使用Qubit @ 2.0荧光计(Thermo Fisher Scientific,USA)和Agilent Bioanalyzer 2100系统(Agilent,USA)评估测序文库质量.最后,在Illumina HiSeq 2500平台(Illumina, USA)上进行测序,产生了250bp的配对末端读数.
1.4 数据分析
测序得到的原始数据,存在一定比例的干扰数据,为了使信息分析的结果更加准确、可靠,首先对原始数据进行拼接、过滤,得到有效数据.然后基于有效数据进行OTUs聚类和物种分类分析.根据OTUs聚类结果,对每个OTU的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况.对于每个代表性的序列,使用基于RDP分类器算法的GreenGene数据库来注释分类信息[16].
为了研究不同OTU的系统发育关系,以及不同样本中优势种的差异,使用MUSCLE软件进行多序列比对(3.8.31版本);基于QIIME计算样品香农指数(Shannon)、辛普森指数(Simpson)、文库覆盖率(Coverage)和系统发育距离,使用平均联动的非加权组平均法的聚类分析方法(UPGMA)来解释距离矩阵构建系统发育树[17];R语言程序(2.15.3版)绘制韦恩图;Origin(8.5版本)绘制属水平优势物种丰度柱状图;优势物种差异显著性利用SPSS(17.0版本)软件进行分析,显著性水平设定为P<0.05;结合Pearson相关性分析和CANOCO软件(4.5版本)来进行优势细菌与水环境因子的冗余分析(RDA)[18].
2 结果与分析
2.1 水样理化指标
太湖冬季不同湖区上覆水的理化指标如表1,可以看出各个湖区的营养水平为河口区>湖心区>水草区.太湖水体整体呈弱碱性,水温在15℃左右.TN含量在不同湖区之间差异明显,TP含量在不同湖区之间差异性较弱.水草区的NH3-N含量较高;河口区和湖心区的TN、TP、、和含量较高.
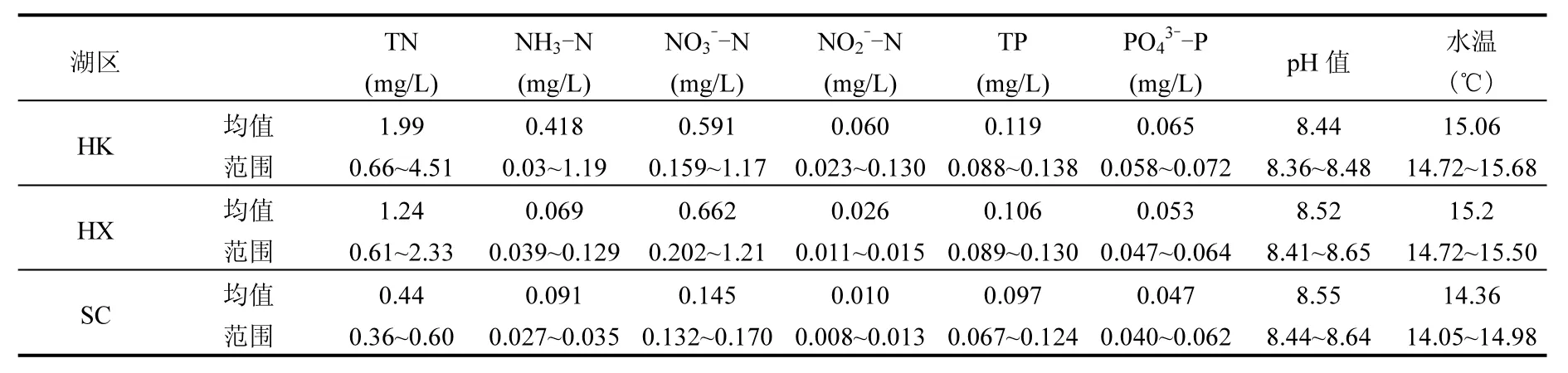
表1 太湖不同湖区冬季水质理化指标Table 1 Physio-chemical indices of water in different zones of Lake Taihu in winter
2.2 OTU聚类与多样性分析
各采样点的OTU聚类结果与多样性指数见表2,测序文库的覆盖率均在99%以上,表明各个采样点的测序结果完全可以代表样本的真实情况.每个采样点的有效序列数(用于OTU聚类等后续分析的有效数据)均在20000以上,本次测序产生的OTUs是将所有样品的有效序列进行统计,以97%的一致性将序列聚类而成[19],然后对OTUs的代表序列进行物种注释.稀释曲线(图2)表明STG、LJK和XWL在有效测序数达到4500时,曲线已保持平缓状态;其余采样点当测序有效序列达到8000时,曲线渐进平缓;表明用于OTU聚类的测序数满足要求[20],且聚类产生的OTUs可以用于后续物种注释.稀释曲线反映出各个采样点聚类产生的OTUs为YYS>XHX>QD>JS>XSX>PTS>XWL>STG>LJK,这与表2所述基本一致.
基于多序列比对计算得出各采样点的Shannon指数和Simpson指数,结果表明,各采样点的Shannon指数为YYS>QD>XHX>JS>XWL>XSX>PTS>STG>LJK;Simpson指数为YYS>QD>XWL>XHX>XSX>JS>PTS>STG>LJK.总体来看,Shannon指数和Simpson指数为水草区>湖心区>河口区.
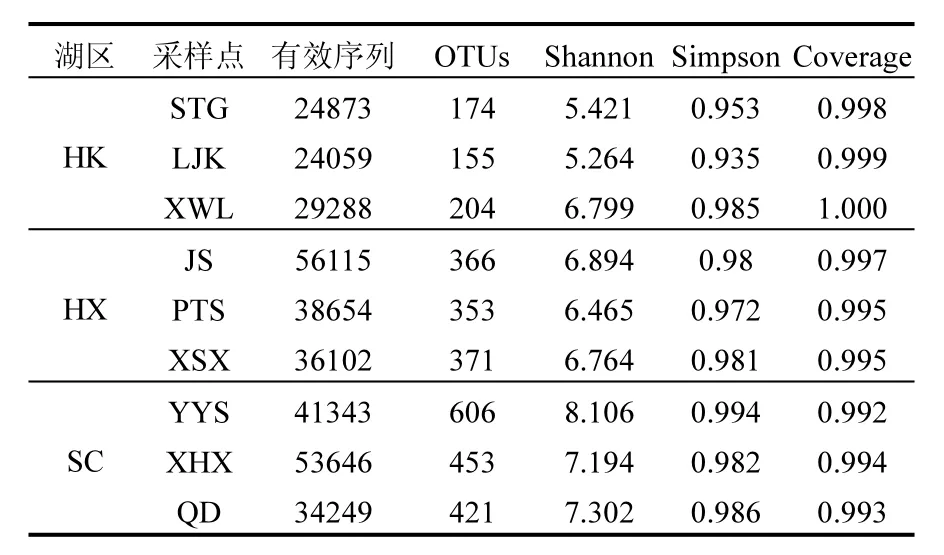
表2 各点位OTU聚类与多样性分析Table 2 Clustering and diversity analysis of each sampling site
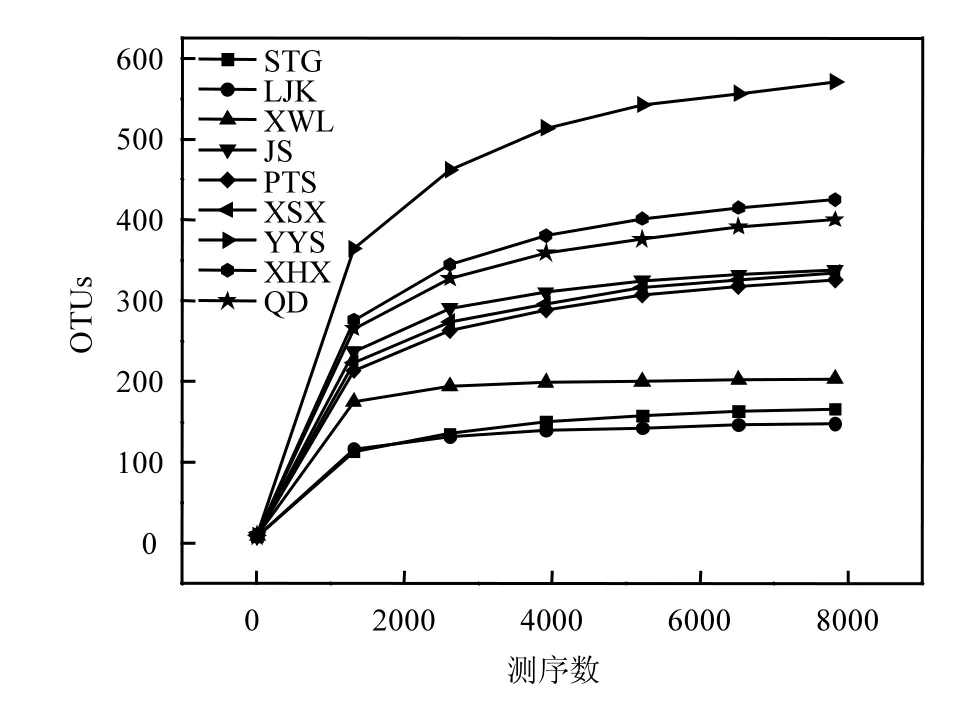
图2 稀释曲线Fig.2 Rarefaction curve
Venn图用于展示可视化数据集之间的重叠和差异,图3反映了河口区、湖心区和水草区样品的OTUs组成相似性以及数据重叠情况.不同营养水平湖区均具有其特有的细菌种类,3个湖区OTUs共计1006,共有的OTUs为78.湖心区和水草区共有的OTU数最多,其次为河口区和湖心区共有的OTU数,河口区与水草区共有的OTU数最少.
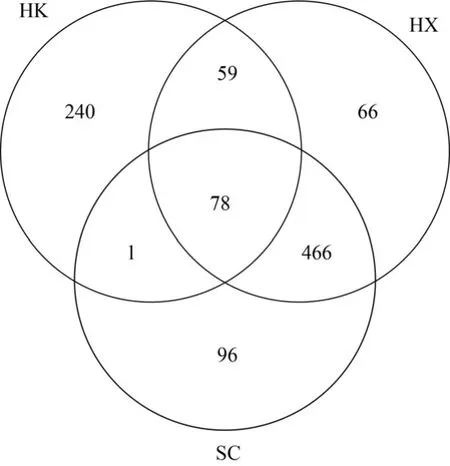
图3 OTU分布韦恩图Fig.3 Venn diagram denoting the distribution of OTUs
描述湖区到湖区物种组成的β多样性对于了解各种空间尺度上物种多样性的模式至关重要[21],可以考察不同湖区的生境多样性,有利于了解整个太湖区域的生物生产力差异.选用距离指标来衡量不同湖区样品间的相异系数(图4).水草区与湖心区相异系数较小(0.214),水草区与河口区以及河口区与湖心区相异系数较大,分别为0.650和0.613.
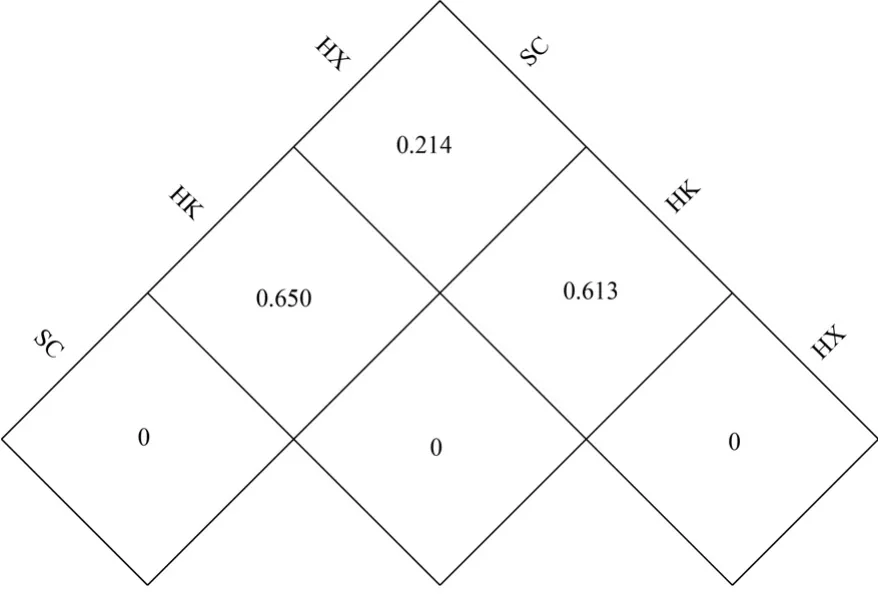
图4 Beta多样性指数Fig.4 Beta diversity index
2.3 沉积物细菌群落结构
高通量测序结果表明,河口区、湖心区和水草区冬季沉积物样品聚类产生的OTUs分别为378、669和641,经分析主要隶属于25个门,51个纲,96个属.在门水平上,优势类群主要包括绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、蓝藻门(Cyanobacteria)和拟杆菌门(Bacteroidetes)等(图5).系统发育树表明位于同一营养水平湖区沉积物的细菌组成较为相似.就河口区而言,丰度高于10%的优势类群为Proteobacteria(29.53%)、硝化螺旋菌门(Nitrospirae,16.47%)和Chloroflexi(13.80%).除Chloroflexi(34.78%)和Proteobacteria(16.16%)外,Cyanobacteria在湖心区丰度高达19.81%.Chloroflexi同时也是水草区丰度最高的优势类群,占比约为总细菌含量的1/3,其次为Proteobacteria(17.64%)、Acidobacteria(12.62%)和Cyanobacteria(10.32%).另外,Bacteroidetes、绿菌门(Chlorobi)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)和浮霉菌门(Planctomycetes)等优势类群也均有检出,丰度均高于1%.
图5可以看出各个点位优势类群的丰度存在明显差别,Proteobacteria和Chloroflexi是太湖各个点位沉积物中相对丰度最高的两个类群.9个采样点占比第一的沉积物细菌分别为STG(Proteobacteria,37.48%)、LJK(Proteobacteria,32.99%)、XWL(Proteobacteria,18.12%)、JS(Proteobacteria,34.44%)、PTS(Chloroflexi,36.67%)、XSX(Chloroflexi,48.15%)、XHX(Chloroflexi,30.58%)、QD(Chloroflexi,37.80%)、YYS(Proteobacteria,28.99%).其中,Chloroflexi中丰度较高的是厌氧绳菌纲(Anaerolineae,11.29%)和KD4-96(7.48%);Proteobacteria中丰度较高的是β-变形菌纲(Betaproteobacteria,3.03%)、γ-变形菌纲(Gammaproteobacteria,9.48%)和δ-变形菌纲(Deltaproteobacteria,3.73%).
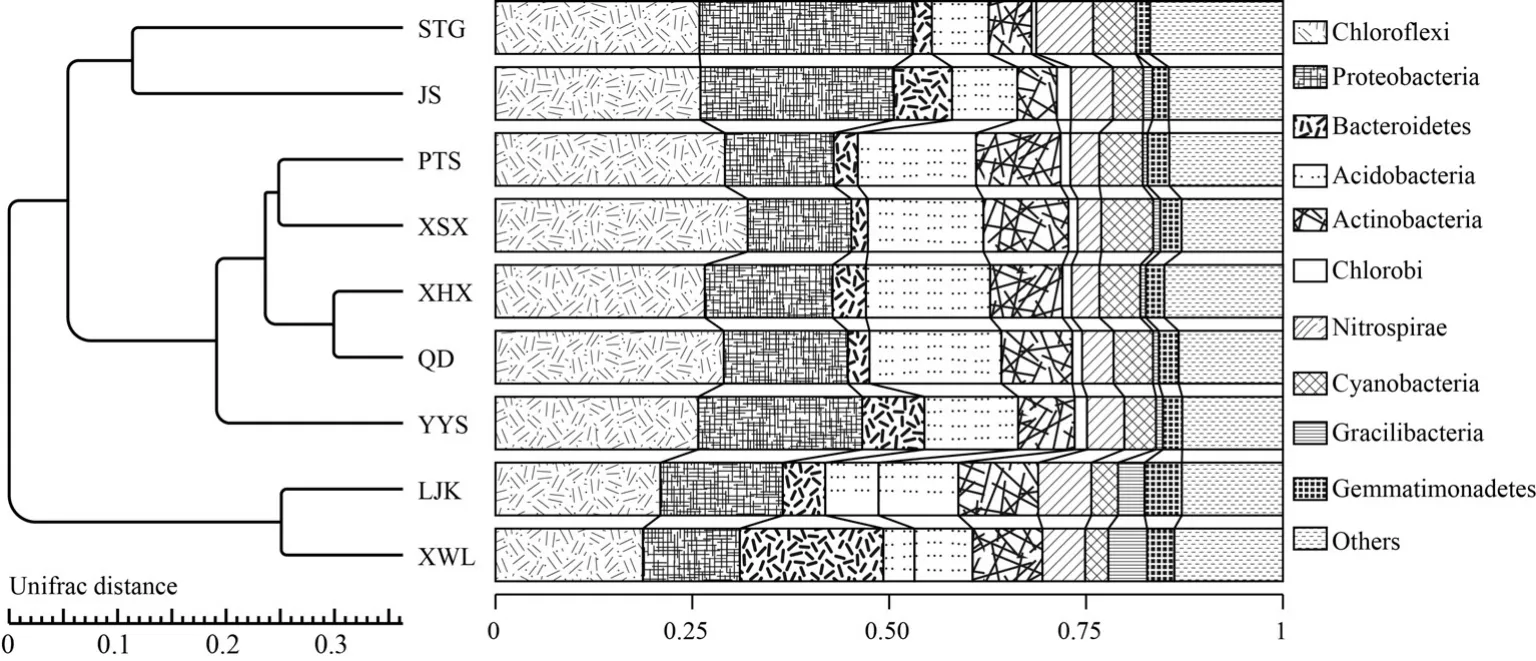
图5 UPGMA聚类树与门水平优势沉积物细菌Fig.5 UPGMA cluster tree of dominant bacteria in winter sediment of Lake Taihu at the phyla level
选取属水平排名前10的优势细菌重新进行相对丰度的计算,以更显著地表明不同湖区优势沉积物细菌的丰度差异性(图6).其中归属于Others的细菌主要有蛭弧菌属(Bdellovibrio)、厌氧粘细菌属(Anaeromyxobacter)、Blvii28_wastewater-sludge_group以及分枝杆菌属(Mycobacterium)等(图中未展示). unidentified_Chloroplast、聚球藻属(Synechococcus)、微囊藻属(Microcystis)和unidentified_ Nitrosomonadaceae是太湖冬季沉积物中优势类群.其中,河口区的主要优势类群为Microcystis、unidentified_Nitrosomonadaceae和unidentified_Chloroplast,平均丰度分别达到26.24%、24.14%和18.87%;这3类细菌也是湖心区丰度排名前3的优势类群;而水草区最具优势的类群为Synechococcus,平均丰度达到31.65%.值得注意的是,Microcystis在每个采样点均有检出,其中JS的Microcystis含量最高,仅次于JS的是LJK.unidentified_Chloroplast、Synechococcus、unidentified_Nitrospiraceae、Blastocatella和Sva0081_sediment_groups分别在XSX、QD、XWL、PTS、STG丰度最高.
选取5类门水平优势细菌、3类纲水平优势细菌与4类属水平优势细菌与不同湖区进行差异显著性分析(表3).单因素方差分析表明,不同优势细菌在湖区之间的差异显著性不同.2类门水平优势细菌Nitrospirae(P=0.033)和Acidobacteria (P=0.042)、2类纲水平优势细菌Anaerolineae(P=0.043)和Nitrospira(P=0.033)在河口区、湖心区和水草区之间差异显著.3类门水平优势细菌(Chloroflexi、Proteobacteria和Cyanobacteria)、1类纲水平优势细菌(Gammaproteobacteria)和4类属水平优势细菌(unidentified_Chloroplast、Synechococcus、Microcystis和unidentified_Nitrospiraceae)在不同湖区之间差异不显著(P>0.05).
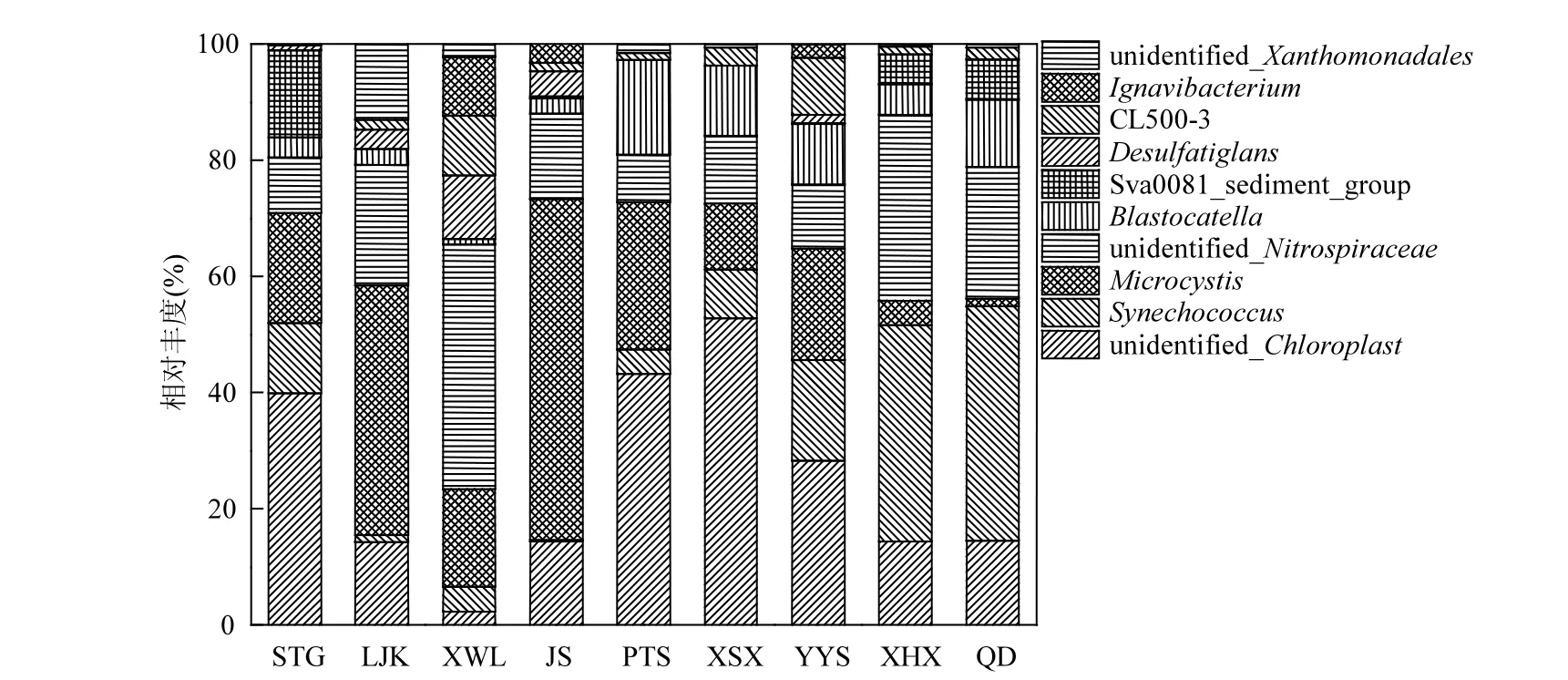
图6 属水平优势沉积物细菌Fig.6 Dominant bacteria in sediment at the genus level
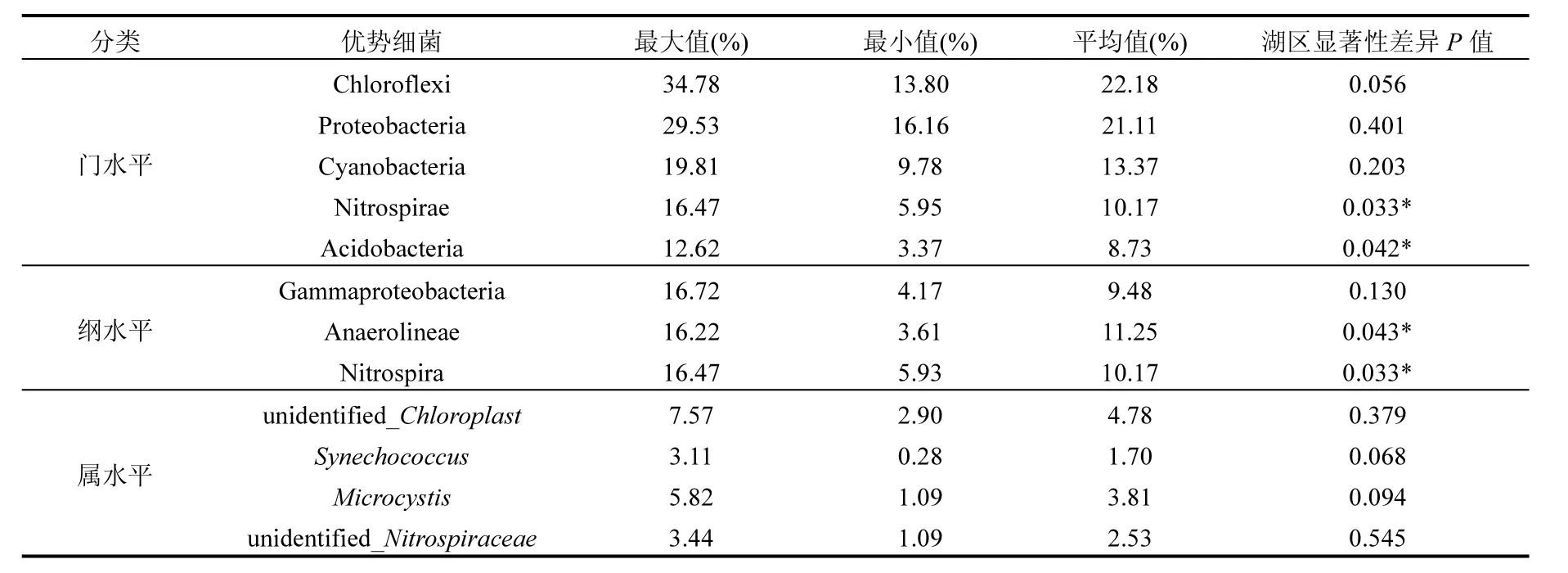
表3 优势细菌与不同湖区差异显著性Table 3 Significance of difference of dominant bacteria among different lake zones
2.4 沉积物细菌与水环境因子的相关性
图7展示了水环境营养盐含量、水温以及pH值与属水平细菌的冗余分析结果,第一主轴对属水平细菌群落方差变化的解释量为62.40%,第二主轴的解释量为18.80%.其中pH值与第一主轴呈显著正相关,与第二主轴呈显著负相关;、水温、TN、TP、、和NH3-N与第一主轴呈显著负相关,与第二主轴呈显著正相关.可见,上层水环境营养盐水平、水温以及pH值均对太湖冬季表层沉积物细菌群落有一定影响.
unidentified_Xanthomonadales、Ignavibacterium和Desulfatiglans与TN、TP、、和NH3-N具有较强正相关性,相关系数均大于0.9;与pH值呈负相关关系,相关系数绝对值大于0.99.Synechococcus和Blastocatella与pH值呈正相关性关系,与TN、TP、、和NH3-N呈负相关关系. Sva0081_sediment_group、CL500-3和uidentified_Nitrospiraceae受环境因子影响较小,NH3-N是其主要影响因子.Microcystis显示出与水温和较强的正相关关系,相关系数均大于0.99.
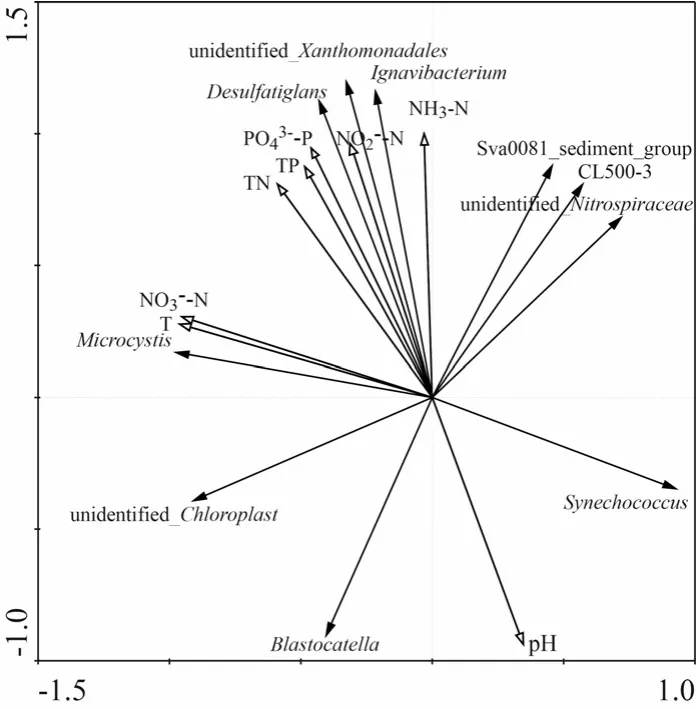
图7 优势细菌与水环境因子的冗余分析Fig.7 Redundancy analysis of dominant bacteria and water environmental factors
3 讨论
3.1 太湖不同湖区沉积物细菌群落特征
太湖水域较广阔,由于其水深相对较浅,外加风浪的作用促使沉积层物质与水体物质交换频繁[22],引起沉积层理化性质与营养程度的变化,进而影响微生物的多样性.为了研究不同湖区沉积物细菌群落差异性和生境多样性,本文选用α多样性和β多样性对太湖不同营养水平湖区进行分析.结果表明,湖心区和水草区的细菌群落组成较为相似;通过Shannon指数和Simpson指数对每个样品中物种组成的丰富度和均匀度两方面进行考察[23],结果表明,水草区物种组成的均匀度和丰富度均最高,其次为湖心区,河口区最低;之前已有研究报道表明营养水平的增加会导致细菌群落多样性显著下降[24].造成太湖3个湖区群落多样性差异可能是由于水草区主要由水生植物主导,富营养化程度较低,水质较好;湖心区地理位置上远离河口区,受外界影响小,富营养化程度较河口区低;由于周边农业、水产养殖业、旅游业和城市化的发展,河口区长期接纳农业化学品、土壤颗粒、工业废水和生活污水的侵蚀,营养输入过多,水质较差.营养通量的改变可能导致生态系统发生巨大变化,使得不同营养区的细菌群落组成各异.Bacteroidetes、Chlorobi、unidentified_Chloroplast和unidentified_Nitrospiraceae在富营养区的丰度更高,而Actinobacteria在贫营养区的检出率更高,刘芳华等[25]也发现Actinobacteria在太湖贫营养区的含量相对较高,营养可用性被认为是改变湖泊沉积物中微生物群落的主要因素[26].营养水平的不同使Nitrospirae、Acidobacteria、Anaerolineae和Nitrospira在3个湖区之间具有显著的差异.同时,不同营养区还存在特有的细菌种类,如Sva0081_ sediment_group仅在水草区的3个采样点有检出.
沉积物细菌具有种类丰富以及代谢活性高的特点,是湖泊中完成转化营养物质工作的承担者[27].太湖冬季沉积物中主要的优势类群为Chloroflexi、Proteobacteria、Acidobacteria和Cyanobacteria等.高光等[28]通过对太湖水生植物主导和藻类主导湖区冬季和夏季的沉积物细菌群落进行比较,发现Proteobacteria在两类湖区丰度均最高,除此之外,Cyanobacteria仅在藻类主要湖区的样品中有检出,水生植物主导湖区的优势类群为Acidobacteria、Bacteroidetes.该研究团队对太湖不同湖区春季沉积物细菌群落的研究结果表明,梅梁湾和水草区的主要优势细菌为Chloroflexi、Proteobacteria;Proteobacteria和Bacteroidetes在湖心区丰度较高[25].可见,Proteobacteria和Chloroflexi是太湖沉积物中长期存在的优势类群.大多数的Proteobacteria对于可降解的有机基质具有很强的代谢能力,在富营养化湖泊占据主导地位并不意外.Chloroflexi是涉及有机污染物生物降解的细菌,太湖的富营养状态使这类细菌具有明显的生存优势.赵大勇[29]等利用T-RFLP方法对太湖3个不同营养水平湖区(梅梁湾、胥口湾、东太湖)夏季表层沉积物的细菌群落开展研究,发现Gammaproteobacteria广泛存在于3个湖区中,Deltaproteobacteria在梅梁湾丰度较高,Betaproteobacteria为东太湖含量较多,这与本次研究结果相类似;但其仅在梅梁湾区域检出Chloroflexi,而本次研究表明Chloroflexi分布于太湖不同湖区所有采样点,可能是由于高通量测序的检测范围宽、定量准确以及测序深度高等优点.
近几年来,尽管太湖的营养污染得到一定的削减,但蓝藻的繁殖频率和持续时间都有所增加[30].早前的报道表明,全球气候的变化导致地表水温升高,可能会在蓝藻繁殖中起重要作用[31].针对富营养化和气候变化促进蓝藻有害增殖和扩张的两个过程,O'Neil等[32]研究了淡水、河口和海洋生态系统的代表蓝藻属与营养和气候变化之间的关系,结果表明蓝藻属对氮磷等营养元素具有极高的竞争力;并且在更高温度下,其生长速度更快.蓝藻水华暴发往往经历4个阶段:湖底休眠、水体复苏、上浮积聚和死亡分解.很多蓝藻细胞在冬季会沉到底泥里,而到春季会复苏到水体,且蓝藻大规模积聚的时间提前,相关部门在春季便开始对太湖蓝藻实施大规模打捞,但蓝藻并未减少,且2017年蓝藻打捞量是2016年同期的5.5倍[33].本次通过高通量测序技术在太湖9个采样点均检出蓝藻,在3个湖区占比均较高,以湖心区含量最高,其次为水草区,河口区丰度最低.研究表明,沉积物中的营养物质会为蓝藻复苏及生长繁殖提供营养[34],致使春季太湖水体中蓝藻大规模富集.可见,下一年春季太湖水体中蓝藻会大规模积聚,可能以湖心区蓝藻覆盖面积更大.设想如若将冬季沉积物中的藻种消除,便可能克服后续大规模的蓝藻打捞工作,从而实现早期蓝藻水华的防控.
3.2 沉积物细菌群落与环境因子的关系
营养盐的输入可能对接收水质产生深远的影响,同时上覆水的理化性质也可对沉积物细菌群落结构有一定的影响.营养状况可能对淡水湖泊沉积细菌群落的形成起重要作用[35].参考《地表水环境质量标准》(GB38382-2002)[36]Ⅲ类水标准要求,河口区和湖心区的TN和TP含量都已超标,由氮磷含量反应出太湖此时已呈现营养状态.冗余分析结果表明水环境因子显著地影响着沉积物细菌群落.Winters等[37]发现硝酸盐、铵盐和磷酸盐等环境因子均可影响劳伦森大湖沉积物细菌群落组成.通过考察不同污染源对太湖春夏秋冬四季沉积物细菌群落的影响,Jing等[38]发现铵盐和有机物显著影响细菌群落组成,4种不同的污染源(污水处理厂,城市,郊区,农业)对太湖沉积物细菌群落影响不同,其中污水处理厂最可能导致沉积物生物同质化.
Microcystis在太湖9个采样点均有检出,上覆水的水温和NO3--N是冬季沉积物中Microcystis的主要影响因子.Liu等[39]对太湖进行了为期11年的调查工作,发现Microcystis与NOx-N和水温呈正相关,在含氮化合物浓度下降时,水温升高是微囊藻水华暴发的主要推动力.李朋富教授团队对太湖梅梁湾、贡湖湾和湖心区进行为期6个月的研究工作,发现从春季到秋季Microcystis含量持续升高[40].本次Microcystis在太湖不同湖区均有检出,当水温持续上升后,Microcystis可能会迅速增长以致大规模积聚.秦伯强等[41]发现产毒的Microcystis主要存在于太湖营养充足的湖区,而无毒的Microcystis则是营养受限湖区的优势细菌.本次研究中,Microcystis在河口区和湖心区丰度很高,这与河口区和湖心区的营养盐含量密不可分;同时河口区与湖心区的水温也高于水草区.对于存在于河口区和湖心区等营养水平较高湖区的Microcystis,应给予极大关注.通过找出Microcystis等有害生物的制约因子,以控制环境制约因子达到对有害微囊藻水华的防控.
4 结论
4.1 营养程度不同,湖区物种丰富度和均匀度也不同,3个湖区的物种丰富度和均匀度为水草区>湖心区>河口区.
4.2 不同湖区优势细菌群落组成存在差异,Nitrospirae、Acidobacteria、Anaerolineae和Nitrospira占比在河口区、湖心区和水草区之间差异显著(P<0.05).冬季太湖沉积物细菌主要类群为Chloroflexi(22.18%)、Proteobacteria(21.11%)、Cyanobacteria(13.37%)和Nitrospirae(10.17%);在属分类水平上,主要的优势类群为unidentified_Chloroplast(4.78%)和Microcystis(3.81%).
4.3 冬季太湖沉积物中全面检出Cyanobacteria,且含量丰富.隶属于Cyanobacteria的Microcystis在太湖不同湖区9个采样点也均有检出,NO3--N和水温是Microcystis的主要影响因子,可为早期蓝藻和有害微囊藻水华防控工作提供基础数据.
[1] Qin B Q, Zhu G W, Gao G A, et al. A drinking water crisis in Lake Taihu, China: linkage to climatic variability and lake management [J]. Environmental Management, 2010,45(1):105-112.
[2] Ye W J, Liu X L, Lin S Q, et al. The vertical distribution of bacterial and archaeal communities in the water and sediment of Lake Taihu [J]. Fems Microbiology Ecology, 2009,70(2):263-276.
[3] Yang Z, Zhang M, Shi X L, et al. Nutrient reduction magnifies the impact of extreme weather on cyanobacterial bloom formation in large shallow Lake Taihu (China) [J]. Water Research, 2016,103:302-310.
[4] 郑艳玲,侯立军,陆 敏,等.崇明东滩夏冬季表层沉积物细菌多样性研究 [J]. 中国环境科学, 2012,32(2):300-310.
[5] 顾婷婷,孔繁翔,谭 啸,等.越冬和复苏时期太湖水体蓝藻群落结构的时空变化 [J]. 生态学报, 2011,31(1):21-30.
[6] Tang X M, Gao G A, Chao J Y, et al. Dynamics of organicaggregate-associated bacterial communities and related environmental factors in Lake Taihu, a large eutrophic shallow lake in China [J]. Limnology and Oceanography, 2010,55(2):469-480.
[7] Shi L M, Cai Y F, Kong F X, et al. Specific association between bacteria and buoyant Microcystis, colonies compared with other bulk bacterial communities in the eutrophic Lake Taihu, China [J].Environmental Microbiology Reports, 2012,4(6):669-678.
[8] 陈兆进,陈海燕,李玉英,等.南水北调中线干渠(河南段)浮游细菌群落组成及影响因素 [J]. 中国环境科学, 2017,37(4):1505-1513.
[9] Chao Y Q, Mao Y P, Wang Z P, et al. Diversity and functions of bacterial community in drinking water biofilms revealed by high-throughput sequencing [J]. Scientific Reports, 2015,5:10044.
[10] Sun Y J, Wang T Y, Peng X W, et al. Bacterial community compositions in sediment polluted by perfluoroalkyl acids(PFAAs) using Illumina high-throughput sequencing [J].Environmental Science and Pollution Research, 2016,23(11):10556-10565.
[11] 刘 洋,曾全超,黄懿梅.基于454高通量测序的黄土高原不同乔木林土壤细菌群落特征 [J]. 中国环境科学, 2016,36(11):3487-3494.
[12] 白 洁,李海艳,张 健,等.黄海西北部沉积物中细菌群落16S rDNA多样性解析 [J]. 中国环境科学, 2009,29(12):1277-1284.
[13] Shao K Q, Gao G, Qin B Q, et al. Structural changes of the sediment bacterial community in Meiliang Bay of Lake Taihu,China, during typhoon Morakot, 2009 [J]. Journal of Basic Microbiology, 2012,52(1):99-103.
[14] Tang X M, Li L L, Shao K Q, et al. Pyrosequencing analysis of free-living and attached bacterial communities in Meiliang Bay,Lake Taihu, a large eutrophic shallow lake in China [J]. Canadian Journal of Microbiology, 2014,61(1):22-31.
[15] 国家环境保护总局.水和废水监测分析方法-第4版 [M]. 北京:中国环境科学出版社, 2002:239-284.
[16] Desantis T Z, Hugenholtz P, Larsen N, et al. Greengenes: a chimera-checked 16S rRNA gene database and workbench compatible in ARB [J]. Applied & Environmental Microbiology,2006,72(7):5069-5072.
[17] Caporaso J G, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data [J].Nature Methods, 2010,7(5):335-336.
[18] Ter Braak C J F, Smilauer P. CANOCO reference manual and CanoDraw for Windows user's guide: software for canonical community ordination (version 4.5) [M]. Ithaca, New York,Microcomputer Power, 2002.
[19] Huse S H, Welch D M, Morrison H G, et al. Ironing out the wrinkles in the rare biosphere through improved OTU clustering[J]. Environmental Microbiology, 2010,12(7):1889-1898.
[20] 陈兆进,丁传雨,朱静亚,等.丹江口水库枯水期浮游细菌群落组成及影响因素研究 [J]. 中国环境科学, 2017,37(1):336-344.
[21] Zhou J, Jiang Y H, Deng Y, et al. Random sampling process leads to overestimation of β-diversity of microbial communities [J].Mbio, 2013,4(3):e00324-13.
[22] 逄 勇,颜润润,余钟波,等.风浪作用下的底泥悬浮沉降及内源释放量研究 [J]. 环境科学, 2008,29(9):2456-2464.
[23] Strecker A L, Arnott S E, Yan N D, et al. Variation in the response of crustacean zooplankton species richness and composition to the invasive predator Bythotrephes longimanus [J]. Canadian Journal of Fisheries and Aquatic Sciences, 2006,63(9):2126-2136.
[24] Sand-Jensen K, Borum J. Interactions among phytoplankton,periphyton, and macrophytes in temperate freshwaters and estuaries [J]. Aquatic Botany, 1991,41(1-3):137-175.
[25] Liu F H, Lin G H, Gao G, et al. Bacterial and archaeal assemblages in sediments of a large shallow freshwater lake, Lake Taihu, as revealed by denaturing gradient gel electrophoresis [J].Journal of Applied Microbiology, 2009,106(3):1022-1032.
[26] Nam Y D, Sung Y, Chang H W, et al. Characterization of the depth-related changes in the microbial communities in Lake Hovsgol sediment by 16S rRNA gene-based approaches [J].Journal of Microbiology, 2008,46(2):125-136.
[27] Madsen E L. Microorganisms and their roles in fundamental biogeochemical cycles [J]. Current Opinion in Biotechnology,2011,22(3):456-464.
[28] Shao K Q, Gao G, Qin B Q, et al. Comparing sediment bacterial communities in the macrophyte-dominated and algae-dominated areas of eutrophic Lake Taihu, China [J]. Canadian Journal of Microbiology, 2011,57(4):263-272.
[29] Huang R, Zhao D Y, Jiang C L, et al. Heterogeneity of bacterial community compositions in surface sediments of three lake zones in Lake Taihu [J]. Proceedings of the National Academy of Sciences, India Section B: Biological Sciences, 2015,85(2):1-10.[30] Yang Z, Zhang M, Shi X L, et al. Nutrient reduction magnifies the impact of extreme weather on cyanobacterial bloom formation in large shallow Lake Taihu (China) [J]. Water Research, 2016,103:302-310.
[31] Paerl H W, Huisman J. Blooms like it hot [J]. Science,2008,320(5872):57-58.
[32] O’Neil J M, Davis T W, Burford M A, et al. The rise of harmful cyanobacteria blooms: The potential roles of eutrophication and climate change [J]. Harmful Algae, 2012,14:313-334.
[33] 宜兴日报.太湖蓝藻打捞量是去年同期的5.5倍 [EB/OL].http://www.yixing.gov.cn/zxzx/show-13593314.heml2017-05-16/2017-06-26.
[34] 陈 楠.太湖沉积物微生物群落组成与物质循环及蓝藻爆发的相关性 [D]. 北京:中国农业大学, 2015.
[35] Yu D, Yang Y, Zhen W, et al. Spatiotemporal variation of planktonic and sediment bacterial assemblages in two plateau freshwater lakes at different trophic status [J]. Applied Microbiology and Biotechnology, 2016,100(9):4161-4175.
[36] GB/3838-2002 地表水环境质量标准 [S].
[37] Winters A D, Marsh T L, Brenden T O, et al. Molecular characterization of bacterial communities associated with sediments in the Laurentian Great Lakes [J]. Journal of Great Lakes Research, 2014,40(3):640-645.
[38] Jing W, Yi L, Wang P F, et al. Response of bacterial community compositions to different sources of pollutants in sediments of a tributary of Taihu Lake, China [J]. Environmental Science and Pollution Research International, 2016,23(14):13886-13894.
[39] Liu X, Lu X H, Chen Y W. The effects of temperature and nutrient ratios on Microcystis blooms in Lake Taihu, China: an 11-year investigation [J]. Harmful Algae, 2011,10(3):337-343.
[40] Wang X Y, Sun M J, Wang J M, et al. Microcystis genotype succession and related environmental factors in Lake Taihu during cyanobacterial blooms [J]. Microbial Ecology, 2012,64(4):986-999.
[41] Otten T G, Xu H, Qin B Q, et al. Spatiotemporal patterns and ecophysiology of toxigenic microcystis blooms in Lake Taihu,China: implications for water quality management [J].Environmental Science and Technology, 2016,46(6):3480-3488.
