嘉陵江出口段水体碱性磷酸酶活性特征
2018-03-02袁绍春孟彩侠张腾璨重庆交通大学河海学院水利水运工程教育部重点实验室重庆400074成都市市政工程设计院四川成都6005
王 敏,袁绍春*,孟彩侠,徐 炜,张腾璨 (.重庆交通大学河海学院,水利水运工程教育部重点实验室,重庆 400074;.成都市市政工程设计院,四川 成都 6005)
藻类活动规律一直是水体富营养化现象的表征之一,2003年嘉陵江出口段水体的消落期发生了不同程度的“藻华”现象,调查期间水体的氮、磷指标均已达到富营养化状态,充足的营养盐含量已经不再是“藻华”发生的阈值[1-5].已有研究表明,碱性磷酸酶(ALP)对藻类等浮游植物利用溶解态有机磷(DOP)并维持自身细胞增殖具有重要意义[6-11].碱性磷酸酶活性的研究主要集中于实验室研究[12-16]或湖泊“藻华”[17-18],在河道型水库“藻华”中的研究[19-23]相对较少.嘉陵江是重庆主城区重要饮用水源,藻类“水华”现象的发生势必增加饮用取水的风险[24].本文以三峡水库的重要支流嘉陵江出口段为研究区域,2011~2016年为研究时段,通过对总碱性磷酸酶活性(TAPA)、总藻(ALGAE)、溶解性正磷酸盐含量(SRP)的测定,分析了三峡水库正常运行后消落期水体中碱性磷酸酶活性特征及动力学特征,探讨“磷营养状态~碱性磷酸酶活性变化~藻华”之间的相关关系,对河道型水库溶解性正磷酸盐补偿机制的研究提供借鉴.
1 材料与方法
1.1 材料
采样点布置:在主城段布点,研究区域从磁器口开始,两江交汇处结束,约17.6km;在流速为0~0.20m/s的富营养化敏感近岸区域共设5个采样点见图1.各样点名称及属性见表1.
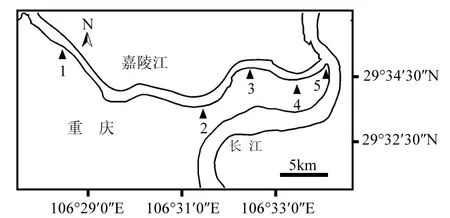
图1 嘉陵江出口段布点Fig.1 Distribution of sampling sites of Jialing River Estuary

表1 嘉陵江出口段采样点位属性Table 1 Characteristic of sampling sites of Jialing River Estuary
1.2 水质指标及分析方法
1.2.1 SRP等水质参数测定 参照《水与废水监测分析方法》(第四版)[25]进行实验室测定.
1.2.2 TAPA测定 在50mL比色管中加入5mL水样和5mL0.3mmol/L对硝基苯磷酸二钠溶液,加入1mL Tris缓冲液调节(pH=8.4),在30℃的恒温箱中培养6h;加入1mLGibbs试剂,将比色管稀释至50mL刻度线,30min后在410nm波长处比色测定;用蒸馏水做对照.
1.3 数据处理
实验数据的统计计算,采用SPSS统计软件和EXCEL软件进行.
酶反应速率最大值Vm及米氏常数Km的求法:每次以0.1,0.3,1.0,1.5,2.0,3.0mmol/L,6组对硝基苯磷酸二钠溶液作为底物进行TAPA的测定,根据Michaelis-Menten方程,采用最小二乘法求出Vm和Km.
2 结果与分析
2.1 TAPA与ALGAE及SRP变化规律
图2为2011~2016年TAPA均值的变化规律.每年12月~次年1月的冬春之交为全年水温最低时期,TAPA逐渐下降,1月为全年最低水平,5个样点TAPA均值为0.5~1nmol/(L·min).2月初水温逐渐升高,TAPA有增加趋势,缓慢上升至0.551~1.289nmol/(L·min).
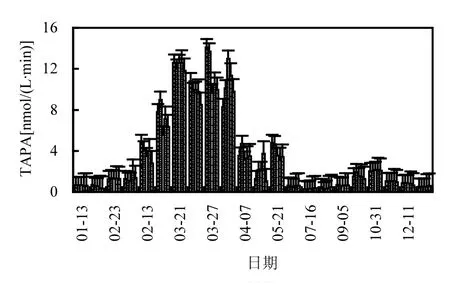
图2 各采样点TAPA变化规律Fig.2 TAPA change of each sampling site

进入消落期后,TAPA为全年最高,3月重庆主城段水体水温略高,硅藻及蓝、绿藻等微生物生长旺盛,5个样点TAPA均有较大幅度的变化,随着水体流速增加,水温上升,微生物活动频繁,氮磷等营养元素的增加使TAPA迅速上升.从3月初的1.289~3.836nmol/(L·min)迅速上升至10.503~11.587nmol/(L·min).磁器口、化龙桥、大溪沟、朝天门4个样点的TAPA相近,两江交汇区略低.4月之后,随着“藻华”迹象的消失TAPA也随之降低至1.0nmol/(L·min)以下.直至9~10月随着汛期的结束,TAPA再次升高.
碱性磷酸酶与磷转化及藻类生长有密切关系.图3和图4为2011~2016年TAPA与溶解SRP及ALGAE均值的年变化规律图.
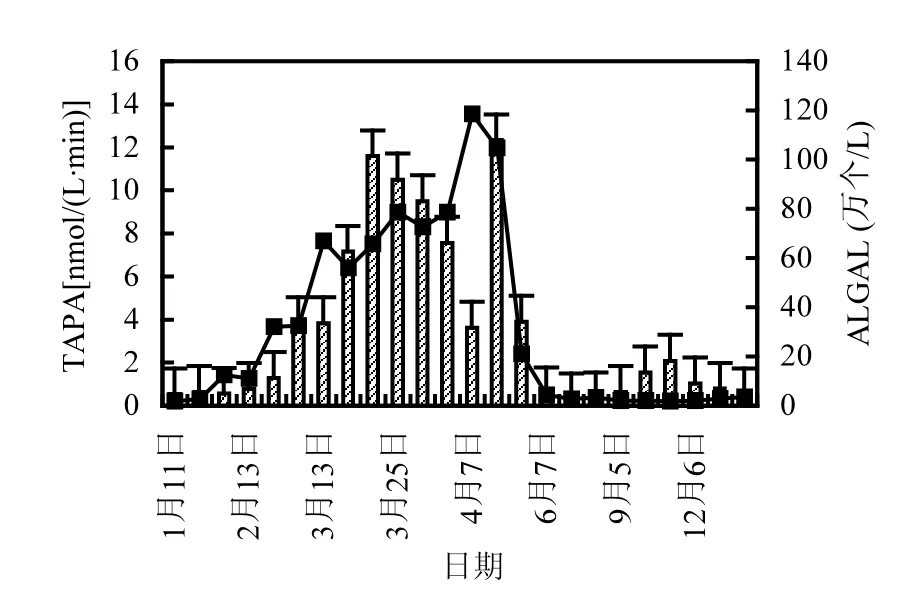
图3 各采样点TAPA~ALGAE含量变化Fig.3 TAPA~ALGAE change of each sampling site
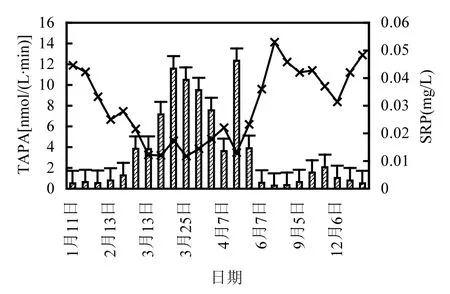
图4 各采样点TAPA~SRP含量变化Fig.4 TAPA~SRP change of each sampling site

从图3、图4中可以看出,每年消落期(3~5月)藻类、浮游植物,浮游动物等微生物量为全年最大时期,此时TAPA活性最强,SRP含量降至全年最低水平,为0.012~0.021mg/L,占TP含量的3%~6%.藻类等微生物在适宜的生境中迅速增殖需要消耗大量的SRP,当水体中SRP含量较低时,将诱导产生大量TAPA促进水体可溶性有机磷水解,释放无机磷,供水体中生物吸收利用.因此,消落期(3~5月)时TAPA为全年最大,SRP则为全年最低.
进入汛期之后,“藻华”暴发现象消失,水流量加大,水体的冲刷稀释作用加强,藻类等微生物活动受到抑制,TAPA下降,SRP含量上升.直到10月蓄水期之后,TAPA、藻类、SRP再次出现相同规律.
2.2 TAPA与ALGAE及SRP相关性分析
结合表2中的SPSS运算结果可知,SRP与TAPA和ALGAE均呈现出显著相关.在每年消落期(3~5月)ALGAE数量出现峰值,在适宜的生境中藻类为了自身生长需要,消耗大量的SRP,因此SRP含量变化与ALGAE生长呈反相关(r=-0.815<0,P=0.001),藻类等微生物为了维持自身生命活动而分泌大量TAPA将其他形式的磷源矿化为能够被自身利用的SRP,因此,TAPA也最大,与ALGAE呈现显著正相关(r=0.809>0, P=0.001).进入汛期之后,“藻华”现象消失,ALGAE数量降低至104个/L以下,水文条件的改变使得藻类活动受到抑制,汛期水体中SRP含量的增加已经能够完全满足藻类生长的需要,藻类不需要额外分泌酶活矿化其他形式的磷源,因此TAPA随之降低.
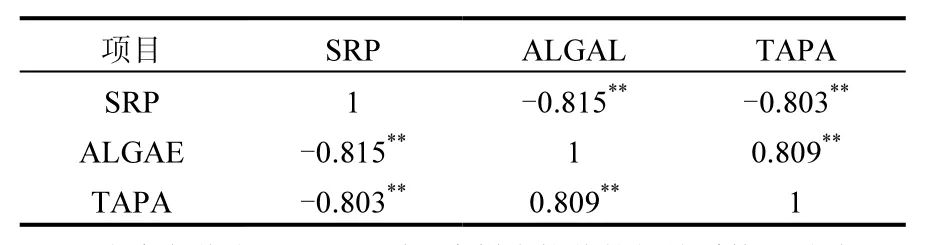
表2 TAPA、ALGAE与SRP相关性分析Table 2 Correlation analysis of TAPA, ALGAE and SRP in each sampling site
2.3 碱性磷酸酶活性的动力学特征
图5反应出各采样点米氏常数Km与最大酶反应速率Vm随时间变化规律.

图5 各采样点动力学参数Km与Vm变化规律Fig.5 Variation of Km and Vm of each sampling site

表3 各样点与Km和Vm的相关性分析Table 3 Correlation analysis of Km and Vm at each sampling site
特征参数Vm和Km值的变化规律验证了TAPA变化的空间和时间的异质性.结果表明,消落期各样点Km为600~1500μmol/L;Vm为1.50~16.0nmol/(L·min),Vm随Km的降低而增加.每年3月,各样点Km为消落期最低,均值为850.32μmol/L,同期Vm均值则高达11.02nmol/(L·min).磁器口右岸水体TAPA具有更高的催化效率(该区域具有更大的Vm和Km值),在消落期(3~5月)该区域迅速增殖的藻类等微生物更易分泌更多的TAPA将可溶性的DOP水解矿化为可被吸收的SRP,弥补水体中可利用磷素含量的不足(SRP=0.01mg/L),为藻类等微生物生长提供充足的SRP.表3中Km与Vm呈现显著负相关说明水体进入3月后,各样点碱性磷酸酶对底物的亲合力增高,酶的水解效率有了显著提升,且磁器口样点有比其他样点更高的催化效率,两江交汇区碱性磷酸酶的催化效率最低.
综上,每年消落期,SRP含量极低时,藻类等微生物为了维持自身生命活动的继续因而分泌大量碱性磷酸酶将其他形式的磷源矿化为能够被自身利用的溶解性磷态.其他学者的研究[26-31]也指出在溶解性正磷酸盐低于某特定值时,TAPA才会迅速升高,虽然SRP的这个特定值可能会受到其他外界条件的影响而出现较大出入.水体中由藻类等微生物合成分泌的碱性磷酸酶矿化磷源的过程是一个复杂的抑制~诱导过程,可能从提高TAPA的反应速率Vm和增加对底物的亲和力Km值这两个途径来提高磷素的利用率,这是浮游生物改善水体缺磷状况的一种策略,同时也为“藻华”的形成创造了前提条件.
3 结论
3.1 三峡库区稳定运行后,水环境因素以水利年为周期循环变化,碱性磷酸酶与磷转化及藻类生长有密切关系.消落期(3~5月)时TAPA为全年最大,与ALGAE显著正相关(r=0.809<0, P=0.001);SRP为全年最低,TAPA与SRP显著负相关(r=-0.803<0,P=0.000).进入汛期之后,“藻华”暴发现象消失,TAPA下降,SRP含量上升.
3.2 消落期TAPA在动力学上表现为最大酶反应速率Vm的骤增和酶反应米氏常数Km的骤减.Vm和Km值的变化规律验证了藻类暴发期各样点碱性磷酸酶对底物的亲合力增高,酶的水解速率有了显著提升,磁器口样点有比其他样点更高的催化效率,两江交汇区碱性磷酸酶的催化效率最低.
3.3 在消落期时,迅速增殖的藻类等微生物分泌更多的碱性磷酸酶将可溶性的DOP水解矿化为可被吸收的SRP,弥补水体中可利用磷素含量的不足,为藻类等微生物生长提供充足的SRP,以利于在适宜的生境中迅速增殖.
[1] 李 哲,方 芳,郭劲松,等.三峡小江回水区段2007年春季水华与营养盐特征 [J]. 湖泊科学, 2009,21(1):36-44.
[2] 方 芳,李 哲,田 光,等.三峡小江回水区磷素赋存形态季节变化特征及其来源分析 [J]. 环境科学, 2009,30(12):3488-3494.
[3] 王 敏,袁绍春,徐 炜,等.嘉陵江重庆出口段小环藻水华影响因素分析 [J]. 重庆交通大学学报, 2016,35(6):86-90.
[4] 张 彦,窦 明,李桂秋,等.考虑光盐交互作用的湖泊富营养化数学模型 [J]. 中国环境科学, 2017,37(11):4312-4322.
[5] 王 倩,吴亚东,丁庆玲,等.西太湖入湖河流水系污染时空分异特征及解析 [J]. 中国环境科学, 2017,37(7):2699-2707.
[6] Ren, Wang P, Wang C, et al. Algal growth and utilization of phosphorus studied by combined mono-culture and co-culture experiments [J]. Environmental Pollution, 2017,220,Part A:274-285.
[7] Dai Y, Wu J, Ma X, et al. Increasing phytoplankton-available phosphorus and inhibition of macrophyte on phytoplankton bloom [J]. Science of The Total Environment, 2017,579:871-880.
[8] Malfatti F, Turk V, Tinta T, et al. Microbial mechanisms coupling carbon and phosphorus cycles in phosphorus-limited northern Adriatic Sea [J]. Science of The Total Environment, 2014,470–471:1173-1183.
[9] Ly J, Philippart C J M, Kromkamp J C. Phosphorus limitation during a phytoplankton spring bloom in the western Dutch Wadden Sea [J]. Journal of Sea Research, 2014,88:109-120.
[10] Lin X, Zhang H, Huang B, et al. Alkaline phosphatase gene sequence characteristics and transcriptional regulation by phosphate limitation in Karenia brevis (Dinophyceae) [J].Harmful Algae, 2012,17:14-24.
[11] Wang S, Jiao L X, Yang S, et al. Effects of organic matter and submerged macrophytes on variations of alkaline phosphatase activity and phosphorus fractions in lake sediment [J]. Journal of Environmental Management, 2012,113:355-360.
[12] 覃仙玲,欧林坚,吕颂辉,等.尖刺拟菱形藻和抑食金球藻碱性磷酸酶生理学特性的比较研究 [J]. 生态科学, 2014,33(1):1-6.
[13] 赵先富,马沛明,邱昌恩,等.聚合硫酸铁除磷效果及藻类的生理生态响应 [J]. 中国环境科学, 2010,30(S1):14-18.
[14] 张 慧,姜锦林,张宇峰,等.微囊藻毒素-LR和铜绿微囊藻裂解液对营养生长期水稻生理生化效应 [J]. 中国环境科学, 2017,37(8):3134-3141.
[15] 何 东,晁建颖,张毅敏,等.藻源性颗粒有机物对磷饥饿微囊藻磷富集与生长的影响 [J]. 中国环境科学, 2016,36(12):3777-3783.
[16] 赵先富,马沛明,刘国祥,等,不同磷浓度对小球藻铜绿微囊藻生长及生理的影响 [J]. 环境科学与技术, 2013,36(11):1-6.
[17] 汪 星,李利强,郑丙辉,等.洞庭湖浮游藻类功能群的组成特征及其影响因素研究 [J]. 中国环境科学, 2016,36(12):3766-3776.
[18] 代亮亮,郭亮亮,吴中奎,等.不同浓度藻类水华对两种沉水植物的影响 [J]. 中国环境科学, 2016,36(9):2765-2773.
[19] Li Z, Chen Q, Xu Q. Modeling algae dynamics in Meiliang Bay of Taihu Lake and parameter sensitivity analysis [J]. Journal of Hydro-environment Research, 2015,9(2):216-225.
[20] Wang L, Wang X, Jin X, et al. Analysis of algae growth mechanism and water bloom prediction under the effect of multi-affecting factor [J]. Saudi Journal of Biological Sciences,2017,24(3):556-562.
[21] Heisler J, Glibert P M, Burkholder J M, et al. Eutrophication and harmful algal blooms: A scientific consensus [J]. Harmful Algae,2008,8(1):3-13.
[22] Xia Z, Zhou Y, Chen F, et al. Stratification of alkaline phosphatase in sediments of two urban lakes and its effect on phosphorus cycle [J].Acta Ecologica Sinica, 2012,32(3):138-143.
[23] 袁 溪,潘忠成,李 敏,等.雨强和坡度对裸地径流颗粒物及磷素流失的影响 [J]. 中国环境科学, 2016,36(10):3099-3106.
[24] 胡建林,刘国祥,蔡庆华,等.三峡库区重庆段主要支流春季浮游植物调查 [J]. 水生生物学报, 2006,30(1):116-119.
[25] 国家环境保护总局.水和废水监测分析方法 [M]. 第四版增补版.北京:中国环境科学出版社, 2002:200-284.
[26] 高 光,高锡芸,秦伯强,等.太湖水体中碱性磷酸酶的作用阈值[J]. 湖泊科学, 2000,12(4):353-358.
[27] 高 光,朱广伟,秦伯强,等.太湖水体中碱性磷酸酶的活性及磷的矿化速率 [J]. 中国科学(D辑:地球科学), 2005,35(3):157-165.
[28] Zhao G, Du J, Jia Y, et al. The importance of bacteria in promoting algal growth in eutrophic lakes with limited available phosphorus [J]. Ecological Engineering, 2012,42(0):107-111.
[29] Kwon H K, Oh S J, Yang H. Ecological significance of alkaline phosphatase activity and phosphatase-hydrolyzed phosphorus in the northern part of Gamak Bay, Korea [J]. Marine Pollution Bulletin, 2011,62(11):2476-2482.
[30] Yoshimura T, Kudo I. Seasonal phosphorus depletion and microbial responses to the change in phosphorus availability in a subarctic coastal environment [J]. Marine Chemistry, 2011,126(1–4):182-192.
[31] Wu Z, Zeng B, Li R, et al. Physiological regulation of Cylindrospermopsis raciborskii (Nostocales, Cyanobacteria) in response to inorganic phosphorus limitation [J]. Harmful Algae,2012,15(0):53-58.
