UV/H2O2光化学降解水中的三氯生
2018-03-02付永胜史鸿乐刘义青周高峰西南交通大学地球科学与环境工程学院四川成都611756
付永胜,史鸿乐,刘义青,周高峰 (西南交通大学地球科学与环境工程学院,四川 成都 611756)
近年来,药品和个人护理品(PPCPs)作为一类新兴的环境污染物,正逐渐引起环保工作者的广泛关注和重视.三氯生(TCS)作为PPCPs中常见的一种,由于其广谱的杀菌特性,被广泛用于个人护理品和日常生活用品(如肥皂,牙膏,洗手液,洗涤剂,护肤品等)[1].全世界每年大约生产1500t的TCS,其中96%以上的TCS被排入污水收集系统,并最终进入水环境[2].目前,除了在生活污水,地表水,地下水,底泥等不同环境介质中不断检出TCS,在藻类,鱼和人类体内也有检出TCS[3-5].有研究表明,TCS对水生生物有毒害作用,能够抑制某些藻类的生长发育;同时能够干扰人体激素的分泌,造成女性乳腺癌的发生[6-7].此外,TCS在环境中的存在还可能会诱发抗药性细菌的出现.因此,它对人体健康和生态系统的影响不容忽视,有必要研究水中TCS的消除技术.
基于羟基自由基(HO˙)的高级氧化技术近年来被广泛用于水中难生物降解有机物和新兴的痕量污染物的处理[8-10].HO˙是一种无选择性的自由基,其氧化还原电位为2.72V[11],具有极强的氧化能力,它可以与大多数有机物反应且反应较快,二级反应速率常数在107~1010L/(mol·s)之间.当前,多种技术可以生成HO˙,如紫外/过氧化氢(UV/H2O2),Fenton法,光Fenton法,光催化法等.其中,UV/H2O2是直接利用紫外光活化H2O2产生HO˙,反应条件温和,无二次污染,因此具有较好的应用前景.目前,利用UV/H2O2降解水中TCS的研究报道较少.已有的文献只考察了H2O2投加量,TCS初始浓度和天然有机物质(NOM)对UV/H2O2降解TCS的影响,缺少对其它常见影响因素(如pH值,无机离子等)对TCS去除影响的研究;且已有的报道检出的反应产物较少[12].因此,本文拟系统地研究UV/H2O2对水中TCS的去除,探讨pH值,H2O2用量,常见无机阴离子(,Cl-,和)和NOM对TCS降解的影响;并利用液相色谱-超高解析度四级杆飞行时间串联质谱仪(LC-QTOF/MS)对TCS的降解产物进行检测分析;最后,基于鉴定的反应产物推测TCS的转化机理.
1 材料与方法
1.1 试剂
三氯生(HPLC级,≥97%)购自Sigma-Aldrich公司;过氧化氢(H2O2,质量分数30%),碳酸氢钠(NaHCO3),硝酸钠(NaNO3),氯化钠(NaCl),硫酸钠(Na2SO4),磷酸一氢钾(K2HPO4),磷酸二氢钾(KH2PO4)和硫代硫酸钠(Na2S2O3)均为分析纯级,购自Fisher Scientific公司;Suwannee河腐殖酸(SRHA)购自国际腐殖质学会(IHSS);甲醇和乙腈均为HPLC级,购于Fisher Scientific公司;去离子水(Milli-pore, 18MΩ·cm)用于试剂和反应液的配置.
1.2 光化学实验
光化学实验在装有两根低压汞灯(Cole-Parmer公司,15W)的平行光发射装置中进行.光源主要发射254nm波长的紫外光,其光强通过校准的光辐射计(IL 1700, International Light公司)进行测定,平均光强为0.1mW/cm2.在TCS降解动力学实验中,TCS初始浓度为1μmol/L,反应溶液pH值利用10mmol/L磷酸盐缓冲液进行调节.在指定的取样时间点,取出0.15mL的反应液加入到装有0.1mL 50mmol/L硫代硫酸钠(淬灭自由基和多余的氧化剂)的液相小瓶中,振荡,混合均匀待测.在TCS降解产物和反应机理研究中,为了提高反应产物的丰度,使用初始浓度为10μmol/L的TCS.在指定的时间间隔,取样并立即进行仪器分析,没有加入淬灭剂,以防止其影响降解产物的测定.除了产物检测,其它所有实验都至少重复3次,得出的数据进行平均数和标准偏差求值,结果图中以平均值做曲线,标准偏差作为误差棒.
1.3 分析方法
高效液相色谱仪(HPLC, Agilent 1100)用于TCS浓度的测定.色谱柱为Discovery HS C18柱(2.1×150mm, 5μm, Supelco公司);流动相由纯水和乙腈(25:75,V/V)组成;流速为0.2mL/min;进样体积为50μL;检测波长为221nm.TCS降解产物利用液相色谱-超高解析度四级杆飞行时间串联质谱仪(LC-QTOF/MS, Agilent公司)进行检测和鉴定.具体方法如下:Agilent ZORBAX Eclipse XDB-C18Narrow Bore Rapid Resolution (2.1× 50mm, 3.5μm)色谱柱用作固定相;流动相由乙腈和纯水组成,采用梯度洗脱的方式:乙腈在前8min由20%提高到85%;然后保持1min;最后,乙腈在1min内由85%降回到20%.流速为0.4mL/min;进样体积为20μL.采用电喷雾电离(ESI),在负离子模式下进行扫描,扫描范围在m/z 50~500.所有质谱数据通过Agilent MassHunter B.04.00工作站软件进行分析.溶液pH值利用pH计(pH meter 245,Corning公司)进行检测.腐殖酸的浓度(以溶解性有机碳计)通过总有机碳分析仪(VCSH-ASI,Shimadzu公司)进行定量.
2 结果与讨论
2.1 H2O2用量的影响
如图1所示,TCS在单独紫外光照下可以发生降解,降解遵循准一级反应动力学,其基于紫外光用量的表观准一级反应速率常数(kobs)为(5.20± 0.28)×10-3cm2/mJ. H2O2的投加能够加快TCS的去除,且H2O2浓度越高,TCS的降解效率越高,这主要归因于生成的HO˙. UV/H2O2对TCS的降解也符合准一级反应动力学,不同H2O2投加量时的TCS表观速率常数kobs见图1内插图.当H2O2浓度小于0.5mmol/L时,kobs随着H2O2用量的增加增长较快;但当H2O2用量超过0.5mmol/L时,kobs随着H2O2浓度的提高缓慢增长.H2O2可以与HO˙发生反应,两者的二级反应速率常数为2.7×107L/(mol·s)[11],因此,过量的H2O2可能会和目标污染物竞争HO˙.类似的结果在我们之前的研究中也有发现[13].
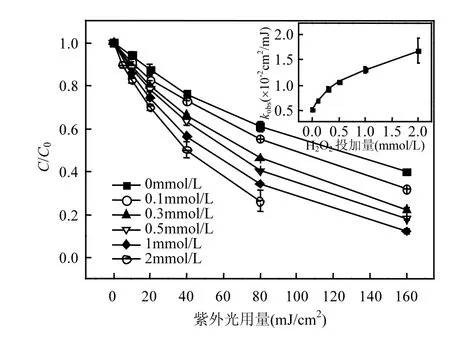
图1 H2O2用量对TCS降解的影响Fig.1 Effect of H2O2 dose on TCS degradation
2.2 pH值的影响
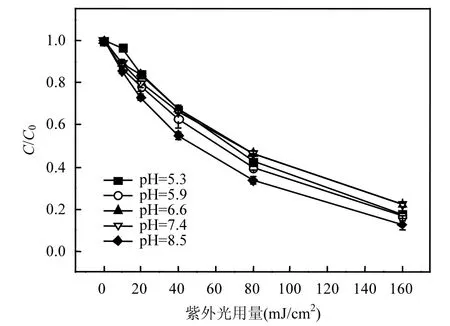
图2 pH值对TCS降解的影响Fig.2 Influence of pH on TCS degradation
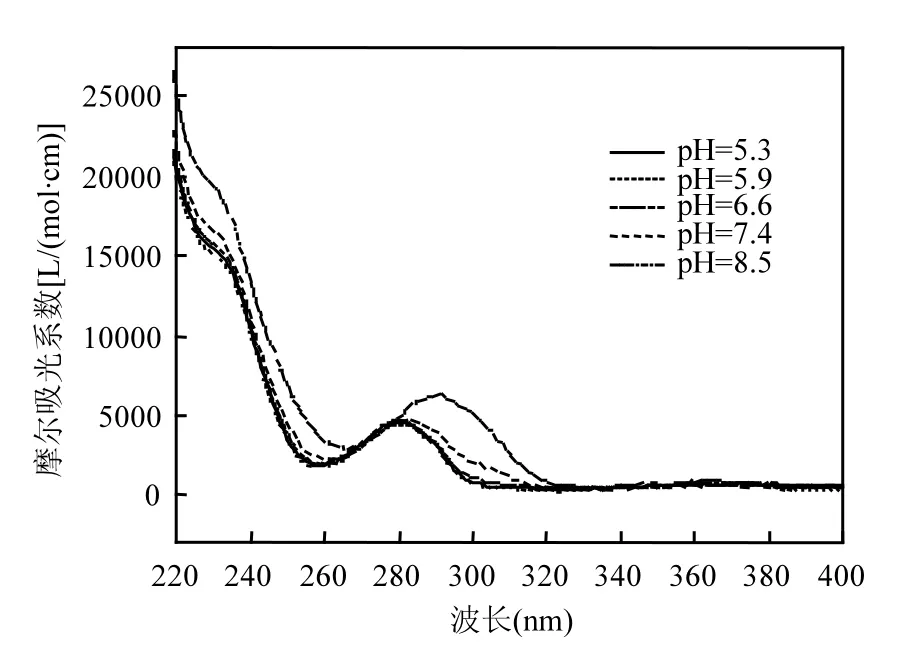
图3 不同pH值下TCS的摩尔吸光系数Fig.3 The molar absorption coefficient of TCS at different pH values
图2为UV/H2O2体系中pH值对TCS去除的影响.在pH 5.3~7.4范围内,TCS的降解基本类似;当pH值为8.5时,TCS的降解效率反而提高.在碱性条件下,氢氧根离子(OH-)的浓度逐渐提高,OH-能够与HO˙发生反应,两者的二级反应速率常数为1.2×1010L/(mol·s)[11].因此,理论上如果目标污染物存在形态不变,其降解效率应该随着pH值的升高而逐渐降低.在本研究中,TCS的pKa为8.1[14].在pH 8.5时,TCS主要以去质子化的形态存在,其摩尔吸光系数较质子化的TCS高(见图3),故在该pH值时TCS的直接光解效率可能要高于研究的其它pH值.此外,有研究表明[12],去质子化的TCS和HO˙的二级反应速率常数大于质子化的TCS和HO˙的二级反应速率常数.因此,这两个方面的因素可能共同导致了本实验的结果.
2.3 无机阴离子的影响
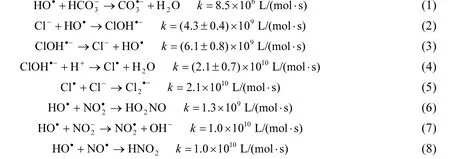
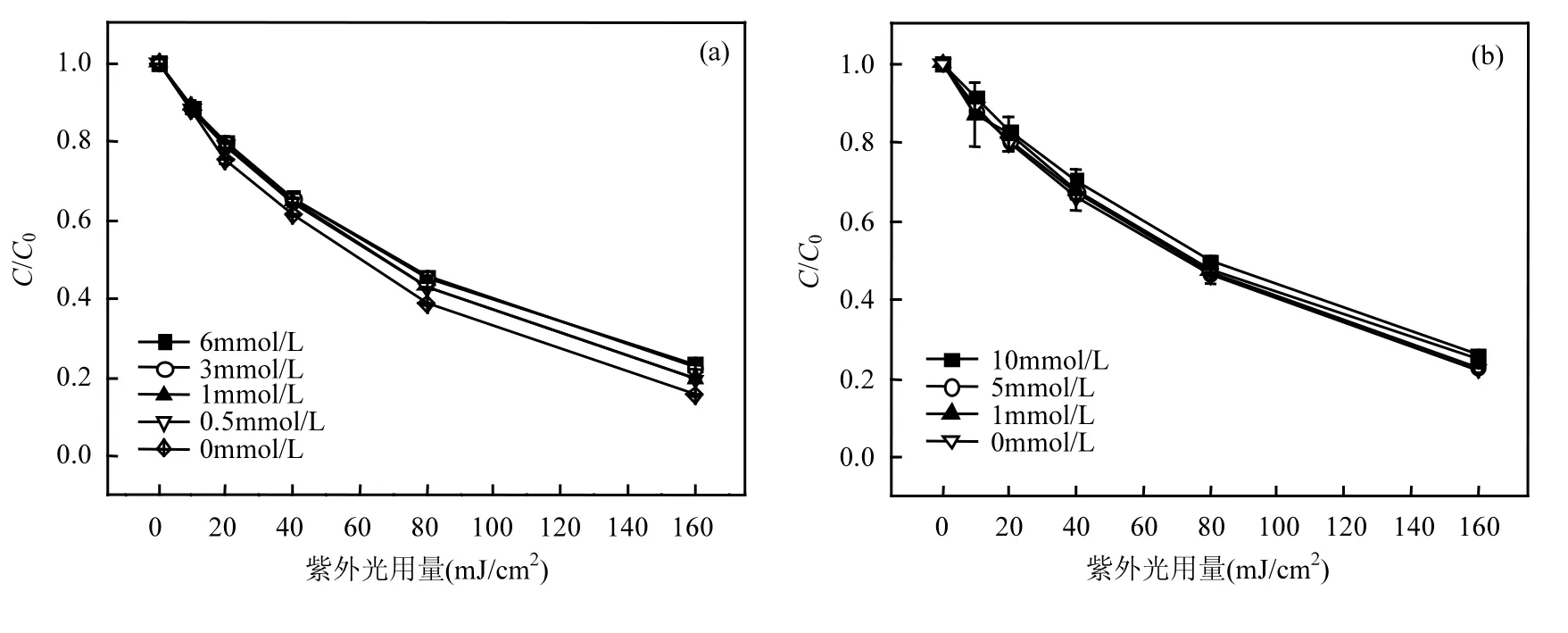
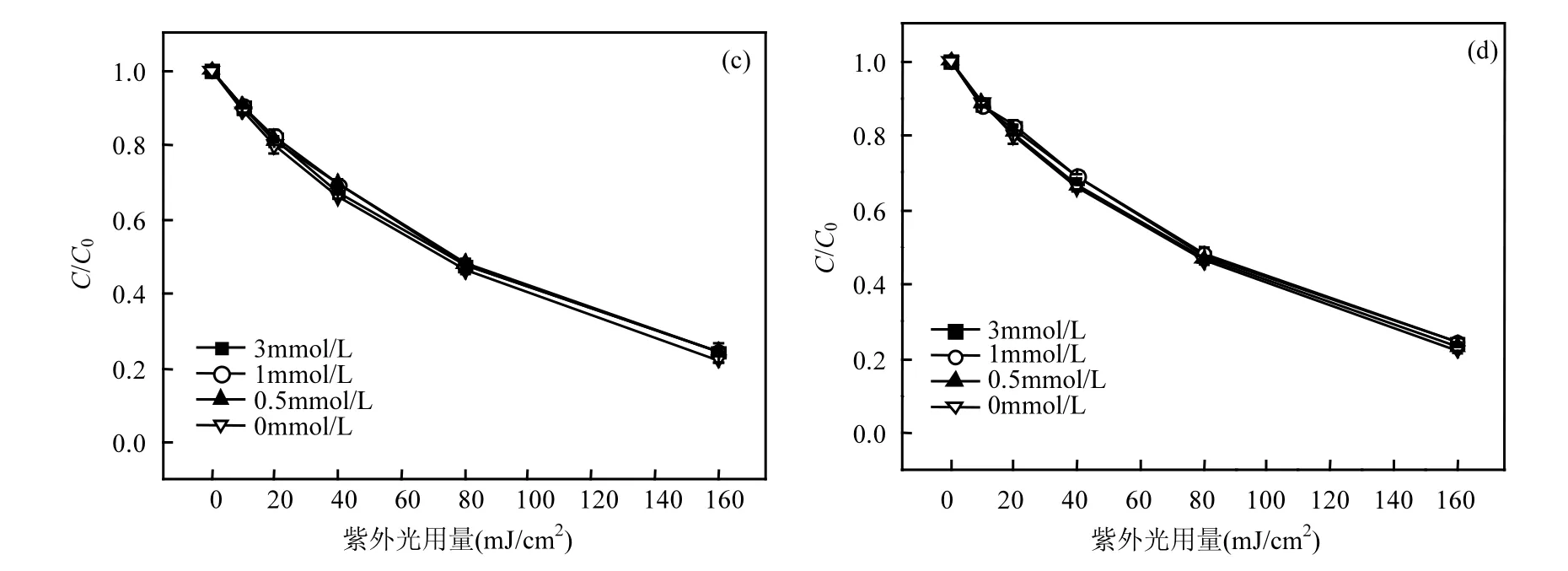
图4 无机阴离子对TCS去除的影响Fig.4 Effect of inorganic anions on TCS removal
2.4 NOM的影响
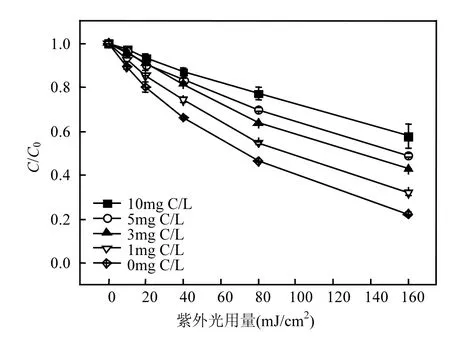
图5 NOM对TCS去除的影响Fig.5 Effect of NOM on TCS removal
本研究利用腐殖酸SRHA代表NOM,探讨NOM对TCS降解的影响,结果如图5所示.NOM的存在会抑制TCS的降解,且NOM浓度越高,抑制作用越明显.这可能是因为:(1)NOM作为一种光敏物质,能够与TCS和H2O2竞争入射的紫外光子,从而既会影响TCS的光解效率,又会影响HO˙的产生[22];(2)NOM和HO˙可以发生反应,两者的二级反应速率常数为2.23×108L/(mol C·s),如式(9)所示[23],导致NOM和TCS竞争HO˙.该结果与罗从伟等[10]研究NOM对UV/H2O2降解TCS影响得出的结论类似.
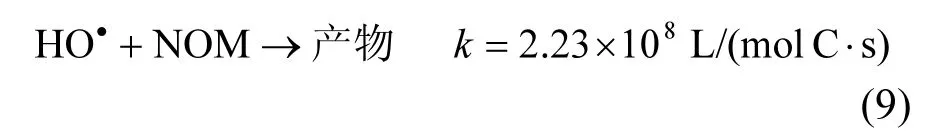
2.5 TCS在实际水体中的降解
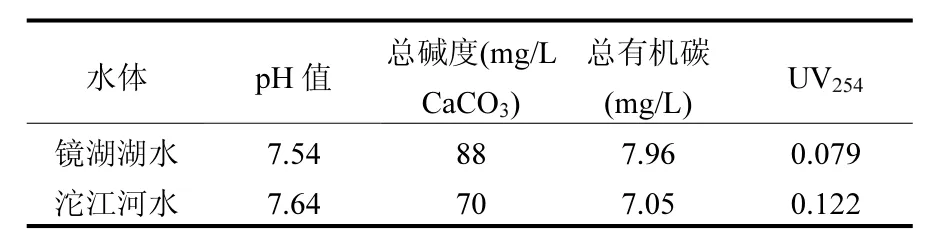
表1 实际水样的水质参数Table 1 Water quality parameters of real waters

图6 TCS在实际水体中的降解Fig.6 Degradation of TCS by UV/H2O2 in real waters
为了研究UV/H2O2对实际水体中TCS的去除效果,收集了2种不同的实际水样,分别为西南交通大学镜湖湖水和沱江河水.2种水样的水质参数如表1所示.由于这2种水样的pH值都在7.5左右,水样中的碱度主要是以HCO3-的形式存在.为了与纯水中TCS的去除进行比较,分别向2个实际水样中加入了1μmol/L的TCS,其在UV/H2O2中的降解如图6所示.与纯水中的相比,TCS在实际水体中的降解都受到了一定程度的抑制,这可能归因于实际水样中HCO3-和NOM的抑制作用,如上述讨论.
2.6 TCS降解产物及机理分析
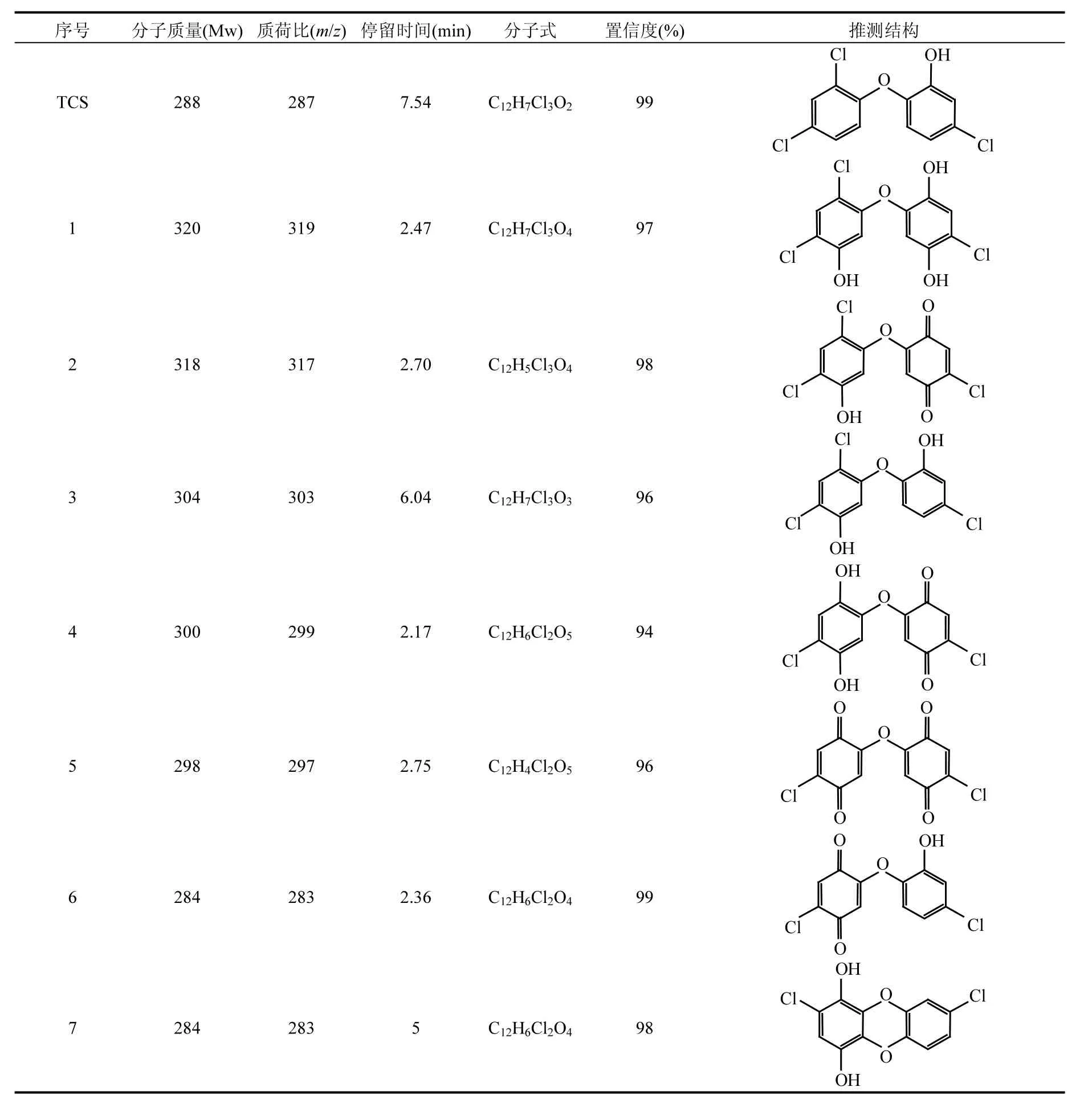
表2 TCS降解产物Table 2 Degradation products of TCS by UV/H2O2

续表2
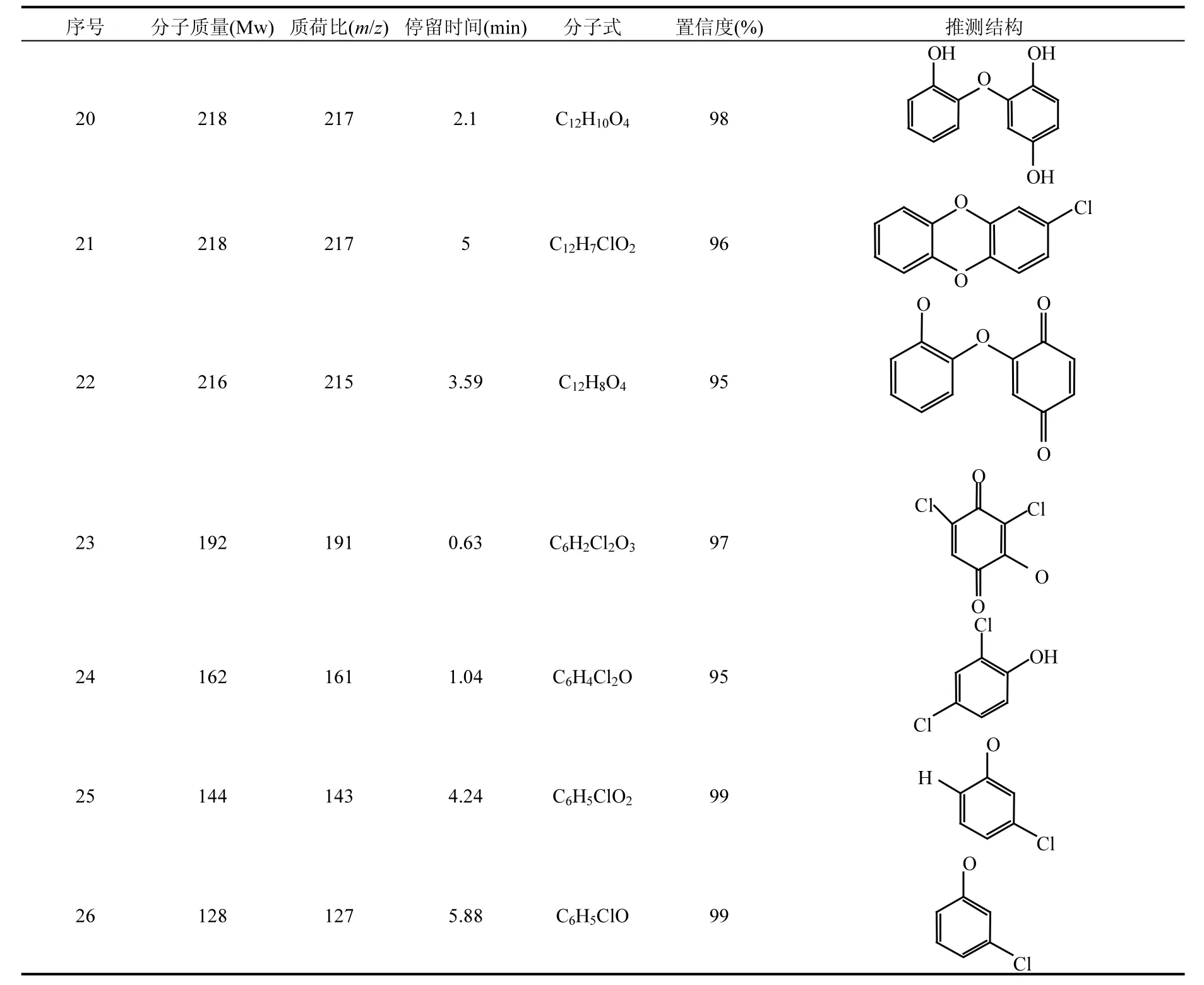
续表2
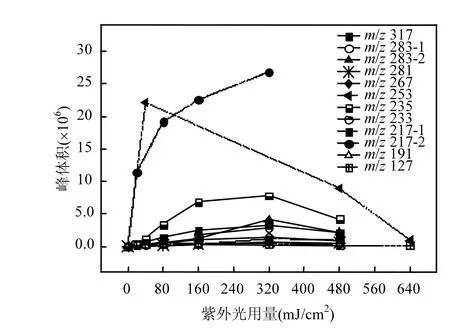
图7 TCS反应产物随时间的变化Fig.7 Evolution of major reaction products of TCS by UV/H2O2
在UV/H2O2降解TCS的过程中,共检出26种反应产物,它们的分子质量(Mw),质荷比(m/z),停留时间,分子式和可能的结构见表2.其中,部分主要降解产物的浓度随时间的变化如图7所示.由于缺少反应产物的标准物质,故不能对其浓度进行定量,因此本研究直接采用各个产物的峰体积数值(从质谱分析软件MassHunter B.04.00直接获得)来反映每种产物在反应体系中浓度的变化.基于这些检测到的降解产物,推测了UV/H2O2降解TCS的反应机理,主要包括6种不同的转化路径,分别为:(1)脱氯氢化,(2)脱氯羟基化,(3)羟基化,(4)脱氢反应,(5)环化反应,(6)醚键断裂,如图8所示.
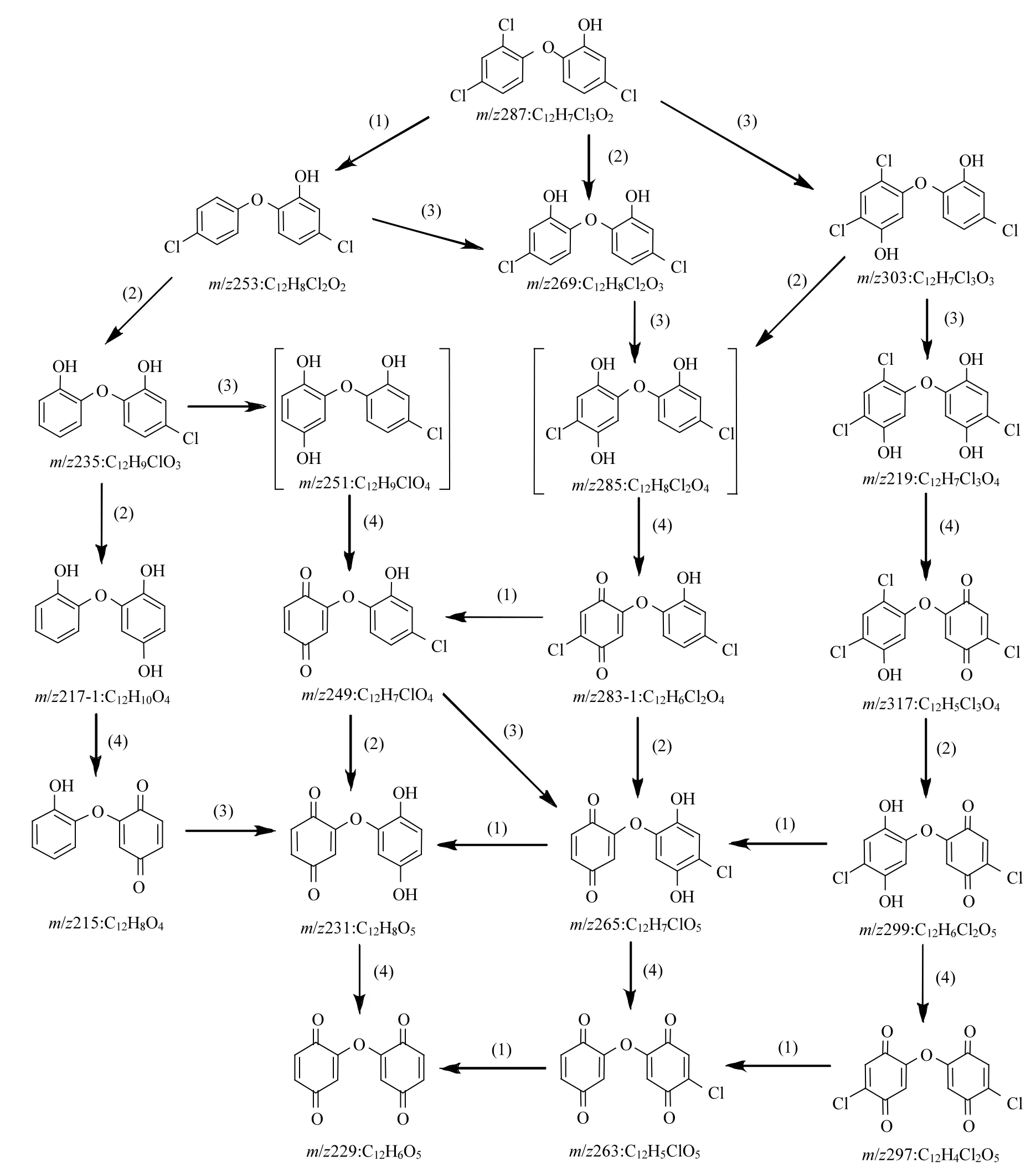
图8 TCS在UV/H2O2中可能的降解路径Fig.8 Possible degradation pathways of TCS in UV/H2O2
TCS通过路径(1),(2)和(3)可以分别生成产物m/z 253, 269和303.生成的m/z 253通过脱氯羟基化可以转化为产物m/z 235,它通过路径(2)和(4)依次转化为m/z 217-1和215;通过途径(3)和(4)可以生成m/z 249,该产物通过脱氯羟基化和脱氢反应可以进一步生成m/z 231和229.产物m/z 269除了由TCS转化生成,还可以由m/z 253通过羟基化反应生成,该产物通过(3)和(4)可以转化为m/z 283-1,其通过路径(2)和(4)可以进一步转化为产物m/z 265和263.m/z 303通过羟基化反应可以生成m/z 319,进一步通过脱氢反应生成m/z 317,该产物通过脱氯羟基化和脱氢反应可以依次转化为m/z 299和297.此外,TCS通过环化反应可以产生m/z 251;通过醚键断裂可以生成产物m/z 143, 127和161.生成的m/z 251通过途径(3)和(4)可以依次转化为m/z 267, 283-2和281;通过(1)和(3)可以依次生成m/z 217-2和233.产物m/z 233还可以由m/z 267通过脱氯氢化反应生成.m/z 161通过(3)和(4)可以转化为产物m/z 191,见图8.罗从伟[12]等在UV/H2O2降解TCS的反应过程中只检出6种反应产物,分别为m/z 269, 253, 235, 219, 161和143.除了产物m/z 219,其他5种产物在本研究中均有检出.
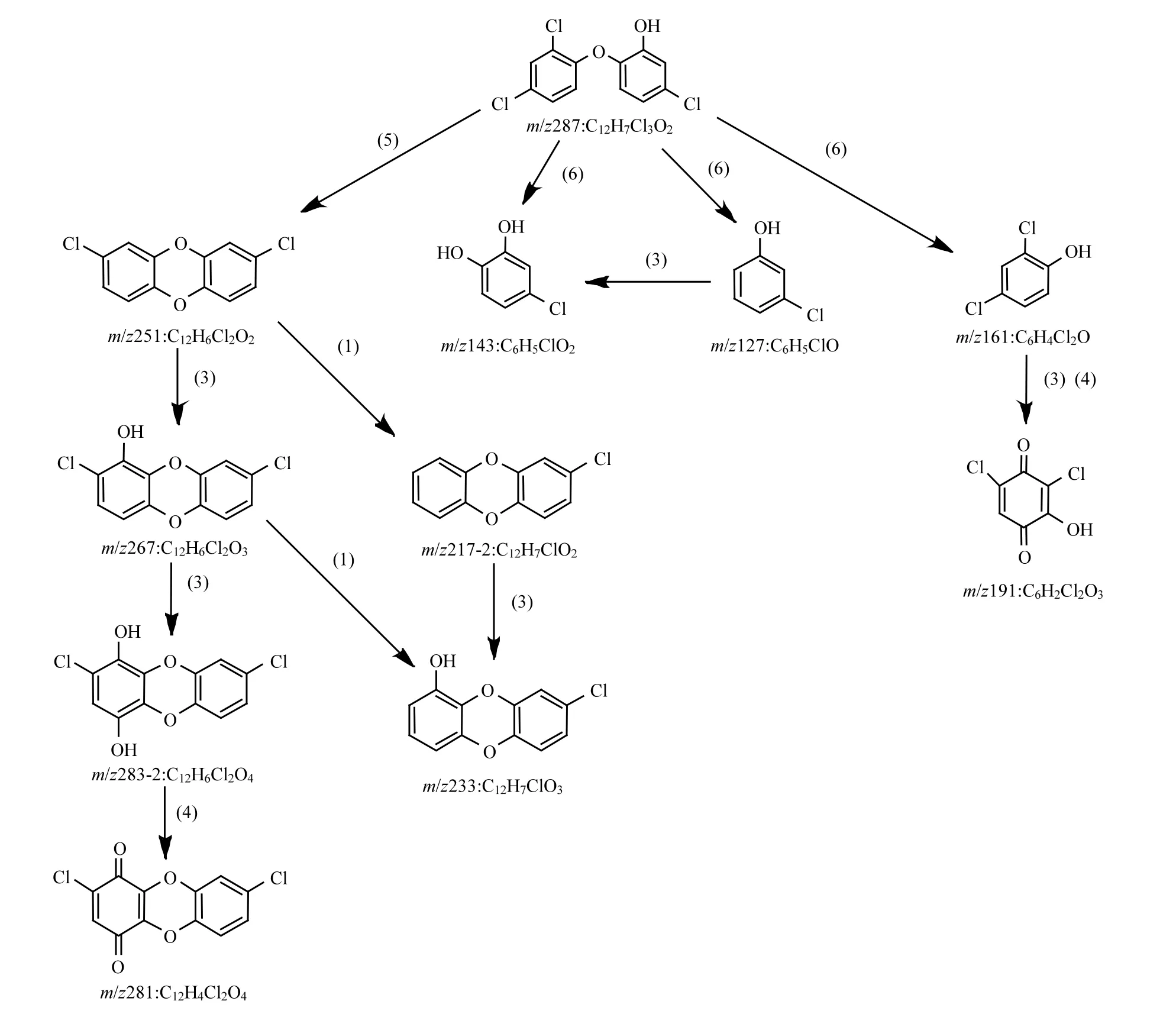
图8 (续)Fig.8 (continued)
在检出的这26种降解产物中,m/z 251即为2,8-二氯二苯并-对-二噁英(2,8-DCDD),其毒性更强持久性更长[24].此外,还有多种2,8-DCDD的衍生物(如m/z 267, 283, 281, 233和217)和多种醌类化合物(如m/z 317, 297, 263, 229, 215,191等)产生,故反应后的溶液毒性可能会有所增强,下一步将对反应液的毒性进行研究.
3 结论
3.1 UV/H2O2对TCS的降解遵循准一级反应动力学,TCS的去除效率随着H2O2用量的增加而逐渐提高,但是过量的H2O2能够成为HO˙的淬灭剂.3.2 由于去质子化的TCS摩尔吸光系数高于质子化的TCS,且其与HO˙的二级反应速率常数也大于质子化的TCS,故TCS在pH 8.5时的降解效率要高于研究的其它pH值.
3.3 UV/H2O2体系中不同浓度,Cl-,和的存在对TCS的降解影响较小;NOM的存在会抑制TCS的去除,且NOM浓度越高,抑制作用越明显.
3.4 与纯水中TCS的降解相比,它在实际水体中的去除受到了一定程度的抑制.
3.5 UV/H2O2降解TCS的反应过程中共检出26种转化产物,基于这些鉴定的降解产物推测TCS可能的反应机理主要包括6种不同的反应路径,分别为脱氯氢化,脱氯羟基化,羟基化,脱氢反应,环化反应和醚键断裂.
[1] Gao Y, Ji Y, Li G, et al. Mechanism, kinetics and toxicity assessment of OH-initiated transformation of triclosan in aquatic environments [J]. Water Research, 2014,49(2):360-370.
[2] Chen X J, Richard J, Liu Y L, et al. Ozonation products of triclosan in advanced wastewater treatment [J]. Water Research,2012,46(7):2247-2256.
[3] Wilson B A, Smith V H, Denoyelles F, et al. Effects of three pharmaceutical and personal care products on natural freshwater algal assemblages [J]. Environmental Science & Technology,2003,37(9):1713-1719.
[4] Liang X M, Nie X P, Ying G G, et al. Assessment of toxic effects of triclosan on the swordtail fish (Xiphophorus helleri) by a multibiomarker approach [J]. Chemosphere, 2013,90(3):1281-1288.
[5] Geens T, Neels H, Govaci A. Distribution of bisphenol-A,triclosan and n-nonylphenol in human adipose tissue, liver and brain [J]. Chemosphere, 2012,87(7):796-802.
[6] Ishibashi H, Matsumura N, Hirano M, et al. Effects of triclosan on the early life stages and reproduction of medaka Oryzias Iatipes and induction of hepatic vitellogenin [J]. Aquatic Toxicology, 2004,67(2):167-179.
[7] Gee R H, Charles A, Taylor N, et al. Oestrogenic and androgenic activity of triclosan in breast cancer cells [J]. Journal of Applied Toxicology, 2008,28(1):78-91.
[8] 罗从伟,马 军,江 进,等.UV/H2O2降解2,4,6-三氯苯甲醚动力学及产物研究 [J]. 中国环境科学, 2017,37(5):1831-1837.
[9] 成建国,白敏冬,余忆玄,等.羟基自由基氧化降解水中二-甲基异莰醇 [J]. 中国环境科学, 2017,37(11):4166-4172.
[10] 吴彦霖,诸秀芬,赵建夫,等.羟基自由基和水合电子降解对叔丁基酚的研究 [J]. 中国环境科学, 2016,36(8):2323-2328.
[11] Shah N S, He X, Khan H M, et al. Efficient removal of endosulfan from aqueous solution by UV-C/peroxides: a comparative study [J].Journal of Hazardous Materials, 2013,263(2):584-592.
[12] 罗从伟,马 军,江 进,等.UV/H2O2降解三氯生动力学及反应机理 [J]. 哈尔滨工业大学学报, 2017,49(2):26-31.
[13] Liu Y, He X, Fu Y, et al. Degradation kinetics and mechanism of oxytetracycline by hydroxyl radical-based advanced oxidation processes [J]. Chemical Engineering Journal, 2016,284:1317-1327.
[14] Kliegman S, Eustis S N, Arnold W A, et al. Experimental and theoretical insights into the involvement of radicals in triclosan phototransformation [J]. Environmental Science & Technology,2013,47(13):6756-6763.
[15] He X, Pelaez M, Westrick J A, et al. Efficient removal of microcystin-LR by UV-C/H2O2in synthetic and natural water samples [J]. Water Research, 2012,46(5):1501-1510.
[16] Canonica S, Kohn T, Mac M, et al. Photosensitizer method to determine rate constants for the reaction of carbonate radical with organic compounds [J]. Environmental Science & Technology,2005,39(23):9182-9188.
[17] Liao C H, Kang S F, Wu F A. Hydroxyl radical scavenging role of chloride and bicarbonate ions in the H2O2/UV process [J].Chemosphere, 2001,44(5):1193-1200.
[18] Neta P, Huie R E, Ross A B. Rate constants for reactions of inorganic radicals in aqueous solution [J]. Journal of Physical and Chemical Reference Data, 1988,17(3):1027-1284.
[19] Mark G, Korth H G, Schuchmann H P, et al. The photochemistry of aqueous nitrate ion revisited [J]. Journal of Photochemistry and Photobiology A: Chemistry, 1996,101(2/3):89-103.
[20] Baxendale J H, Wilson J A. The photolysis of hydrogen peroxide at high light intensities [J]. Transactions of the Faraday Society,1957,53:344-356.
[21] Keen O S, Love N G, Linden K G. The role of effluent nitrate in trace organic chemical oxidation during UV disinfection [J].Water Research, 2012,46(16):5224-5234.
[22] Liao C H, Gurol M D. Chemical oxidation by photolytic decomposition of hydrogen peroxide [J]. Environmental Science& Technology, 1995,29(12):3007-3014.
[23] Westerhoff P, Mezyk S P, Cooper W J, et al. Electron pulse radiolysis determination of hydroxyl radical rate constants with Suwannee River fulvic acid and other dissolved organic matter isolates [J].Environmental Science & Technology, 2007,41(13):4640-4646.
[24] Latch D E, Packer J L, Arnold W A, et al. Photochemical conversion of triclosan to 2,8-dichlorodibenzo-p-dioxin in aqueous solution [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2003,158(1):63-66.
