脑胶质瘤共面、非共面容积旋转调强及螺旋断层放射治疗技术的剂量学比较研究*
2018-03-02许敬辉廖雄飞陈亚正
王 宇 吴 文 许敬辉 廖雄飞 黎 杰 陈亚正*
放射治疗是恶性肿瘤治疗的主要手段之一,集外科肿瘤学、内科肿瘤学一体成为治疗恶性肿瘤的主要手段。据Tubianal999年报告,约45%的恶性肿瘤可治愈,其中放射治疗可治愈18%,仅次于手术治愈的22%[1-6]。目前,共面容积旋转调强放射治疗(volumetric modulated arc therapy,VMAT)的放射治疗技术已成为临床上主要治疗技术,是在调强放射治疗(intensity modulated radiation therapy,IMRT)和图像引导放射治疗(image guided radiation therapy,IGRT)的基础上,随着计算机的发展及放射治疗技术和设备的改进而产生的更为先进的精确放射治疗新技术[7]。VMAT可以根据治疗计划的复杂程度自动调节剂量率、机架旋转速度及子野个数等多个自由度。相比于IMRT技术,VMAT在肿瘤靶区均匀度及适形度方面均有提高,危及器官的平均剂量降低,并能够减少机器跳数和治疗时间,从而提高肿瘤治疗的增益比[8-9]。VMAT技术在放射治疗期间能使机架角度及速度、备份光栅、剂量率、MLC叶片位置和准直器角度5个部分同时操作,将MLC动态调强和弧形照射技术的结合,可在360°多弧设定的任何角度范围内旋转照射,使整个治疗时间缩短至2~6 min。
近年来,VMAT在临床的各种肿瘤治疗上具有良好的获益。为此,本研究对比不同类型脑胶质瘤患者术后在共面VMAT、非共面VMAT(non VMAT)及螺旋断层(TOMO)放射治疗计划之间的剂量学差异,评价不同放射治疗计划的差别。
1 材料与方法
1.1 一般材料
收集2016年6月至2017年1月在四川省肿瘤医院确诊为脑胶质瘤的7例患者CT图像资料,并进行回顾性分析,其中男性4例,女性3例;年龄27~65岁,平均年龄(45±3.2)岁。对每个病例分别制定共面VMAT、non VMAT和TOMO计划,并将其定义为共面VMAT计划组、non VMAT计划组和TOMO计划组。
1.2 纳入标准
所有患者均经病理检查,全部证实为高级别脑胶质瘤。
1.3 仪器与材料
采用Varian Eclipse 11.0放射治疗计划系统(美国Varian公司);TOMO放射治疗计划系统(美国Accuray公司)。
1.4 治疗方法
(1)制定放射治疗计划。所有病例靶区以及正常组织由一名肿瘤医师勾画,并将所有勾画好的靶区及危及器官分别传输至Eclipse11.0及TOMO放射治疗计划系统。对7例患者设计共面VMAT及non VMAT治疗计划,采用Eclipse治疗计划系统进行逆向优化,以计划临床靶体积(planning clinical target volume,PCTV)的中心为照射野中心,采用合适的机架角度拉弧,分别进行共面、非共面照射。TOMO组铅门宽度为1.5 cm,螺距为0.287 cm,束流强度调制因子为3,采用360°旋转照射方式对患者实施放射治疗。
(2)处方剂量及分割方式。3组均给予相同的处方剂量及分割方式,水肿区PCTV处方剂量为54 Gy/30 F,靶区计划肿瘤体积(planning gross tumor volume,PGTV)照射剂量为60 Gy/30 F。要求处方剂量为95%靶体积剂量(D95),最大剂量(Dmax)<110%。依据肿瘤放射治疗协作组织(radiation therapy oncology group,RTOG)02-25的标准限制危及器官(organ at risk,OAR)剂量:①视网膜Dmax≤55 Gy,晶体Dmax越小越好,视神经Dmax≤54 Gy,视交叉Dmax≤54 Gy;②脑干Dmax≤56 Gy。根据OAR限量进行初步参数设定,并经计算机优化后得出治疗计划的初步方案,在优先满足靶区覆盖率的前提下调整参数及优先级,尽量减少危及器官的受量,经计算机多次优化后根据优化结果不断调整参数,最终得出较为合理的治疗计划。
1.5 观察与评价指标
(1)对三组的PGTV和PCTV的Dmax、Dmean及Dmin进行评价。
(2)对三组的均匀性指数(homogeneity index,HI)及适形度指数(conformity index,CI)进行比较。
(3)比较三组危及器官的Dmax及Dmean参考指标间的剂量差异。
1.6 统计学方法
采用SPSS 19.0统计软件对所有数据进行分析,统计数据以均值士标准差(x-±s)表示,进行配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 三组PGTV的Dmean、D95、CI及HI参考指标比较
(1)对于靶区PGTV,共面VMAT、non VMAT及TOMO等剂量曲线均能满足处方剂量D95要求。其中,TOMO计划组Dmean为(61.18±0.13)Gy,优于其他两组计划(61.41±0.16)Gy和(61.47±0.25)Gy,其差异有统计学意义(F=6.500,P<0.05)。三组计划的D95分别为(60.05±0.05)Gy、(60.2±0.38)Gy及(60±0)Gy,其差异无统计学意义,均能很好满足靶区处方要求。
(2)共面VMAT计划组与non VMAT计划组和TOMO计划组的CI值接近,差异无统计学意义;但non VMAT计划组与TOMO计划组的CI值差异有统计学意义(F=3.211,P<0.05),TOMO计划组靶区适形度较non VMAT组计划适形度好。
(3)non VMAT计划组与共面VMAT计划组、TOMO计划组的HI值接近,差异无统计学意义,但共面VMAT计划组与TOMO计划组的HI值差异有统计学意义(F=4.068,P<0.05),见表1。
2.2 三组PCTV的Dmean、D95、CI及HI参考指标比较
对于水肿区PCTV的共面VMAT、Non VMAT、TOMO等剂量曲线均能满足处方(D95)要求。其中,TOMO计划Dmean(56.24±0.63)Gy优于其他两组计划(57.72±0.97)Gy、(57.71±1.14)Gy,差异有统计学意义(F=12.755,P<0.05)。三组计划的D95分别为(54.12±0.26)Gy、(54.18±0.32)Gy及(54±0)Gy,其差异无统计学意义。三组计划的CI值其差异无统计学意义。共面VMAT计划组与TOMO计划组的HI值比较,差异有统计学意义(F=1.714,P<0.05),TOMO计划组水肿区(PCTV)均匀性较共面VMAT计划组更好,见表2。
2.3 危及器官参考指标比较
对于晶体、视网膜及右侧视神经的保护,TOMO计划组的Dmax平均受量分别为(2.87±1.59)Gy、(3.08±1.68)Gy、(14.93±8.7)Gy、(21.43±13.01)Gy和(28.54±21.74)Gy,优于其他两组,差异具有统计学意义(F=12.214,P<0.05);对于视交叉和左侧视神经,三组计划差异无统计学意义。脑干属于串行器官,TOMO计划组的Dmax(41.23±15.72)Gy优于non VMAT计划组Dmax(44.14±16.33)Gy,差异具有统计学意义(F=2.895,P<0.05),见表3、表4。
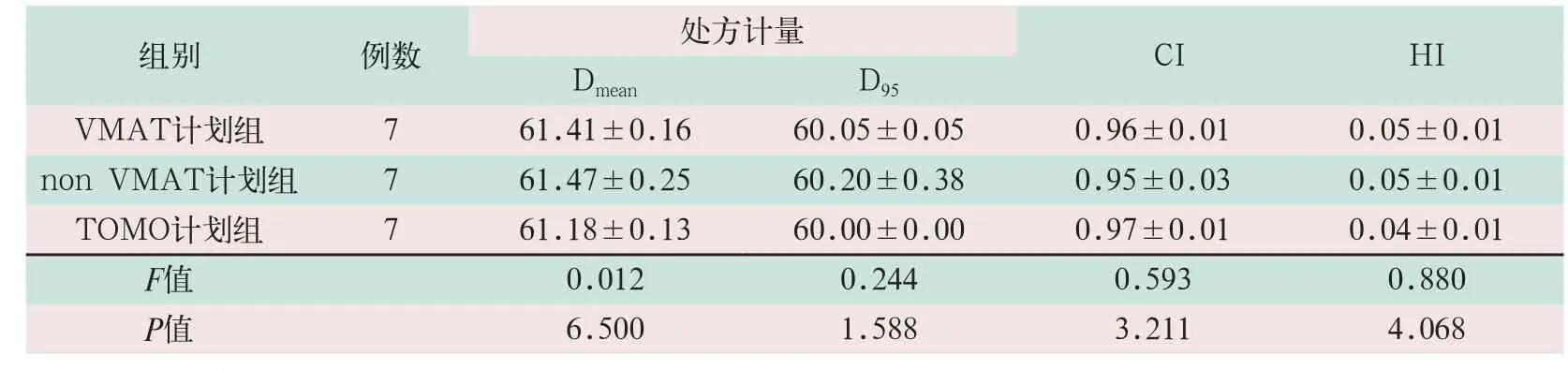
表1 三组PGTV的Dmean、D95、CI及HI参考指标比较(x-±s,Gy)
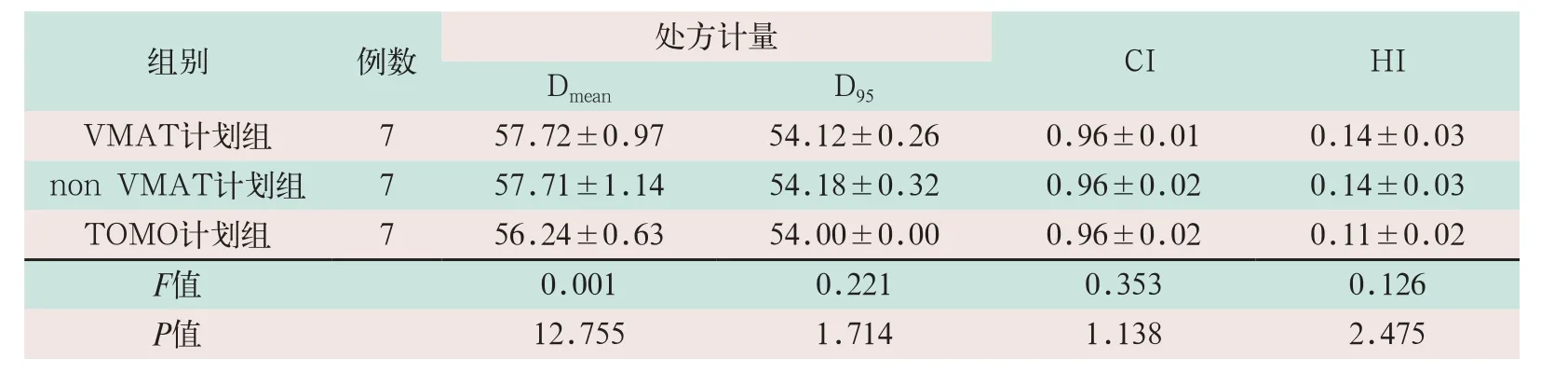
表2 三组水肿区(PCTV)的CI及HI参考指标比较(x-±s,Gy)
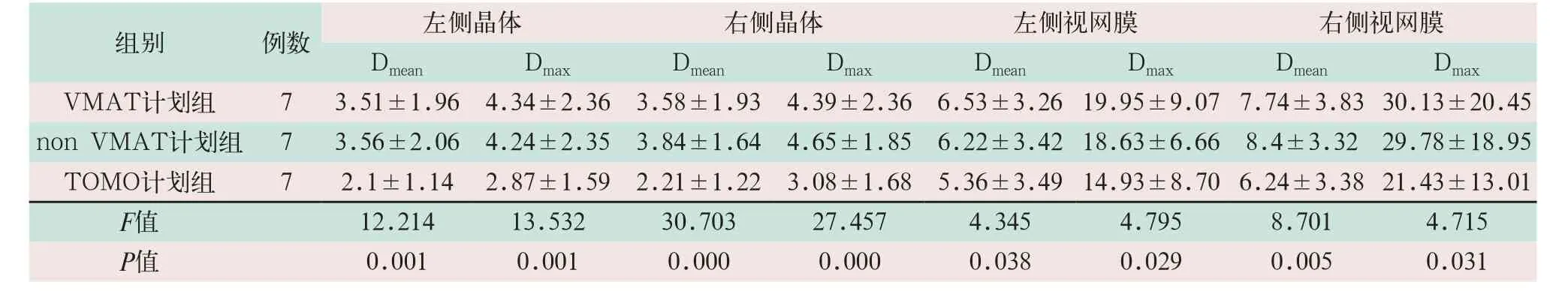
表3 共面VMAT、non VMAT与TOMO计划危及器官晶体和视网膜参考指标比较(x-±s,Gy)
表4 共面VMAT、non VMAT与TOMO计划危及器官视神经、视交叉和脑干参考指标比较,Gy)
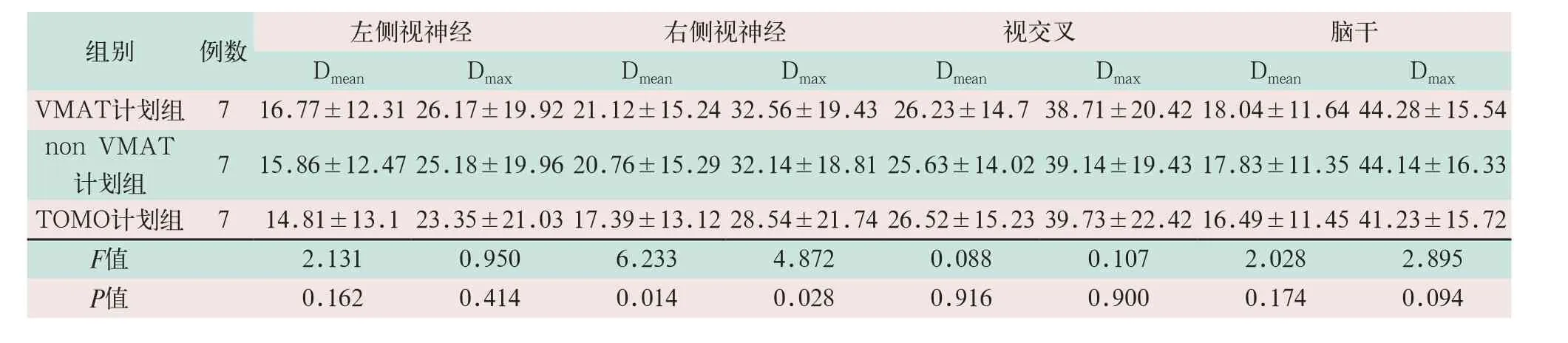
表4 共面VMAT、non VMAT与TOMO计划危及器官视神经、视交叉和脑干参考指标比较,Gy)
组别 例数 左侧视神经 右侧视神经 视交叉 脑干Dmean Dmax Dmean Dmax Dmean Dmax Dmean Dmax VMAT计划组 7 16.77±12.31 26.17±19.92 21.12±15.24 32.56±19.43 26.23±14.7 38.71±20.42 18.04±11.64 44.28±15.54 non VMAT计划组 7 15.86±12.47 25.18±19.96 20.76±15.29 32.14±18.81 25.63±14.02 39.14±19.43 17.83±11.35 44.14±16.33 TOMO计划组 7 14.81±13.1 23.35±21.03 17.39±13.12 28.54±21.74 26.52±15.23 39.73±22.42 16.49±11.45 41.23±15.72 F值 2.131 0.950 6.233 4.872 0.088 0.107 2.028 2.895 P值 0.162 0.414 0.014 0.028 0.916 0.900 0.174 0.094
3 讨论
随着放射治疗的发展,从适形IMRT、IGRT到最新的TOMO。TOMO集IMRT、IGRT和剂量引导放射治疗(dose guided radiation therapy,DGRT)于一体,是当今最先进的肿瘤放射治疗设备,其独创性的设计使直线加速器与螺旋CT完美结合,突破了传统加速器的诸多限制,在CT引导下360°聚焦断层照射肿瘤,能高效、精确地治疗恶性肿瘤。因此,TOMO是肿瘤治疗史上具有革命性的里程碑[10]。
理想的放射治疗方案应包括:①最大放射剂量值在肿瘤靶区内,且不超过处方的110%;靶区内高剂量分布情况与靶区形状一致或大致相似;②靶区外各危及器官及正常组织所受照射剂量最小;③靶区的定位准确且重复性好。Wilson等[11]提出了更为简单、高效的单弧旋转调强方式(VMAT),其作为一种新的放射治疗方式,在计划执行过程中剂量率、机架速度和MLC叶片位置等参数动态地改变,目前投入临床使用的VMAT治疗产品有美国Varian RapidArc和瑞典Elekta VMAT,随着RapidArc和VMAT的临床应用,已经证实VMAT计划质量相当或稍优于固定机架角IMRT和螺旋断层放射治疗。VMAT与固定野IMRT相比,其具有提高受照射正常组织分散度、减少加速器输出剂量(MU)和节省治疗时间等优点,其实施效率更高[12]。螺旋断层放射治疗系统是直线加速器和螺旋CT的完美结合,其剂量分布具有优异的适形性和高度的均匀性,能更好保护危及器官。Pezner等[13]对颅内肿瘤进行IMRT与TOMO计划剂量学比较的研究表明,TOMO计划具有更好的剂量均匀性和剂量梯度[22]。Yartsev等[14]和Franzese等[15]对多种现行的放射外科进行比较后表明,TOMO放射治疗具有最好的靶区均匀性和适形指数。
头颈部有很多重要器官,如晶体、视神经和脑干等,为了尽量避免这些重要器官受到较多剂量的照射,有必要考虑非共面调强。在选择移动床转角过程中,也要考虑到防止医用加速器机头与床相撞的情况,根据实际操作,发现对于头颈部肿瘤照射,治疗床转角的弧度为0°~30°。在如此小的范围内进行非共面旋转调强,其结果与共面旋转调强在某些器官的剂量方面并无较大差异。但是螺旋断层放射治疗在靶区适形度、均匀性指数以及正常器官剂量有较大优势。
本研究为脑胶质瘤放射治疗提供了三种放射治疗方式,为临床医师和物理师制作计划设计提供了数据参考。
[1]殷蔚伯,谷铣之.肿瘤放射治疗学[M].3版.北京:中国协和医科大学出版社,2002:1081.
[2]张仁生.Sox-2、TBX2在人脑胶质瘤的表达及临床意义[D].长春:吉林大学,2011.
[3]殷蔚伯,佘子豪,徐国镇.肿瘤放射治疗学[M].4版.北京:中国协和医科大学出版社,2008:1126-1127.
[4]费舟,章翔,蒋晓帆,等.长期生存脑恶性胶质瘤患者治疗随访研究[J].中华神经外科疾病研究杂志,2006,5(5):449-451.
[5]McGirt MJ,Chaichana KL,Gathinji M,et al.Independent association of extent of resection with survival in patients with malignant brain astrocytoma[J].J Neurosuig,2009,110(1):156-162.
[6]康红兵,肖爱农.脑胶质瘤术后适形放疗的临床研究[J].中国现代医生,2008,46(28):34-35.
[7]张矛,金海国,卜明伟,等.脑胶质瘤术后VMAT与IMRT放疗技术间比较[J].中国医学物理学杂志,2011,28(6):2959-2963.
[8]吴昊,韩树奎,孙艳,等.局部进展期鼻咽癌快速旋转调强与固定野动态调强放疗的剂量学比较[J].中华放射肿瘤学杂志,2010,19(5):410-413.
[9]占加元.恶性脑胶质瘤综合治疗的临床疗效观察[J].中国医药导报,2012,9(16):177-178.
[10]陈正和,陈忠平.脑胶质瘤的治疗进展[J].新医学,2015,46(7):419.
[11]Wilson B,Otto K,Gete E.A simple and robust trajectory-based stereotactic radiosurgery treatment[J].Med Phys,2017,44(1):240-248.
[12]Sheng K,Molloy JA,Larner JM,et al.A dosimetric comparison of non-coplanar IMRT versus Helical Tomotherapy for nasal cavity and paranasal sinus Cancer[J].Radiother Oncol,2007,82(2):174-178.
[13]Pezner RD,Liu A,Han C,et al.Dosimetric comparison of helical tomotherapy treatment and step-and-shoot intensity-modulated radiotherapy of retroperitoneal sarcoma[J].Radiother Oncol,2006,81(1):81-87.
[14]Yartsev S,Bauman G.Optimization of brain metastases radiotherapy with TomoHDA[J].Med Dosim,2017,42(1):53-56.
[15]Franzese C,Cozzi L,Franceschini D,et al.Role of Stereotactic Body Radiation Therapy with Volumetric-Modulated Arcs and High-Intensity Photon Beams for the Treatment of Abdomino-Pelvic Lymph-Node Metastases[J].Cancer Invest,2016,34(7):348-354.
