多花黄精实生苗组培快繁技术研究
2018-03-02饶宝蓉谢东奇陈泳和周先治邹荣春陈敏建刘忠辉
饶宝蓉,谢东奇,陈泳和,周先治,邹荣春,陈敏建,刘忠辉
0 引言
多花黄精(Polygonatum cyrtonema)属百合科(Liliaceae)黄精属(Polygonatum)的多年生草本植物。多花黄精具有养阴补气、润肺、益肾、健脾等功效,常用于脾胃虚弱、体倦乏力、口干食少、肺虚燥咳、精血不足、内热消渴[1]。目前,多花黄精的繁殖方式主要是种子繁殖[2-3]和根状茎繁殖[1]。 但这两种方法繁殖速度慢,大大限制了多花黄精的种植面积。因此,多花黄精种苗的问题成为了人工大面积种植的瓶颈。现有的多花黄精栽培基地也迫切需要对多花黄精品种进行提纯复壮,以培育出高产的、抗病脱毒的种苗[4]。由此,对多花黄精组培快繁技术的研究迫在眉睫。
目前有关多花黄精组织培养的研究刚刚起步,成果较少,对规模化生产尚不足以起到指导作用,因此,我们开展了多花黄精实生苗组织培养快速繁殖技术研究,以期初步建立高效、适宜、成熟的多花黄精实生苗快繁培养体系,代替传统的栽培技术来满足市场对多花黄精不断增长的需求,为工厂化、规模化的多花黄精育苗提供技术依据。
1 材料与方法
1.1 试验材料
本试验所用多花黄精种子取自南平市光泽县承天药业多花黄精规范化生产基地,于2015~2017年在南平市华科生物科技有限公司与南平市农业科学研究所中进行试验。
1.2 试验方法
1.2.1 无菌苗的获得
1.2.1.1 种子的预处理试验 从多花黄精规范化生产基地取得的多花黄精种子,分别进行4种预处理,L1:种子种皮处理(用沙子磨去),后变温浸种(将黄精种子浸在1000 mg/kg GA3中,先放置在25℃恒温催芽箱内浸种24 h后,再放置于0~4℃冷藏箱内浸种 24 h);L2:种子种皮不处理,直接变温浸种;L3:种子种皮处理,未浸种,直接从冷库中取出;L4:种子种皮不处理,未浸种,直接从冷库中取出。将处理好的种子无菌播种到培养基中,每瓶10粒,各个处理10瓶,放到25℃培养室中,观察其发芽率。
1.2.1.2 灭菌方式的确定 选择最佳的种子预处理方式对种子进行处理,用流水冲洗干净,在超净工作台上用75%的酒精消毒30 s,然后用无菌水冲洗3次,放在无菌瓶中用2%NaClO灭菌,时间分别为0、7、15 min;用无菌水冲洗3次,再用0.1% 的 HgCl2消毒7、14、21 min后,用无菌水冲洗6次,用滤纸吸干外表水分,放入无菌盘子上,将种子播在无菌诱导培养基表面。每瓶3粒,各个处理接种50瓶,50粒一个重复,重复3次,约10 d后,观察种子的感染情况,并继续观察发芽情况。
1.2.2 培养基的制备与培养条件 均以包含30多种元素的MS为基本培养基,再根据试验目的(诱导、增殖、生根)添加不同浓度的6-BA(6-苄基腺嘌呤)、GA3(赤霉素)、2,4-D[5](2,4-二氯苯氧乙酸)和 NAA[6-7](萘乙酸)等激素,附加蔗糖 25 g/L(生根培养基20 g/L)、卡拉胶7 g/L,最后调节pH 值至5.8(用 1 mol/L NaOH 或 1 mol/L HC1 调节 pH 值)。 罐装于培养瓶后,进行灭菌,灭菌条件为:121℃、131 kPa,灭菌20 min。培养基制备好之后,置于无菌操作室中,放置72 h,并将紫外灯打开将无菌操作室进行灭菌。材料接种后,在光照度1500~2500 lx光照下培养,光照时间 11 h/d,培养室温度保持在(25±1)℃。
1.2.3 黄精种子诱导、芽增殖与生根培养基的激素浓度筛选方法 选择最佳的种子预处理方式对种子进行处理,后选择最佳的消毒灭菌方法,将消毒好的种子放入不同激素组合的诱导培养基中,每瓶6粒,每个处理接种30瓶,60粒为一个重复,重复3次,60 d后统计诱导结果。选取生长健壮、大小一致、没有污染的多花黄精小芽种球切块成0.3~0.5 cm大小,转移到不同激素组合的增殖培养基中,每瓶6个芽,每个处理接种30瓶,60个芽为一个重复,重复3次,30 d后统计增殖情况。选取生长健壮、大小一致、没有污染的多花黄精小芽,转移到不同激素组合的生根培养基中,每瓶6个芽,每个处理接种30瓶,60个芽为一个重复,重复3次,30 d后统计生根情况。
1.2.4 炼苗移栽 将较好的多花黄精生根瓶苗移入大棚温室中培养5 d,打开瓶盖炼苗3 d后,从瓶中取出试管苗,洗去根部培养基,选择带有3条以上根的健康小苗,移栽到基质(泥炭土∶沙子=2∶1)中,每周浇一次营养液,2个月后统计存活率。
2 结果与分析
2.1 不同预处理方式对种子发芽率的影响
经不同方式预处理后,种子发芽时间及发芽率的统计结果见表1。由表1可知,不同预处理方法对种子的发芽有一定的影响,L3、L4明显比L1、L2发芽时间早、发芽率高,长势也明显优于进行变温处理的种子;同是直接从冷库中取出的种子,L3较L4发芽时间早、发芽率高。从叶片长势上看,种皮未经沙磨处理的略好,可能是由于沙磨处理对种皮造成一定损伤,对后期发芽生长产生了一定的影响。综合发芽时间、发芽率及芽生长状况,将黄精种子直接从冷库中取出后磨去种皮(L3处理)是发芽率较高并能缩短发芽时间的种子预处理方式。

表1 不同种子预处理方式对发芽率的影响
2.2 不同的灭菌方式对种子污染率与发芽率的影响
从表2可以看出,两种灭菌剂(NaClO与HgCl2)的使用以及灭菌时间的差异,对种子的污染率及发芽率都有一定的影响。其中,单独使用HgCl2(A1~A3)的效果没有HgCl2与NaClO结合使用(A4~A9)的效果好;当 2%NaClO灭菌时间相同时,随着 0.1%HgCl2灭菌时间增长,污染率呈现越来越低的趋势;当0.1%HgCl2灭菌时间相同时,随着2%NaClO灭菌时间增长,污染率呈现越来越低的趋势;当2%NaClO灭菌时间相同时,随着0.1%HgCl2灭菌时间增长,种子的发芽率却出现先升高后降低的趋势;当0.1%HgCl2灭菌时间相同时,随着2%NaClO灭菌时间增长,种子的发芽率却出现升高的趋势,即种子的发芽率随着0.1%HgCl2灭菌时间的加长而先升高后降低,说明HgCl2灭菌时间过长对种子的发芽有一定的影响,会对种子的胚产生一定的破坏;但随着2%Na-ClO灭菌时间增长,种子的发芽率出现升高的趋势。因此,最适的灭菌方式是A8(2%NaClO 15 min+0.1%HgCl214 min),污染率低且发芽率高。

表2 不同的灭菌方式对种子污染率与发芽率的影响
2.3 不同激素配比的芽分化诱导培养基对黄精不定芽诱导的影响
试验中获得的无菌苗及初生成的球茎接种于芽分化诱导培养基中,培养30 d后,芽分化结果如表3。从表3可知,B1、B2处理的发芽率较低;诱导出的芽长得最好的是B3配方的培养基(MS+6-BA 1 mg/L+GA30.2 mg/L),诱导率达 80%以上;B5配方的培养基虽然芽的数量较多,诱导率较高,球茎较大,但是球茎出现异形。因此,从6种诱导培养基配方中选出较好的 4种配方(B3、B4、B5、B6)对其进行增殖效果的比较。

表3 不同激素配比的芽分化诱导培养基对不定芽诱导的影响
2.4 不同激素配比的增殖培养基对黄精苗长势的影响
如表4 所示,B3配方(MS+6-BA 1 mg/L+GA30.2 mg/L+2,4-D 0 mg/L+ NAA 0 mg/L)的苗长势不错,叶子大且鲜绿,球茎大,增殖率较高,增殖系数3.15(以种球上的芽为单位,即增殖系数=出芽数/原有芽数);B4配方的叶子长势不错,但是无种球,增殖率一般,增殖系数为1.8;B5配方组培苗球茎异常大,叶子少,球茎有点畸形;在B6配方上长得较差,只有零星几片叶子,出芽率低,增殖系数低。
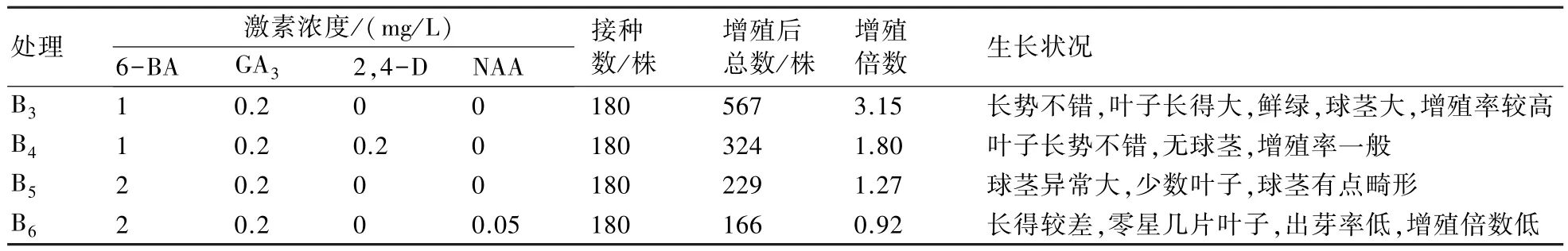
表4 不同激素配比的增殖培养基对黄精苗长势的影响
2.5 不同激素配比的生根培养基对黄精组培苗生根 的影响
从表5可知,6-BA对生根有抑制的作用,当6-BA浓度达0.3 mg/L时明显抑制了根的生长,其后生根率为0,但是其对叶子和球茎的生长有明显的促进作用;而NAA对生根有较好的促进作用,浓度较低时更利于生根,高浓度时也会出现抑制的现象。综合13 种配方的培养效果,H1配方(MS+6-BA 0 mg/L+NAA 0.3 mg/L)较为理想,生根率达 85%,球茎大小中等,叶子长势较好。但在该配方培养过程中仍然有少数叶子发黄,因此后期还要继续深入试验,找到一个叶子既不发黄,又有利于生根的平衡点。
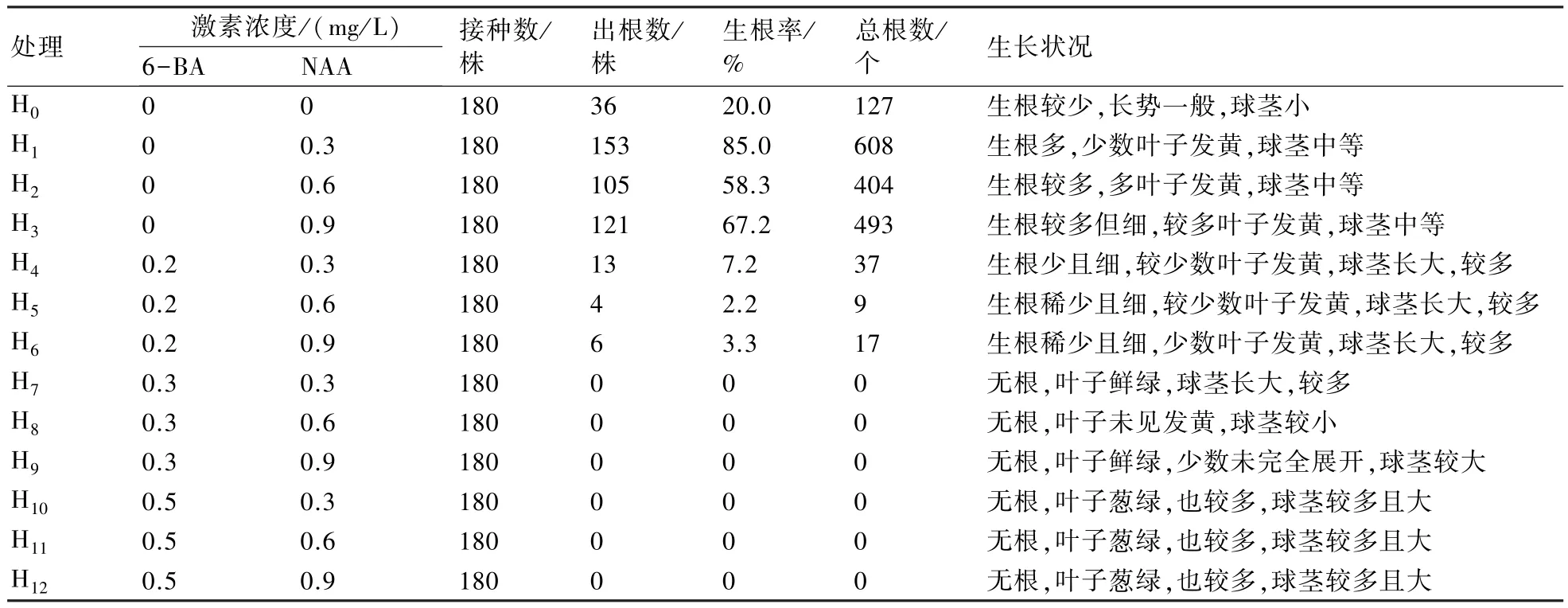
表5 不同激素配比的生根培养基对黄精组培苗生根的影响
2.6 移栽炼苗
移栽200株健康小苗,2个月后统计,存活株为183株,存活率达到90%以上(图1~图2)。

图1 准备移栽的小苗

图2 移栽后的苗
3 讨论与小结
本试验结果表明:种子发芽的最佳预处理方式是将黄精种子直接从冷库中取出,经种皮磨去处理,可提高发芽率,缩短发芽时间;最适的消毒灭菌处理方式是用2%NaClO消毒15 min,再用0.1%HgCl2消毒14 min,污染率较低,发芽率高,效果最好;诱导及增殖的最适宜培养基是一致的,即MS+6-BA 1.0 mg/L+GA30.2 mg/L,其诱导出的芽、叶片长势良好,叶片大且鲜绿,球茎大,增殖率较高,增殖系数达到3以上;理想的生根培养基为MS+NAA 0.3 mg/L,生根率高达85%,叶子长势较好,黄色叶子较少,球茎大小中等。还需进一步研究黄精组培苗的落地和栽培试验,对于黄精组培苗能否应用于生产,将在后续的试验中作进一步探讨。
[1]田启建,赵致.黄精栽培技术研究进展[J].中国现代中药,2007,9(8):32-38.
[2]刘红美,方小波,夏开德,等.多花黄精组织培养快繁技术的研究[J].种子,2010,29(12):13-17.
[3]赵致,庞玉新,袁媛,等.药用作物黄精种子繁殖技术研究[J].种子,2005,24(3):11-13.
[4] 顾正位.黄精栽培技术研究进展[J].齐鲁药事,2012,31(6):358-359.
[5]万学锋,陈菁瑛.多花黄精组培快繁技术初探[J].中国现代中药,2013,15(10):850-852.
[6]周建金,罗晓锋,叶炜,等.多花黄精组培快繁技术研究[J].福建农业科技,2012(9):59-61.
[7]周新华,朱宜春,桂尚上,等.多花黄精组培生根技术研究[J].经济林研究,2015,33(4):102-105.
