DNA甲基化抑制剂5-azaC对花椰菜生长发育的影响
2018-03-02袁建民木万福麻继仙李易蓉苏银玲
袁建民,木万福,麻继仙,杨 龙,李易蓉,但 忠,苏银玲
花椰菜(Brassica oleracea L.var.botrytis L.),又称花菜、菜花、椰菜花,包括通常所说的青花和白花2种。青花即青花菜(Brassica oleracea var.italica),又名西兰花、绿菜花等。花椰菜以花球为食用器官,营养丰富,味道鲜美,是我国重要的蔬菜作物之一,具有一定的防癌、抗癌功效[1],深受消费者的青睐。近年来,栽培面积迅速扩大,就云南而言,年生产面积约3.33万hm2(含复种)。近年来,关于花椰菜在形态学[2]、细胞学[3]、生理生化[4]、分子水平[5]等方面的研究报道较多,并取得了一定的进展。然而,对于表观遗传研究、DNA甲基化水平变化、基因表达调控等方面的研究却比较缺乏。DNA甲基化与表观遗传变化密切相关,在植物的整个发育分化过程中,DNA甲基化对控制基因表达、基因组防御、生长发育都起着重要作用[6]。DNA甲基化抑制剂5-氮杂胞苷(5-azaC)现已广泛用于植物生长发育调控等方面的研究。甲基化水平会影响植物的花期、株高、抗病性、产量等重要农艺性状,同时产生的一些表型变异可作为育种材料[7]。
目前,涉及的甲基化研究主要集中在拟南芥[8]、水稻[9]、小麦[10]等植物上,而关于 DNA 甲基化抑制剂在花椰菜育种上的研究却鲜见报道。本研究以花椰菜(青花和白花)为试材,对DNA甲基化抑制剂5-azaC对花椰菜生长发育的影响进行初步探索,以期通过表观遗传学的方法为花椰菜育种及繁种提供一定的科学依据,为进一步深入研究DNA甲基化提供参考。
1 材料与方法
1.1 试验材料
供试材料为5份不同熟性的花椰菜材料(表1)。其中,青花材料包括13195父本、13195母本及13027母本,白花材料包括C-2母本和152母本,均由云南省农业科学院热区生态农业研究所蔬菜研究中心提供。

表1 供试材料
1.2 试验方法
试验于2014年在云南省楚雄州元谋县热区所蔬菜实验基地进行。试验共设5个处理,DNA甲基化抑制剂 5-azaC 浓度分别为 0、5、10、20、40 mg/L,依次记为对照(CK)、T1、T2、T3、T4。
供试材料于2014年7月20日播种育苗,穴盘采用50孔的黑色塑料盘,当花椰菜幼苗长至5片左右真叶时,选取大小均匀一致的幼苗进行5-azaC叶面喷施处理,叶面喷施至叶片充分淋湿为止,为使溶液充分接触叶片,在溶液中加入1~2滴吐温20,每隔5 d处理1次,共3次。试验采用随机区组设计,每处理重复3次。每个小区定植20株,小区面积约4 m2,株距40 cm,行距50 cm,常规田间栽培管理。
1.3 数据调查与分析
调查不同熟性花椰菜材料的生育期和各时期的主要生物学性状,包括株高、株幅、现蕾天数(从定植到现蕾的天数)、叶长度、叶宽度、叶形指数、茎粗、叶柄长、花球直径、单球质量等。每个小区随机选取5株调查记录并取平均值。
试验所得数据采用Excel 2003软件进行数据的初步处理和制表,采用SAS 9.0国际通用统计分析软件进行数据差异显著性分析,并用Duncan法进行多重比较。
2 结果与分析
2.1 5-azaC处理对花椰菜株高的影响
当花椰菜生长到120 d左右时,对株高进行测量。由表2可知,不同浓度5-azac对不同花椰菜材料株高发育的影响不同。对青花材料而言,处理组对其株高的生长存在显著促进效应,均比对照高。当5-azac浓度为20 mg/L时,13195父本株高达到最高;5-azac浓度为 10 mg/L时,13195母本株高达到最高;而5-azac浓度为 40 mg/L时,13027母本株高达到最高。对白花材料而言,处理组对C-2母本株高的生长促进效应显著高于对照,随着5-azac浓度的升高,促进效应随之降低;而对152母本株高的生长存在一定程度的抑制效应,随着5-azac浓度的升高,抑制效应随之增强。

表2 不同浓度5-azaC处理对花椰菜株高发育的影响 cm
2.2 5-azaC处理对花椰菜株幅的影响
由表3可知,同一材料在不同浓度5-azaC处理之间花椰菜株幅存在显著差异。随着5-azaC浓度的升高,13195父本和152母本的株幅呈下降趋势,表现为抑制效应;而13195母本、13027母本和C-2母本的株幅变化则呈升高趋势,表现为促进效应,表明无论是白花还是青花,不同花椰菜材料对5-azaC处理的敏感程度不同。

表3 不同浓度5-azaC处理对花椰菜株幅发育的影响 cm
2.3 5-azaC处理对花椰菜现蕾时间的影响
现蕾时间的早晚不仅与花椰菜熟性密切相关,而且还受许多外界因素的影响,现蕾时间的早晚直接影响着花椰菜种子的生产。由表4可以看出,与对照相比,青花材料13195母本,提前现蕾时间较短,在10 mg/L 5-azaC条件下最多可以提前 3 d左右;而13027母本在10 mg/L 5-azaC条件下提前现蕾时间最高可以达到8 d左右;其余13195父本、C-2母本、152母本提前现蕾时间最大值分别为7.0、6.4、4.3 d。此外,在5个供试材料中,13195父本和C-2母本在5-azaC浓度为20 mg/L条件下提前现蕾时间达到最大值;而13195母本、13027母本、152母本均在 5-azaC浓度为10 mg/L条件下提前现蕾时间达到最大值。由此可见,现蕾时间的早晚与5-azaC的浓度存在密切相关,提前现蕾的适宜5-azaC浓度为10~20 mg/L。同一材料在不同浓度5-azaC处理下,花椰菜现蕾时间存在显著差异。各处理的现蕾时间均比对照明显提前,现蕾时间提前范围为3~8 d,这表明甲基化抑制剂5-azaC可以在一定程度上促进花椰菜提早现蕾提早开花。

表4 不同浓度5-azaC处理对花椰菜现蕾时间的影响 d
2.4 5-azaC处理对花椰菜花球直径的影响
当花椰菜幼苗生长到120 d左右,可见明显花蕾时对花球直径进行准确测定,结果显示(表5):在同一供试材料中(除了材料C-2母本),不同浓度5-azaC处理之间花椰菜花球直径变化差异显著。随着5-azaC浓度的升高,13195母本的花球直径均明显高于对照组,而13195父本、13027母本和152母本的花球直径与对照组相比,呈先升高后下降趋势。当5-azaC 浓度为 10 mg/L时(T2),所有供试材料的花球直径均达到最大值;当5-azaC浓度达到40 mg/L时(T4),13195父本的花球直径受到的抑制效应最明显。可见,不同花椰菜材料花球直径对5-azaC处理的影响程度不同。

表5 不同浓度5-azaC处理对花椰菜花球直径的影响 cm
2.5 5-azaC处理对花椰菜单球质量的影响
田间观察表明,在整个生育期内,处理组与对照组均能正常生长发育,未发现幼苗枯萎或死亡现象。无论是青花还是白花,其叶形、叶色、花球颜色等农艺性状基本一致。单球质量是影响花椰菜产量的重要指标。结果显示(表6):在同一供试材料中,不同浓度5-azaC处理之间的花椰菜单球质量变化差异显著,而C-2母本各处理之间的差异不显著,表明不同材料对5-azaC处理的敏感程度不同。随着5-azaC浓度的升高,13195父本、13195母本、13027母本、152母本的单球质量与对照相比呈先升高后下降趋势,低浓度(低于10 mg/L)表现为促进效应,高浓度(10~40 mg/L)表现为抑制效应。 5-azaC 浓度为 10 mg/L 时(T2),13195 母本、13027母本和 152 母本单球产量达到最大值;而当5-azaC浓度为40 mg/L时(T4),13195父本和13195母本的单球质量与对照相比抑制效应最明显。
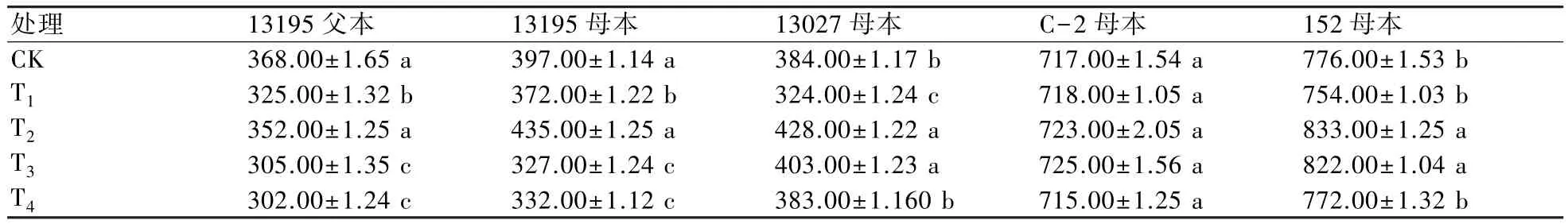
表6 不同浓度5-azaC处理对花椰菜单球质量的影响 g
3 结论与讨论
已有研究指出,DNA甲基化参与植物基因的表达调控,DNA甲基化不足或太高都可以引起植物的表型异常,进而调节植物的生长发育,同时DNA甲基化是植物正常生长发育过程中所必需的。DNA甲基化抑制剂5-azaC处理可以使甲基化水平降低,DNA去甲基化是导致植物异常表型的主要原因。前人在研究 5-azaC 处理拟南芥种子[11]、亚麻种子[12]、甘蓝幼苗[13]、小麦幼苗[10]时,结果显示:植株经 5-azaC处理后DNA甲基化水平降低,可见植株矮化、株成丛状、叶片变小等异常性状,并且可以遗传给后代。在本试验中,花椰菜幼苗经不同浓度的5-azaC处理后没有发现枯萎或死亡现象,但是一定浓度(20~40 mg/L)的5-azaC处理可使花椰菜植株出现植株矮化、叶片变小、提早现蕾、植株丛状等异常性状,其中对青花较为明显,这可能是青花相对白花对5-azaC处理更为敏感,5-azaC处理后引起了DNA甲基化水平降低,从而导致了表型异常,而且这种抑制作用存在一定剂量累计效应。此外,经过一定浓度5-azaC处理后,花椰菜的株高、株幅、现蕾时间、花蕾直径、单球质量明显异于对照,这说明适宜浓度的5-azaC处理可以获得一些理想的表型,这些表型变化假如可以遗传,则可能用于下一步育种。
DNA甲基化与植物春化作用及开花密切相关。Burn等[14]采用5-azaC处理尚未春化的拟南芥植株后,处理组比对照组提前开花,而对春化作用不敏感的晚开花材料对5-azaC处理无明显变化。本试验结果表明:一定浓度的5-azaC处理可以促进花椰菜(包括青花和白花)提早现蕾和开花,提早时间在3~8 d之间;不同浓度不同材料之间花椰菜提前现蕾的天数各有差异,但均比对照组有所提前;不同材料对5-azaC的敏感程度反应不同。这与拟南芥[10]、小麦[15]、萝卜[16]、白菜[17]等植物的研究结果一致,说明DNA甲基化水平的降低可以促进植物提早现蕾开花。Finnegan等[18]研究认为:仅甲基化水平降低就可以使植物开花,这说明在植物生长发育过程中,存在一些与开花相关基因启动子DNA去甲基化,活化基因表达导致DNA甲基化水平降低,进而促进植物开花,但是具体的开花机制尚不清楚。本研究以花椰菜(包括青花和白花)为材料,通过对5叶1心幼苗进行DNA甲基化抑制剂5-azaC处理,达到了提早现蕾和开花等理想效果,这对解决花椰菜杂交育种中亲本花期不遇具有重要作用。目前还只是研究初始阶段,而对于甲基化水平具体下降了多少,DNA甲基化相关基因如何调控等,还需要进一步深入研究。
[1] Keck A S, Finley JW.Cruciferous vegetables: cancer protective mechanisms of glucosinolate hydrolysis products and selenium[J].Integrative Cancer Therapies, 2004, 3(1): 5-12.
[2]朱世杨,张小玲,刘庆,等.花椰菜自交系主要形态性状的主成分分析和聚类分析[J].植物遗传资源学报,2012,13(1):77-82.
[3]袁建民,木万福,杨龙,等.青花菜小孢子发育时期与花器形态的相关性[J].中国农学通报,2016,32(34):123-128.
[4]李光庆,谢祝捷,姚雪琴,等.花椰菜叶绿素荧光参数与耐寒性的关系研究[J].园艺学报,2010,37(12):2001-2006.
[5]楼珏,张小玲,罗天宽,等.利用SSR和SRAP标记分析花椰菜自交系的遗传多样性[J].分子植物育种,2015,13(3):605-614.
[6]屠发志,彭世清.植物表观遗传与DNA甲基化[J].生物技术通讯,2007,18(5):155-158.
[7] Fieldes M A,Schaeffer SM, Krech M J,et al.DNA hypomethylation in 5-azacytidine-induced early-flowering lines of flax[J].Theor Appl Genet, 2005, 111(1): 136-149.
[8] Wang Z C,Ma H X,He Y X.Effects of cadmium on Arabidopsis thaliana DNA methylation[J].Plant Physiology Communications, 2009, 45(2): 115-118.
[9] A kimoto K,Katakami H, Kim H J,et al.Epigenetic inheritance in rice plant[J].Annals of Botany, 2007, 100(2): 205-217.
[10]陈芳,王子成.5-氮杂胞苷对小麦生长发育及DNA甲基化的影响[J].河南大学学报:自然科学报,2011,41(1):61-66.
[11] Finnegan E J, Peacock W J, Dennis E S.Reduced DNA methylation in Arabidopsis thaliana results in abnormal plant development[J].Proc Natl Acad Sci USA, 1996, 93(16):8449-8454.
[12] Fieldes M A,Schaeffer SM,Krech M J,et al.DNA hypomethylation in 5-azaCytidine induced early flowering lines of flax[J].Theor Appl Genet, 2005, 111(1): 136-149.
[13] King G J.Morphological development in Brassica oleraceais modulated by in vivo treatment with 5-azaCytidine[J].Jourm Horticul Sci, 1995, 70(2): 333-342.
[14] Burn J E, Bagnall D J,Metager J D, et al.DNA Methylation, vernalization, and the initiation of flowering[J].PNAS, 1993,90(1): 287-291.
[15] Horvath E,Szalai G, Janda T,et al.Effect of vernalization and 5-azaCytidine on the methylation level of DNA in wheat(Triticum aestivum L.cv.martonvasar 15) [J].Plant Science, 2003, 165(4): 689-692.
[16]汪炳良,李水凤,曾广文,等.5-azaC对萝卜茎尖DNA甲基化和开花的影响[J].核农学报,2005,19(4):265-268.
[17]李梅兰,曾广文,朱祝军.5-氮杂胞苷促进白菜开花的效应分析[J].浙江大学学报,2003,29(3):287-290.
[18] Finnegan E J, Genger R K.DNA methylation and the promotion of flowering by vernalization[J].Plant Biology, 1998,95(10): 5824-5829.
