体外受精与体外培养对小鼠囊胚发育潜能的影响
2018-03-01郭翔宇陈书强李博
郭翔宇,陈书强,李博
(空军医大学唐都医院生殖医学中心,西安 710038)
临床上,为了提高辅助生殖的成功率及避免多胎妊娠,很多时候会选择单囊胚进行胚胎移植[1-3]。目前已经有研究表明单囊胚移植在不降低妊娠率的同时能够显著降低多胎妊娠率[4]。因此,临床上一直在努力建立筛选健康胚胎的新方法。另外,无论在临床上还是在动物模型上所观察到的辅助生殖技术(ART)对植入后胎盘、胎儿以及出生后个体的影响,都是ART对早期胚胎影响的延续。因此,评估体外受精对囊胚期胚胎的影响,是非常必要的。
资料和方法
一、动物来源
小鼠品系为ICR清洁级小鼠,购买自北京维通利华实验动物技术有限公司。雌鼠4~6周龄,雄鼠3~6月龄。
二、主要仪器和试剂
孕马血清促性腺释放激素(PMSG)、HCG(Prospec Protein Specialists,以色列)、KSOM(Millipore,美国)、戊巴比妥钠(Sigma,德国)、多聚甲醛(Sigma,德国)、RNeasy Plus Micro Kit(Qiagen,德国)、Quanti TectReverse Transcription Kit(Qiagen,德国)、SYBR(Sigma,德国)。
实体解剖镜(Motic,中国),电子天平AA-160(Denver Instrument Company,美国),CO2培养箱(Thermo,美国)、培养皿(35 mm)/四孔板(Nunc,丹麦)、超净台(Labconco,美国)、荧光显微镜(Leica,德国)。
三、研究方法
1.获取囊胚:以下胚胎操作实验方法均来自《Manipulating the Mouse Embryo-A Laboratory Manual,3rdedition》[5]。
(1)获取自然交配形成的囊胚(in vivo组):取24 g左右的雌性小鼠,腹腔注射7.5 U PMSG,46~48 h后腹腔注射7.5 U HCG;与雄鼠合笼,次日检查阴栓。在见栓后72 h,将雌鼠处死,剪取双侧子宫和部分输卵管,将吸有mHTF培养液(自制)的针头插入子宫角,将囊胚冲出,收集囊胚,在mHTF培养液中洗涤,待用。
(2)体内受精-体外培养获取的囊胚(IVC组):超排卵及交配处理同前。次日检查阴栓,在注射HCG 20 h 后,处死雌鼠,取MⅡ卵获取受精卵团,用0.3%透明质酸酶消化卵团,然后用吸管将消化分离的卵母细胞转入4~5 滴100 μl的mHTF培养液,以洗去透明质酸酶和颗粒细胞,待继续培养至囊胚。
(3)体外受精获取囊胚(IVF组):①获取MII卵:雌鼠促排卵处理同前。注射HCG 14~16 h 后断颈处死小鼠,剪取输卵管,置于平皿中,在100 μl 的mHTF培养液中清洗1次,转入另一100 μl的mHTF培养液滴,用尖头镊子撕开输卵管呈半透明状的膨大部位,轻压撕开处,令卵母细胞和颗粒细胞的复合体流出,用镊子将流出的复合体转入4~5 滴100 μl的mHTF培养液中洗涤,待用。②精子的准备与获能:取5日内未交配过的3~6月龄雄性小鼠,断颈处死后剪取双侧附睾尾,置入300 μl 37℃、5%CO2条件下预平衡4 h以上的HTF培养液中,剪开数段,37℃、5%CO2条件下培养20 min使精子自行游出后取出附睾尾,继续培养1.5 h使精子获能。③卵母细胞的准备与体外受精:MII卵丘团置于500 μl 预平衡过的HTF培养液中,加入30 μl获能精子上层悬液,37℃、5%CO2条件下继续培养4 h以使卵母细胞受精。④体外培养:将含有两个原核的受精卵以每20 μl 10个受精卵的密度培养于石蜡油覆盖的KSOM溶液中。分别在24、48、84 h后检查胚胎发育至2-cell、4-cell和囊胚的比率。
2.胚胎移植:取6周龄以上雌鼠,与结扎雄鼠合笼过夜,次日晨检查阴栓,见阴栓当日记作假孕0.5 d(D 0.5),作为假孕鼠备用。取3.5 d(D 3.5)假孕鼠,按0.01 ml/g体重进行腹腔注射1%(w/v)浓度的戊巴比妥钠麻醉剂,待小鼠麻醉后,背侧正中开一小口,钝性分离皮肤和皮下组织层,于子宫角对应肌肉层开一小口,拉出脂肪垫固定,用1 ml注射针头于子宫角无血管处顺子宫方向扎一小口后,同位置插入口吸管,将囊胚(每侧8 枚)轻吹入子宫腔,取出口吸管后还纳子宫卵巢,缝合伤口。
3.囊胚的细胞计数:免疫杀伤法计算总细胞数及内细胞团细胞和总细胞数的比值。
选取不同组别形态相似的扩张期囊胚(Grade II),用酸性台氏液将囊胚透明带去除,之后用含0.1% PVA的PBS(PBSA)缓冲液清洗3遍;将囊胚转移到含10 mmol/L TNBS(Baomanbio,中国)的PBSA中,冰上放置10 min;之后,将囊胚转移到含30%的anti-DNP-BSA(Thermo,美国)的PBSA中,37℃放置30 min;将囊胚转移至含20%的豚鼠补体(Sigma,美国)及10 μg/ml PI(Sigma,美国)的PBSA中,37℃放置20 min;用4%多聚甲醛固定胚胎,同时加入10 μg/ml的Hoechst 33258(MCE,美国)进行染色,4℃放置2 h;囊胚转移到载玻片上进行封片,然后在荧光显微镜下观察。
分别在380 nm和460 nm(或535 nm)激发波长下观察拍照,前者观察到的为总细胞,后者为TE(滋养层)细胞,分别计数进行统计,细胞总数减去TE细胞数即为内细胞团(ICM)细胞数,由此可计算出内细胞团细胞和总细胞数比值。
4.胚胎植入和活产的判定:胚胎移植后第11天,即孕14.5 d,断颈处死代孕母鼠后剪取双侧子宫,浸泡在4℃预冷的PBS缓冲液中,用解剖镊钝性剥离胎儿胎盘,去除羊膜及其他胚外组织,以PBS缓冲液清洗。
活产包括形态学正常的胚胎;植入包括:①活产;②肉眼可见的已经机化的黑色植入点。
5.囊胚qRT-PCR:(1)囊胚mRNA抽提:每200个囊胚为一组,以PBS清洗3遍后置于RNAse-free的EP管中,尽量吸走多余的PBS,采用RNeasy© Plus Micro Kit(Qiagen,德国)抽提总RNA,具体步骤参见产品说明。(2)cDNA合成:以囊胚总RNA为材料,采用QuantiTect© Reverse Transcription Kit(Qiagen,德国)合成总cDNA,具体步骤参见产品说明。(3)囊胚期细胞命运决定因子检测:采用Bio-Rad CFX96 Real-Time PCR检测系统配套软件进行反应模块排版,基于SYBR© Green进行实时荧光检测,以H2afz为内参基因进行相对定量,检测囊胚期细胞命运决定因子的表达。引物序列查询自Primerbank,详见表1。(4)实时定量PCR:采用Sigma公司SYBR© Green JumpStartTMTaqReadyMixTMq-PCR反应液。反应总体系25 μl:SYBR 12.5 μl、Primer pair 1 μl、cDNA 1.5 μl、ddH2O 10 μl。扩增条件:95℃ 3 min;95℃ 15 s、56℃ 30 s、72℃ 30 s,50个循环;72℃ 2 min,65℃~95℃(每15 s升高0.5℃)。以上在每个PCR循环的延伸期采集荧光信号,PCR反应完成后利用温度梯度变性获得熔解曲线供PCR产物定性分析。

表1 目的基因引物序列
四、统计学分析
使用SPSS19.0对实验数据进行统计学分析。计量资料采用单因素-ANOVA进行分析,胚胎植入率等计数型对比资料采用χ2进行分析,P<0.05为差异有统计学意义。
结 果
一、体外受精对囊胚细胞总数、TE和ICM细胞数目的影响
囊胚期细胞总数以及TE/ICM比值和胚胎质量相关[6]。因此我们对in vivo、IVC和IVF三组不同来源的囊胚进行了细胞差别染色,以便识别TE和ICM细胞(图1)。
为了避免胚胎级别对实验结果的影响,我们所有的实验均选择二级囊胚即扩张期囊胚进行实验。发现:in vivo组(n=23)、IVC组(n=24)、IVF组(n=26)囊胚细胞总数分别为(75.05±6.76)、(58.21±3.66)、(58.96±3.75),TE细胞总数分别为(54.5±5.59)、(40.95±4.29)、(42.88±3.67),ICM细胞总数分别为(28.29±5.11)、(17.35±2.96)、(16.04±2.72);与in vivo组相比,IVF组和IVC组囊胚细胞总数、TE细胞数、ICM细胞数均显著降低(P<0.01)(图1)。in vivo组、IVC组、IVF组TE/ICM比值分别为(0.38±0.08)、(0.43±0.11)、(0.38±0.09),三组之间无显著差异(P>0.05)。
二、体外受精对囊胚期细胞命运决定因子表达的影响
我们进一步对in vivo、IVC和IVF三组不同来源的囊胚进行了细胞谱系决定重要因子表达的相对定量,结果显示:IVC和IVF来源的囊胚多潜能因子Nanog、Sox2表达水平显著上调(P<0.05),但是维持滋养外胚层(trophectoderm,TE)存活、调控原始外胚层(Primitive endoderm,PE)分化的、由上胚层(Epiblast)分泌的因子Fgf4的表达水平却显著下调(P<0.05);IVF和IVC导致PE分化的转录调控因子Gata4、Sox17的表达水平显著下调(P<0.05);IVF和IVC导致TE分化的转录调控因子Eomes和Elf5的表达量显著下调(P<0.05);IVF和IVC还导致调控重要信号通路的内分泌因子Lif的表达水平显著下调(P<0.05)(图2)。
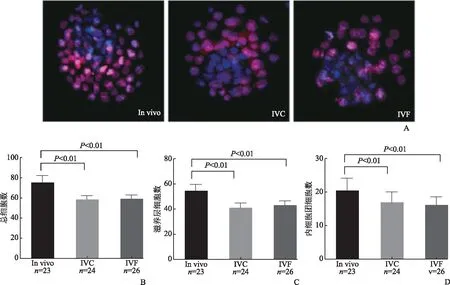
A:囊胚的细胞差别染色(蓝色代表ICM,红色代表TE);B:三组总细胞数比较;C:三组TE细胞数比较;D:三组ICM细胞数比较。与in vivo组相比,IVC和IVF组的总细胞数、ICM、TE细胞数均显著减少(P<0.01),IVC组与IVF组相比无显著差异(P>0.05)图1 体外受精对囊胚细胞总数、TE和ICM细胞数量的影响
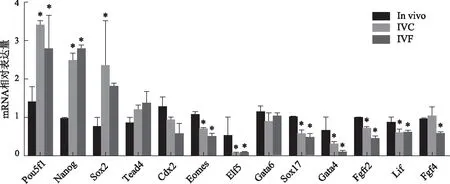
与In vivo组相比,*P<0.05图2 体外受精对囊胚期细胞命运决定因子表达的影响
三、体外受精对胚胎植入率及成活率的影响
胚胎植入率以及植入后成活率是评估胚胎质量的关键指标[6]。我们选择in vivo、IVC、IVF来源的扩张期囊胚,进行了胚胎移植实验,在孕14.5 d时比较胚胎植入率以及植入后胚胎成活率。结果显示:in vivo组 (n=96)、IVC组(n=95)和IVF组(n=93)的胚胎植入率分别为(74.00±4.34)%、(73.67±2.08)%和(71.96±5.17)%,这表明体外受精和体外培养均不影响胚胎的植入率(P>0.05)。但我们进一步发现,体外受精来源的胚胎植入后胚胎的成活率显著低于in vivo组和IVC组(P<0.05),表明体外受精会影响胚胎植入之后的进一步发育,导致胚胎成活率降低(表2)。

表2 比较三组囊胚植入率、成活率、活产率与流产率 (-±s)
注:与In vivo组和IVC组相比,*P<0.05
讨 论
近年来,ART囊胚移植率逐渐升高,其优势在于囊胚移植能够与子宫内膜发育程度相符,减少了促排卵过程中大量使用激素对子宫内膜的影响,使胚胎更易于着床;同时,整个囊胚培养过程是对胚胎的一个筛选过程,能够淘汰大部分非整倍体以及具有遗传缺陷的胚胎[7]。无论是在临床上还是动物模型上观察到的辅助生殖技术对植入后胎盘、胎儿、及出生后个体的影响,都是辅助生殖技术对早期胚胎操作影响的延续。因此,为了更好地改善ART的临床结局,对体外受精过程中囊胚发生的改变进行评估是非常必要的。
囊胚由ICM和TE组成,TE细胞主要功能是胚胎与外界进行物质交换,以支持ICM的发育分化。ICM/TE以及总细胞数常用于评估囊胚质量[8]。临床上用于移植的胚胎均为优质囊胚,因此我们为了更贴近临床实际,选取了扩张期二级囊胚作为研究对象。尽管不同组别胚胎发育速度会有所差异,会导致同一时期的胚胎细胞数有所不同,但是同一级别的囊胚形态相同,三组之间囊胚细胞数是有可比性的。我们发现,即使是同样形态的扩张期囊胚,体外受精来源的囊胚以及体内受精-体外发育的囊胚相对于体内发育的囊胚在细胞总数、TE细胞数以及ICM细胞数方面均显著减少。有研究表明,体外培养会影响植入前胚胎发育率,具体表现为ICM细胞数以及ICM/TE比值的降低[9],而暴露在不良环境中也会使ICM细胞数和ICM/TE比值显著下降[10]。这与本研究结果基本相符。虽然本实验中ICM/TE比值无显著差异,原因可能是ICM与TE细胞数量均减少,导致比值无显著改变;但是考虑到三组同级别的囊胚比较,IVF组细胞总数、TE细胞数,ICM细胞数均显著减少,综合评估体外受精的胚胎质量低于体内发育的囊胚。
有研究表明,囊胚的形态和发育率与胚胎整倍性相关[17],所有整倍体胚胎植入率相似,与囊胚的形态和发育率无关。我们检测了体外受精对胚胎植入率及植入后胚胎存活率的影响,发现体外培养组和体内自然发育组相比虽然植入率等有所降低,但是并无统计学差异;而体外受精虽不影响胚胎的植入率,但植入后胚胎的存活率显著降低。提示与体外培养相比,体外受精这一操作更容易影响胚胎质量,是导致胚胎质量下降、不良妊娠结局的主要原因。
目前有报道表明,H19的ICR区域甲基化水平的降低和临床上自发性流产相关,并且在动物模型上也得到了验证[18-21]。我们观察到体外受精的小鼠胚胎植入后存活率的降低可能和体外受精导致的印记基因ICR区域印记丢失相关。进一步澄清体外受精导致小鼠胚胎植入后存活率降低的原因,将有助于确定表观遗传紊乱与胚胎质量的关系,为临床上完善辅助生殖技术提供理论依据。
本研究发现,IVF会导致小鼠囊胚胚胎质量和移植后成活率下降,初步揭示了囊胚质量的相关分子水平的改变。后期还需实验继续研究IVF胚胎的表观遗传学是否发生改变,以及导致囊胚质量下降的分子机制,才能进一步为临床上改善ART结局和预防ART婴儿出生后远期安全性问题提供理论依据。
[1] Stillman RJ,Richter KS,Banks NK,et al.Elective single embryo transfer:a 6-year progressive implementation of 784 single blastocyst transfers and the influence of payment method on patient choice[J].Fertil Steril,2009,92:1895-1906.
[2] Adashi EY,Gleicher N.Is a blanket elective single embryo transfer policy defensible?[J].Rambam Maimonides Med J,2017,8.
[3] Wang X,Du M,Guan Y,et al.Comparative neonatal outcomes in singleton births from blastocyst transfers or cleavage-stage embryo transfers:a systematic review and meta-analysis[J].Reprod Biol Endocrinol,2017,15:36.
[4] 薛侠,施文浩,师娟子,等.D5选择性的单囊胚移植和双囊胚胎移植妊娠结局比较[J].生殖医学杂志,2014,23:276-279.
[5] Richard B,Marina G,Kristina VN,et al.Manipulating the mouse embryo[M].New York:Cold Spring Harbor Laboratory Press,2014:1-795.
[6] Lane M,Gardner DK.Nonessential amino acids and glutamine decrease the time of the first three cleavage divisions and increase compaction of mouse zygotes in vitro[J].J Assist Reprod Genet,1997,14:398-403.
[7] Cardellicchio L,Reschini M,Paffoni A,et al.Frozen-thawed blastocyst transfer in natural cycle:feasibility in everyday clinical practice[J].Arch Gynecol Obstet,2017,295:1509-1514.
[8] Qu P,Qing S,Liu R,et al.Effects of embryo-derived exosomes on the development of bovine cloned embryos[J/OL].PLoS One,2017,12:e174535.
[9] 王保垒,赵禹,刘军,等.共培养对小鼠囊胚质量及其表观遗传修饰的影响[J].生物工程学报,2009,25:733-738.
[10] Maluf M,Perin PM,Foltran Januário DA,et al.In vitro fertilization,embryo development,and cell lineage segregation after pre-and/or postnatal exposure of female mice to ambient fine particulate matter[J].Fertil Steril,2009,92:1725-1735.
[11] Whitmill A,Liu Y,Timani KA,et al.Tip110 deletion impaired embryonic and stem cell development involving downregulation of stem cell factors Nanog,Oct4,and Sox2[J].Stem Cells,2017,35:1674-1686.
[12] Guo G,Huss M,Tong GQ,et al.Resolution of cell fate decisions revealed by single-cell gene expression analysis from zygote to blastocyst[J].Dev Cell,2010,18:675-685.
[13] Soma M,Iha M,Kihara Y,et al.Preferential emergence of cell types expressing markers for primitive endoderm lineages in mouse embryonic stem cells expressing exogenous EGAM1 homeoprotein[J].J Biosci Bioeng,2012,114:342-346.
[14] HosseinNia P,Hajian M,Tahmoorespur M,et al.Expression profile of developmentally important genes in pre and peri-implantation goat embryos produced in vitro[J].Int J Fertil Steril,2016,10:310-319.
[15] Veraguas D,Gallegos PF,Velasquez AE,et al.FSH stimulation of anestrous cats improves oocyte quality and development of parthenogenetic embryos[J].Theriogenology,2017,87:25-35.
[16] Rodríguez-Alvarez L,Cox J,Tovar H,et al.Changes in the expression of pluripotency-associated genes during preimplantation and peri-implantation stages in bovine cloned and in vitro produced embryos[J].Zygote,2010,18:269-279.
[17] Majumdar G,Majumdar A,Verma IC,et al.Relationship between morphology,euploidy and implantation potential of cleavage and blastocyst stage embryos[J].J Hum Reprod Sci,2017,10:49-57.
[18] Pathak S,Kedia-Mokashi N,Saxena M,et al.Effect of tamoxifen treatment on global and insulin-like growth factor 2-H19 locus-specific DNA methylation in rat spermatozoa and its association with embryo loss[J].Fertil Steril,2009,91:2253-2263.
[19] Ankolkar M,Patil A,Warke H,et al.Methylation analysis of idiopathic recurrent spontaneous miscarriage cases reveals aberrant imprinting at H19 ICR in normozoospermic individuals[J].Fertil Steril,2012,98:1186-1192.
[20] Liu Y,Tang Y,Ye D,et al.Impact of abnormal DNA methylation of imprinted loci on human spontaneous abortion[J].Reprod Sci,2017,1:1933719117704906.
[21] Carrell DT.Aberrant methylation of the H19 imprinting control region may increase the risk of spontaneous abortion[J].Epigenomics,2013,5:23-24.
