人卵丘颗粒细胞和壁层颗粒细胞体外培养方法比较*
2018-03-01文艳飞韩婵林蔡柳洪
何 文, 吕 杰, 李 涛, 文艳飞, 韩婵林, 蔡柳洪△
(1中山大学附属第三医院生殖中心, 广东 广州 510630; 2江门市中心医院,中山大学附属江门医院生殖中心, 广东 江门 529030)
卵巢颗粒细胞是组成卵泡最大的细胞群,是女性生殖过程中发挥重要作用的一类细胞。颗粒细胞与卵母细胞之间存在广泛的信息交流,二者形成功能上的统一体。研究表明,颗粒细胞的质量下降或凋亡增多会影响激素和细胞因子的分泌,甚至影响卵母细胞的发育以及后续的胚胎质量[1-2]。当卵泡窦腔形成后,颗粒细胞分化可为卵丘颗粒细胞(cumulus cells,CCs)和壁层颗粒细胞(mural granulosa cells,MGCs),这2种颗粒细胞在卵泡生长过程中发挥着不同的作用[3-4]。MGCs是承担卵巢分泌激素和细胞因子的主要功能细胞,主要通过旁分泌和自分泌的形式调节卵母细胞发育过程[5];CCs附着于卵母细胞,与卵母细胞形成一个结构功能紧密的合胞体,通过复杂的细胞间链接机制参与影响卵泡发育[6]。
人卵巢颗粒细胞体外培养模型的建立,不仅可运用于女性生殖内分泌和辅助生殖技术的研究,而且可应用于女性生殖系统恶性肿瘤的生理及药物毒性等的研究。由于MGCs的原代培养样本较易获取,因此关于人MGCs体外建系的文献报道较多,但由于提取CCs需要的样本来源较难获得和所需样本量大等因素限制,因此关于人CCs体外建系的研究甚少。本实验依托中山大学附属第三医院生殖中心充足的临床样本,选取进行卵胞浆内单精子显微注射(intracytoplasmic sperm injection, ICSI)技术治疗的患者,用机械切割所得卵丘颗粒细胞复合物培养人CCs,并与人MGCs体外培养进行对比,比较2种颗粒细胞建系的操作特点及细胞体外培养的生物学特性,旨在建立人CCs体外培养体系,作为人颗粒细胞亚群的补充。
材 料 和 方 法
1材料
人淋巴细胞分离液(Ficoll-Paque PLUS)、DMEM/F12培养基、胎牛血清(fetal bovine serum,FBS)、青/链霉素、L-谷氨肽胺(GlutaMAXTM-I)、非必需氨基酸(nonessential amino acids,NEAA)、0.25% 胰酶和PBS缓冲液均购于Invitrogen;抗人卵泡刺激素受体(follicle stimulating hormone receptor,FSHR)抗体购于R&D Systems;MOPS缓冲液购于Vitrolife;驴抗小鼠荧光II抗购于Abcam;Triton X-100、Tris-HCl和Tween-20购于Amresco;4%多聚甲醛和正常山羊血清封闭液购于BOSTER;Hoechst 33342购于碧云天;CCK-8试剂盒购于Dojindo;雌激素检测ELISA试剂盒购于Elabscience。
收集2016年11月~2017年4月于中山大学附属第三医院生殖中心行ICSI治疗的患者样本共30例。所有患者均年龄介于25~35岁,基础性激素水平在正常范围内,月经第3天窦卵泡数在7~20个之间,均采用经典黄体期长方案超排卵,获卵数≥20个。实验过程所涉及卵泡液和卵丘颗粒细胞复合物均为患者治疗过程中的医疗废物,所有样本均获得患者的知情同意,项目的实施获得中山大学附属第三医院生殖医学伦理委员会批准。
2方法
2.1人卵丘颗粒细胞的分离、提纯及培养 对ICSI超排卵患者收集取卵后, 常规进行卵母细胞-卵丘颗粒细胞复合物机械切割处理, 所得的卵丘颗粒细胞复合物(要求每次收集ICSI样本获卵数≥20个)用颗粒细胞培养基(含10% FBS的DMEM/F12培养基)于培养皿中洗涤2次, 以去除捡卵过程中的MOPS液和冲洗液中的矿物油,然后用1.5 mL颗粒细胞培养基接种于12孔板中,置于37 ℃、5% CO2培养箱中培养,24 h后全量换液1次,之后每48 h全量换液1 次,光学显微镜观察颗粒细胞形态。
2.2人壁层颗粒细胞的分离、提纯及培养 收集ICSI超排卵患者取卵术采集的卵泡液(不含卵母细胞及卵丘颗粒细胞复合物),采用密度梯度离心法分离[7],具体操作为:300×g离心10 min,弃上清,用2 mL PBS液重悬,加入2 mL胰酶, 37 ℃消化10 min后加入1 mL颗粒细胞培养基终止消化;后300×g离心30 min,弃上清,加入2 mL PBS液重悬,小心加入2 mL Ficoll液面上,400×g离心20 min。离心后颗粒细胞位于上层混合液和下层Ficoll液交界液面处,用移液管轻柔吸取,加入3 mL PBS液,300×g离心3 min后弃上清,用颗粒细胞培养液重悬沉淀,接种6孔板, 置于37 ℃、5% CO2培养箱中培养, 24 h后全量换液1次,之后每48 h全量换液1 次,光学显微镜观察颗粒细胞形态。
2.3细胞鉴定 分别取培养至第3代的2种颗粒细胞,接种于12孔板中,培养至融合度60%时用PBS清洗2次,4%多聚甲醛4 ℃固定20 min,PBS冲洗3次,每次5 min,用含0.1% Triton X-100的BSA液破膜并封闭1 h,PBS冲洗3次,每次5 min,用细胞免疫荧光法检测FSHR抗体表达情况,细胞质出现红染为阳性;Hoechst 33342检测细胞核,胞核表现为蓝染。
2.4细胞生长曲线的检测 取2种颗粒细胞培养至融合度70%~80%时传代,吸去培养液,PBS清洗1遍,胰酶消化,计数细胞浓度为1×109/L,接种于6孔板,置于37 ℃、5% CO2培养箱中培养, 每48 h全量换液1次。取第3代的2种颗粒细胞,以5×106/L密度接种于96孔板中,置于37 ℃、5% CO2培养箱中培养,24 h后全量换液1次,之后每48 h全量换液1次。于培养第1、3、5、7、9和11天时点每孔添加10 μL CCK-8试剂,继续培养箱内培养3 h后使用酶标仪测量各孔在450 mm波长处的吸光度(A)。
2.5雌激素检测 取第3代的2种颗粒细胞,以1×109/L的密度接种于6孔板中,24 h后全量换液1次,每48 h全量换液1次,收集培养第1、3、5、7、9和11天的细胞培养液,-80 ℃储存,用ELISA方法检测培养基中雌激素含量。
3统计学处理
采用SPSS 20.0 统计软件进行分析。每组实验至少重复3次,结果以均数±标准差(mean±SD)表示,独立样本均数比较采用t检验,重复测量数据的组间比较采用重复测量方差分析,以P<0.05为差异有统计学意义。
结 果
12种颗粒细胞体外培养的形态学观察
人CCs原代提取于捡卵时进行卵母细胞ICSI前处理,用细针切割卵母细胞周围卵丘颗粒细胞复合体而得,几乎没有红细胞残留,24 h后培养基中复合体内颗粒细胞大部分贴壁生长,培养24 h后换液将剩余漂浮复合体团块洗去,显微镜下观察到颗粒细胞生长分散,细胞伸展充分,见图1A;人MGCs原代提取培养24 h后大部分贴壁生长,但仍有较多数量红细胞混杂,见图1B,红细胞并未对颗粒细胞贴壁产生明显影响,培养24 h后全量换液可去除大部分残留红细胞。
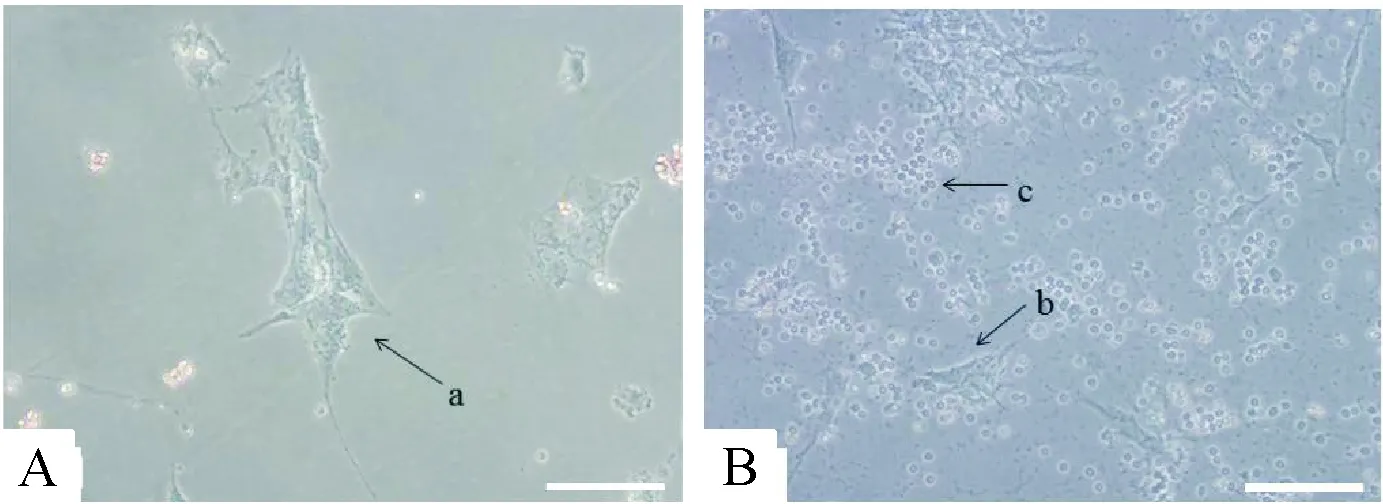
Figure 1. The representative images ofinvitrocultured human cumulus cells and human mural granulosa cells (×200). A: human cumulus cells after 24 h of incubation; B: human mural granulosa cells after 24 h of incubation. a: human cumulus cells; b: human mural granulosa cells; c: remaining erythrocytes. The scale bar=50 μm.
图1体外培养的人卵丘颗粒细胞和人壁层颗粒细胞
2种颗粒细胞贴壁后外观相似,均呈梭形或多突状,胞核大、圆,核仁明显,细胞质颗粒丰富、均匀,细胞间伪足连接紧密。体外培养这2种细胞在第3~7天分裂能力达到峰值,第7~9天进入生长平台期,随后出现退化现象,悬浮细胞增多,细胞出现类成纤维细胞形态改变。
2免疫荧光鉴定颗粒细胞
对2种颗粒细胞进性免疫荧光方法检测FSHR表达,结果显示, 胞质呈红色,说明FSHR表达阳性,阳性率达90%以上,表明2种来源所得细胞均为颗粒细胞,见图2。
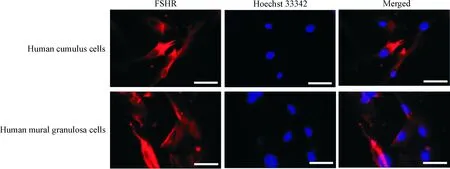
Figure 2. Immunofluorescence staining of human cumulus cells and human mural granulosa cells (×400). The scale bar=20 μm.
图2人卵丘颗粒细胞和人壁层颗粒细胞的免疫荧光观察
3细胞生长曲线比较
CCK-8法检测发现,培养第1天,2种颗粒细胞贴壁数量相当;培养第3、5及7天,人CCs数量均较人MGCs多;第9及11天结果显示, CCs开始出现细胞凋亡而MGCs进入生长平台期。统计结果显示2种颗粒细胞的生长曲线差异无统计学意义(P>0.05),见图3。
4雌激素分泌能力比较
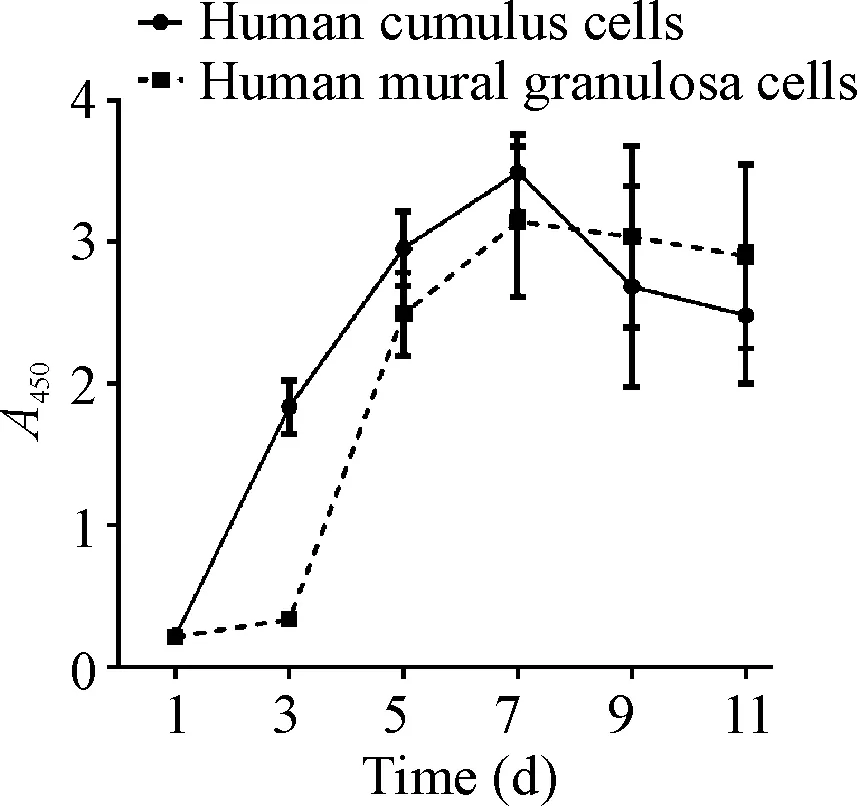
Figure 3. The growth curves of human cumulus cells and human mural granulosa cells. Mean±SD.n=10.
图3人卵丘颗粒细胞和人壁层颗粒细胞生长曲线
ELISA方法检测发现, MGCs分泌雌激素稍多于CCs[(3.17±0.33) nmol/Lvs(2.95±0.14) nmol/L],但统计结果显示2种颗粒细胞分泌雌激素量的差异无统计学意义(P>0.05), 见图4。
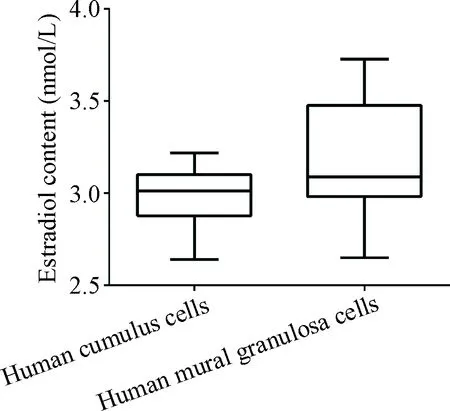
Figure 4. Estrogen contents in the culture media of human cumulus cells and human mural granulosa cells. Mean±SD.n=10.
图4人卵丘颗粒细胞和人壁层颗粒细胞培养液雌激素含量
讨 论
卵巢颗粒细胞是卵母细胞生长发育内环境的重要组成部分,其体外培养模型的建立对研究多能干细胞分化具有重要意义,如在生殖系细胞发生的热点研究中,将干细胞与MGCs共培养,发现MGCs能促进干细胞向雌性生殖细胞进一步分化[8-10]。此外,MGCs的体外模型有助于研究其与卵母细胞的互相调节机制,并且可以为卵母细胞与颗粒细胞共培养及多能干细胞与颗粒细胞共培养的研究提供不同的颗粒细胞亚类来源[11-13]。不过,上述研究的开展大部分取用壁层颗粒细胞作为研究对象,CCs作为颗粒细胞亚群之一,与卵母细胞处于同一微环境中,其所起到的作用与MGCs不同[14],因此需要建立CCs培养体系,为研究卵母细胞发生和干细胞共培养等研究提供不同的颗粒细胞亚群。
细胞建系的关键在于原代颗粒细胞的分离和提纯方法,本实验采用直接培养法对CCs进行原代提取,比传统密度梯度离心法分离MGCs更为简单方便[15]。直接法无需消化及离心操作,有研究指出[16],CCs生长发育受卵母细胞分泌因子的调控,脱离了卵母细胞的单独CCs不适宜长期体外培养,不过该项研究基于山羊模型,因此所得结论可能不适用于人CCs的体外培养。此外,有国内学者认为[17],卵丘颗粒细胞复合物中的黏液团会影响颗粒细胞的提纯及生长活性。与卵母细胞体外受精操作中对卵母细胞-卵丘颗粒细胞复合物的处理比较而言,ICSI操作机械切割卵丘颗粒细胞复合物的体积更大,剥除的颗粒细胞更多,本实验选取ICSI促排获卵超过20个的患者作为原代提取样本,所收集的卵丘颗粒细胞复合物量较多。本研究结果显示,虽然黏液团未经消化,但CCs在培养24 h后可从黏液团中爬向皿底并贴壁,后续生长的颗粒细胞形态结构与MGCs相似,未见明显异常。CCs样本收集前经过MOPS液冲洗2次,基本不含血细胞影响,培养24 h后可除去绝大部分黏液团块,此法可保证细胞纯度的同时,操作简单。本实验原代样本取自ICSI促排获卵超过20个的患者,若种皿时选取6孔板及更大面积培养皿,CCs 24 h后贴壁密度低,会导致后续的生长受到影响。本实验提示, 如果12孔板中每孔原代样本量少20个卵丘颗粒细胞复合物,会因为贴壁的颗粒细胞密度过低,导致接下来的生长受到影响。但由于没有对黏液团块进行消化处理,无法提供定量种皿的细胞数,是本实验的不足之处。
本实验研究显示,CCs的体外培养生长特点和雌激素分泌功能和MGCs相似。目前,有关人颗粒细胞体外培养所用培养基的选择文献报道不一[18-20],本实验综合当前研究报道,选择含体积分数为10% FBS的DMEM/F12培养基作为MGCs及CCs培养基,且未在培养基中添加卵泡液。CCK-8实验结果显示,CCs体外生长情况良好,伸展性佳,具有和MGCs相当的生长能力,因此提示本实验选用的培养基适用于CCs的体外培养;FSHR抗体免疫荧光结果表明,从卵丘颗粒细胞复合物中分离所得细胞为颗粒细胞[21];ELISA检测雌激素结果提示,分离所得CCs分泌雌激素能力和MGCs相似,提示我们CCs在体外培养后同样具有雌激素分泌功能。
综上所述,本实验建立了一种有效的分离、提取和培养人CCs的方法,且操作简便,并通过与经典的人MGCs体外培养方法比较,结果显示, 人CCs具有良好的体外生长能力以及雌激素分泌功能,为有关颗粒细胞的体外实验、卵母细胞-颗粒细胞共培养和诱导干细胞-颗粒细胞共培养等研究提供了不同的颗粒细胞亚群。
[1] Bao B, Garverick HA. Expression of steroidogenic enzyme and gonadotropin receptor genes in bovine follicles during ovarian follicular waves: a review[J]. J Anim Sci, 1998, 76(7):1903-1921.
[2] Webb R, Campbell BK, Garverick HA, et al. Molecular mechanisms regulating follicular recruitment and selection[J]. J Reprod Fertil Suppl, 1999, 54(54):33-48.
[3] Eppig JJ. Oocyte control of ovarian follicular development and function in mammals[J]. Reproduction, 2001, 122(6):829-838.
[4] Havelock JC, Rainey WE, Carr BR. Ovarian granulosa cell lines[J]. Mol Cell Endocrinol, 2004, 228(1-2):67-78.
[5] Matzuk MM, Burns KH, Viveiros MM, et al. Intercellular communication in the mammalian ovary: oocytes carry the conversation[J]. Science, 2002, 296(5576):2178-2180.
[6] Gilchrist RB, Lane M, Thompson JG. Oocyte-secreted factors: regulators of cumulus cell function and oocyte quality[J]. Hum Reprod Update, 2008, 14(2):159-177.
[7] Chen SU, Chen RJ, Shieh JY, et al. Human chorionic gonadotropin up-regulates expression of myeloid cell leukemia-1 protein in human granulosa-lutein cells: implication of corpus luteum rescue and ovarian hyperstimulation syndrome[J]. J Clin Endocrinol Metab, 2010, 95(8):3982-3992.
[8] Qing T, Shi Y, Qin H, et al. Induction of oocyte-like cells from mouse embryonic stem cells by co-culture with ovarian granulosa cells[J]. Differentiation, 2007, 75(10):902-911.
[9] Chen HF, Jan PS, Kuo HC, et al. Granulosa cells and retinoic acid co-treatment enrich potential germ cells from manually selected Oct4-EGFP expressing human embryonic stem cells[J]. Reprod Biomed Online, 2014, 29(3):319-332.
[10] 张武文, 黄丽丽, 庄亚玲, 等. 巨噬细胞集落刺激因子及其受体mRNA在人卵泡颗粒细胞和胎盘及子宫内膜中的表达[J]. 中国病理生理杂志, 2007, 23(9):1850-1852.
[11] Sela-Abramovich S, Edry I, Galiani D, et al. Disruption of gap junctional communication within the ovarian follicle induces oocyte maturation[J]. Endocrinology, 2006, 147(5):2280-2286.
[12] 文艳飞, 蔡柳洪, 何 文, 等. 卵巢早衰患者来源的诱导多能干细胞的建系、鉴定及诱导分化[J]. 中国病理生理杂志, 2016, 32(1):140-145.
[13] Vanderhyden BC, Armstrong DT. Role of cumulus cells and serum on theinvitromaturation, fertilization, and subsequent development of rat oocytes[J]. Biol Reprod, 1989, 40(4):720-728.
[14] Maalouf WE, Lee JH, Campbell KH. Effects of caffeine, cumulus cell removal and aging on polyspermy and embryo development oninvitromatured and fertilized ovine oocytes[J]. Theriogenology, 2009, 71(7):1083-1092.
[16] Romaguera R, Morató R, Jiménezmacedo AR, et al. Oocyte secreted factors improve embryo developmental competence of COCs from small follicles in prepubertal goats[J]. Theriogenology, 2010, 74(6):1050-1059.
[17] 江 欢, 谢宝国, 罗 琛, 等. 两种人卵巢颗粒细胞分离提纯方法的比较研究[J]. 生殖与避孕, 2012, 32(11):728-732.
[18] Sutton ML, Gilchrist RB, Thompson JG. Effects ofin-vivoandin-vitroenvironments on the metabolism of the cumulus-oocyte complex and its influence on oocyte developmental capacity[J]. Hum Reprod Update, 2003, 9(1):35-48.
[19] Somigliana E, Viganò P, La Sala GB, et al. Follicular fluid as a favourable environment for endometrial and endometriotic cell growthinvitro[J]. Hum Reprod, 2001, 16(6):1076-1080.
[20] 刘玉霞, 董静霞, 金玉洁, 等. 人卵巢颗粒细胞的体外培养方法探讨[J]. 中国组织化学与细胞化学杂志, 2011, 20(5):436-439.
[21] Simoni M, Gromoll J, Nieschlag E. The follicle-stimulating hormone receptor: biochemistry, molecular biology, physiology, and pathophysiology[J]. Endocr Rev, 1997, 18(6):739-773.
