白藜芦醇缓解完全弗氏佐剂所致小鼠炎性痛的NF-κB信号通路机制
2018-03-01王丽君
王丽君, 仝 雷
(郑州工业应用技术学院医学院 1医学机能教研室, 2医学形态教研室, 河南 郑州 451100)
炎性痛(inflammatory pain,IP)是由外伤、手术创伤、化学物质和微生物感染等各种原因引起的组织损伤,各种刺激因素引起肥大细胞、巨噬细胞、中性粒细胞和神经末梢等释放炎症因子,引起局部组织炎症反应,同时伴有局部红、肿、热、痛和功能障碍等,表现为炎症区域的原发性痛和周边的继发性痛,以痛觉过敏、痛觉超敏及自发痛为特征,严重时可影响患者工作和生活质量[1-3]。因此,研究炎性痛的发生机制并寻找有效的缓解措施是疼痛防治的重点与难点。研究表明,多种信号转导通路及炎症介质参与了炎性痛的形成和发展,其中核因子κB(nuclear factor-κB,NF-κB)信号通路及相关的炎症因子,如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin-6,IL-6)等起着重要作用[4-5]。白藜芦醇(resveratrol,Res)是一种从花生、藜芦、葡萄、虎杖和桑椹等植物中提取的具有生物活性的多酚类化合物,具有抗氧化应激、舒张血管、诱导自噬、促凋亡、抗肿瘤、抗病毒、抗抑郁及保护脑缺血损伤等药理活性,且对炎症和疼痛有较好的缓解作用[6-8]。为了进一步阐明白藜芦醇抗炎镇痛的作用机制,本研究采用完全弗氏佐剂(complete Freund’s adjuvant,CFA)小鼠足底注射法复制炎性痛动物模型,同时给予白藜芦醇进行干预,观察其对小鼠炎性痛的改善作用及对NF-κB信号通路的影响,探讨其抗炎性痛作用和相关机制。
材 料 和 方 法
1动物、试剂与仪器
60只清洁级健康BALB/c小鼠,体重18~22 g,雌雄各半,由郑州大学实验动物中心提供,生产许可证号为SCXK (豫)2010-0002。将小鼠饲养于温度(23±2) ℃、湿度45%~65%的动物室,普通饮食饮水。白藜芦醇(纯度98%)购自南京景竹生物科技有限公司,临用时以0.5%羧甲基纤维素钠混悬备用;完全弗氏佐剂(F5881-10ML-PW, 批号068K8761)购自Sigma;地塞米松(dexamethasone,Dex; 每片0.75 mg,批号20160324)购自广东华南药业集团有限公司产品;兔抗小鼠NF-κB p65、NF-κB抑制蛋白α(inhibitor of NF-κB α,IκBα)、IκB激酶β(IκB kinase β,IKKβ)、TNF-α、IL-1β及β-actin抗体,以及羊抗兔过氧化物酶标记IgG II 抗、BCA蛋白质定量试剂盒、PVDF膜、超敏ECL化学发光底物、SDS-PAGE凝胶试剂盒、RIPA裂解液等购自武汉博士德生物工程有限公司;Trizol总RNA抽提试剂盒、BeyoRTTMII M-MLV反转录酶(RNase H-)、Easy-LoadTMPCR Master Mix(Blue, 2×)和琼脂糖购自碧云天生物技术有限公司;PCR引物设计与合成由北京三博远志生物技术有限责任公司完成。BIO-EVF3 von Frey电子测痛仪(Bioseb);DB026型冷热板测量仪和DB020型热刺痛仪(北京智鼠多宝生物科技有限责任公司);FA2104S电子分析天平(上海光学仪器厂);H2500R-2高速冷冻离心机(湖南湘仪离心机仪器有限公司); iMark酶标仪、Gel Doc XR+凝胶成像分析系统、Mini-PROTEAN 3 Dodeca小型高通量电泳槽、Mini Trans-Blot Electrophoreti小型 Trans-Blot 转印槽(湿转)、小型垂直电泳系统、Model 111 Mini IEF Cell等电聚焦电泳槽和SmartSpec Plus 核酸蛋白测定仪等(Bio-Rad);DTC-3T型梯度PCR仪(上海金鹏分析仪器有限公司)。
2动物分组及给药
将60只BALB/c小鼠随机分为6组,每组10只,分别为正常对照(control)组、完全弗氏佐剂炎性痛模型(model)组、阳性对照(CFA+Dex)组和白藜芦醇高、中、低剂量(CFA+Res 100、50、25 mg/kg)组。正常对照组于小鼠右后足垫皮下注射生理盐水20 μL,其余各组小鼠右后足垫皮下注射CFA 20 μL。造模后第7天,正常对照组和模型组小鼠生理盐水10 mL/kg灌胃,阳性对照组小鼠地塞米松0.5 mg/kg灌胃,白藜芦醇给药组小鼠分别给予白藜芦醇100、50和25 mg/kg灌胃,连续给药7 d。
3主要方法
3.1von Frey纤维机械刺激缩足反射阈值(paw withdrawal mechanical threshold,PWMT)的测定[9]将小鼠置于透明有机玻璃罩内(高20 cm,直径10 cm),底部为金属丝制成的网格垫(网格大小为5 mm×5 mm),小鼠适应10 min后开始检测PWMT。操作方法如下:使用不同折力(g)的von Frey纤维丝刺激小鼠右足底皮肤,持续5~7 s,观察小鼠有无抬足现象,若von Frey纤维弯曲至90 °时小鼠仍无抬足现象,则需用大一级的von Frey纤维再次刺激,若有明显反应,则用低一级的von Frey纤维刺激,每次刺激间隔时间为15 s,直到刺激能引起50%抬足反应的von Frey纤维折力即为机械刺激缩足反射阈值,折力超过4.0 g按此值算。各组小鼠于造模前1 d 测定基础机械缩足反射阈值,于造模后第7天(给药前)及给药后第1、3、5和7天测定小鼠机械刺激缩足反射阈值的变化。
3.2热刺激缩足反应潜伏期(paw withdrawal thermal latency,PWTL)的测定[9]将小鼠置于厚度为2 mm的玻璃板上,并调整其与热刺痛仪适当高度,用透明透气塑料笼将小鼠固定在一定活动范围内,使其适应15 min。将热刺痛仪光辐射聚焦点对准小鼠足底,打开开关,记录从照射开始至小鼠出现缩足现象的时间(潜伏期),如果照射时间超过20 s小鼠仍未出现缩足反应,应立即停止,避免灼伤足底。连续测定3次,每次间隔15 min,取平均值作为热刺激缩足反应潜伏期。各组小鼠于造模前1 d测定基础热刺激缩足反应潜伏期,于造模后第7天(给药前)及给药后第1、3、5和7天测定小鼠热刺激缩足反应潜伏期的变化。
3.3冷缩足反射次数(cold withdrawal times,CWT)的测定[9]将小鼠置于冷热板测量仪上,调整板面温度为(4±1) ℃,用透明透气塑料笼控制其活动范围,使其先适应5 min,再记录其5 min内抬足、抖足或添足次数即为冷缩足反射次数。各组小鼠于造模前1 d测定基础冷缩足反射次数,于造模后第7天(给药前)及给药后第1、3、5和7天测定小鼠冷缩足反射次数的变化。
3.4RT-PCR测定小鼠脊髓组织中NF-κB、IκBα、IKKβ、TNF-α及IL-1β的mRNA表达 小鼠末次给药后完成行为学检测后颈椎脱臼处死,快速取出小鼠L4~L6脊髓组织,匀浆后按照Trizol总RNA试剂盒说明书提取RNA,并逆转录为cDNA,进行PCR扩增实验。NF-κB的上游引物序列为5’-CAGCTTCACTCGGAGACTGG-3’,下游引物序列为5’-ACACGGAAGCTGGCTTTGTA-3’,产物314 bp;IκBα的上游引物序列为5’-GGGTGATTCGGCTGTTGTCT-3’,下游引物序列为5’-CCACTGAACACCTGGCTCTT-3’,产物231 bp;IKKβ的上游引物序列为5’-ACACCGTGACCGTTGACTAC-3’,下游引物序列为5’-CTTCTGCCGGACTTTGGAGT-3’,产物119 bp;TNF-α的上游引物序列为5’-CCTCTCATGCACCACCATCA-3’,下游引物序列为5’-GCATTGCACCTCAGGGAAGA-3’,产物184 bp;IL-1β的上游引物序列为5’-CTTTCCCGTGGACCTTCCAG-3’,下游引物序列为5’-AATGGGAACGTCACACACCA-3’,产物125 bp; β-actin的上游引物序列为5’-ACAGCAGTTGGTTGGAGCAAA-3’,下游引物序列为5’-CGCGACCATCCTCCTCTTA-3’,产物197 bp。PCR扩增条件为:94 ℃ 5 min; 94 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s,共35个循环; 72 ℃延伸10 min。将扩增产物行1.2%琼脂糖凝胶电泳检测mRNA表达情况。
3.5Western bolt法检测小鼠脊髓组织NF-κB p65、IκBα、IKKβ、TNF-α及IL-1β 蛋白的表达 小鼠末次给药后完成行为学检测后颈椎脱臼处死,快速取出小鼠L4~L6脊髓组织,于冰上充分匀浆,移入盛有RIPA裂解液的EP管中,按照说明书要求进行蛋白提取。用BCA法检测各样本总蛋白浓度,并调整一致,沸水中灭活蛋白5 min,行SDS-PAGE,转膜,孵育相应 I 抗及 II 抗,加入ECL显色液,于凝胶成像仪下显影拍照,分析蛋白表达情况。
4统计学处理
应用SPSS 17.0统计软件进行数据处理和统计分析。实验数据以均数±标准差(mean±SD)表示,组间样本均数比较采用单因素方差(one-way ANOVA)分析,以P<0.05为差异有统计学意义。
结 果
1白藜芦醇对炎性痛小鼠机械刺激缩足反射阈值的影响
与正常对照组比较,给予CFA 7 d后,模型组及各给药组小鼠机械刺激缩足反射阈值明显降低(P<0.01);与模型组比较,分别给予白藜芦醇100和50 mg/kg后第3、5和7天,小鼠机械刺激缩足反射阈值明显升高(P<0.05或P<0.01),见图1。

Figure 1. The effects of resveratrol (Res) on paw withdrawal mechaical threshold (PWMT) in the mice with inflammatory pain induced by complete Freund’s adjuvant (CFA). Mean±SD.n=10.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图1白藜芦醇对炎性痛小鼠机械刺激缩足反射阈值的影响
2白藜芦醇对炎性痛小鼠热刺激缩足反应潜伏期的影响
与正常对照组比较,给予CFA 7 d后,模型组及各给药组小鼠热刺激缩足反应潜伏期明显缩短(P<0.01);与模型组比较,给予白藜芦醇100 mg/kg后第1天及给予白藜芦醇100和50mg/kg后第3、5和7天,小鼠热刺激缩足反应潜伏期显著延长(P<0.05或P<0.01),见图2。

Figure 2. The effects of resveratrol (Res) on paw withdrawal thermal latency (PWTL) in the mice with inflammatory pain induced by complete Freund’s adjuvant (CFA). Mean±SD.n=10.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图2白藜芦醇对炎性痛小鼠热刺激缩足反应潜伏期的影响
3白藜芦醇对炎性痛小鼠冷缩足反射次数的影响
与正常对照组比较,给予CFA 7 d后,模型组及各给药组小鼠冷缩足反射次数明显增多(P<0.01);与模型组比较,给予白藜芦醇100 mg/kg后第1天、给予白藜芦醇100和50 mg/kg后第3、5和7天及给予白藜芦醇25 mg/kg第7天,小鼠冷缩足反射次数显著减少(P<0.05或P<0.01),见图3。
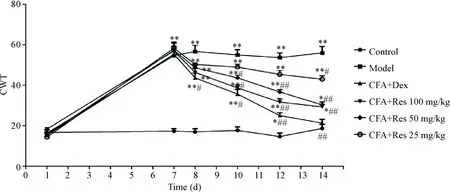
Figure 3. The effects of resveratrol (Res) on cold withdrawal times (CWT) in the mice with inflammatory pain induced by complete Freund’s adjuvant (CFA). Mean±SD.n=10.*P<0.05,**P<0.05vscontrol group;#P<0.05,##P<0.05vsmodel group.
图3白藜芦醇对炎性痛小鼠冷缩足反射次数的影响
4白藜芦醇对炎性痛小鼠脊髓组织NF-κB、IκBα、IKKβ、TNF-α及IL-1βmRNA表达的影响
与正常对照组比较,炎性痛模型组小鼠脊髓组织NF-κB、IκBα、IKKβ、TNF-α及IL-1β的mRNA表达水平明显升高(P<0.01);与模型组比较,给予白藜芦醇100 mg/kg可明显下调炎性痛小鼠脊髓组织NF-κB、IκBα、IKKβ、TNF-α及IL-1β 的mRNA表达水平(P<0.05或P<0.01),见图4。
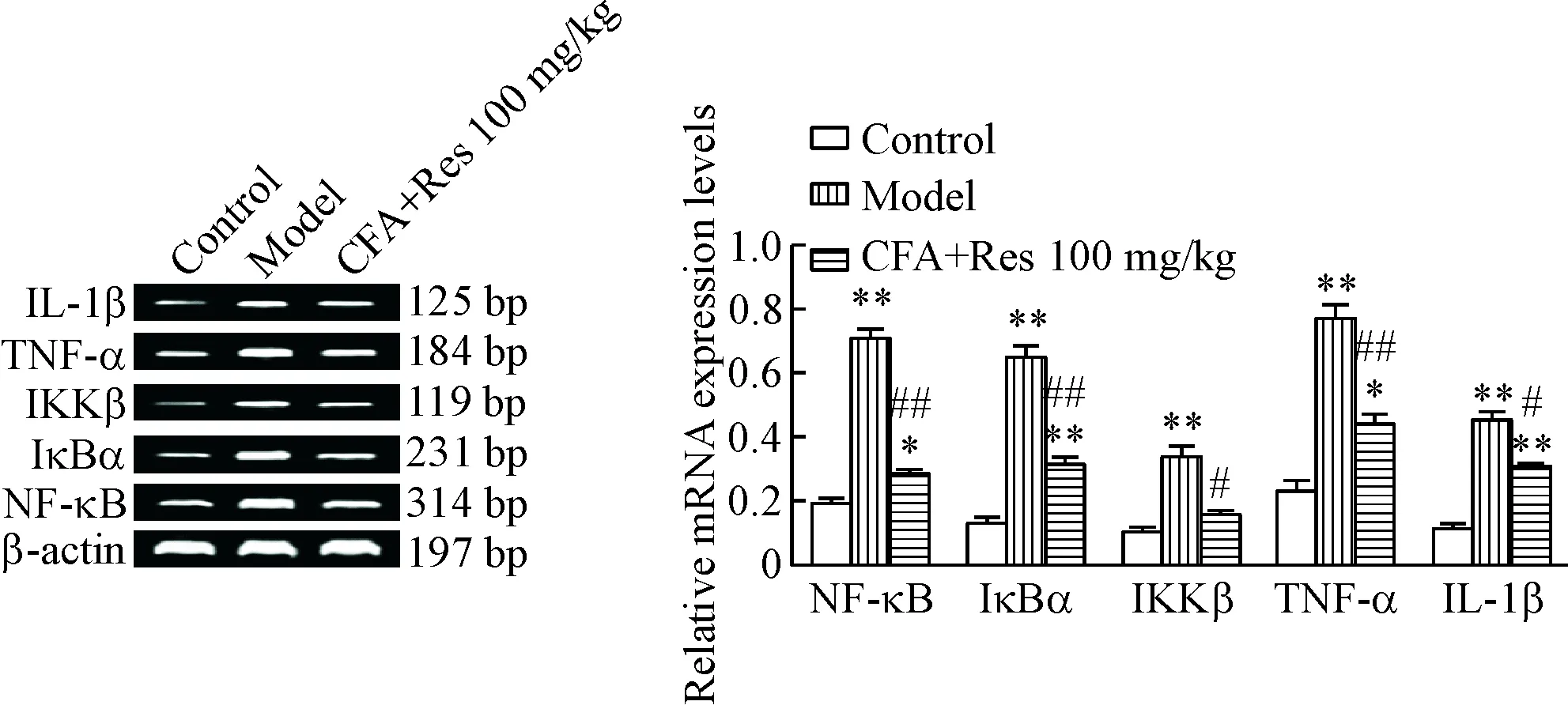
Figure 4. The effects of resveratrol (Res) on the mRNA expression levels of NF-κB, IκBα, IKKβ, TNF-α and IL-1β mRNA in the spinal cord tissues of the mice with inflammatory pain induced by complete Freund’s adjuvant (CFA). Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图4白藜芦醇对炎性痛小鼠脊髓组织NF-κB、IκBα、IKKβ、TNF-α及IL-1βmRNA表达水平的影响
5白藜芦醇对炎性痛小鼠脊髓组织NF-κB、IκBα、IKKβ、TNF-α及IL-1β蛋白表达的影响
与正常对照组比较,炎性痛模型组小鼠脊髓组织NF-κB、IκBα、IKKβ、TNF-α及IL-1β 蛋白表达水平显著升高(P<0.01);与模型组比较,给予白藜芦醇100 mg/kg可显著下调炎性痛小鼠脊髓组织NF-κB、IκBα、IKKβ、TNF-α及IL-1β 蛋白表达水平(P<0.05或P<0.01),见图5。

Figure 5. The effects of resveratrol (Res) on the protein expression levels of NF-κB, IκBα, IKKβ, TNF-α and IL-1β in the spinal cord tissue of the mice with inflammatory pain induced by complete Freund’s adjuvant (CFA). Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
图5白藜芦醇对炎性痛小鼠脊髓组织NF-κB、IκBα、IKKβ、TNF-α及IL-1β蛋白表达水平的影响
讨 论
炎性痛是由损伤或感染的组织或细胞释放炎症介质(因子)所导致的机体感觉异常和痛觉功能障碍的一种慢性病理性疼痛,许多不明原因的疼痛疾患往往都是由于组织的炎症所导致的,因此控制炎症是缓解炎性痛的重要措施之一[10-11]。本研究发现,白藜芦醇在100 mg/kg和50 mg/kg剂量时可明显升高CFA致炎性痛小鼠机械刺激缩足反射阈值,显著延长其热刺激缩足反应潜伏期并减少其冷缩足反射次数,表明白藜芦醇对炎性痛具有较好的缓解作用,可作为一种潜在的抗炎性痛药物进行研究开发。
炎症介质和细胞因子在炎性痛的发生发展中扮演着非常重要的角色,当机体受损或发生炎症时,损伤或炎症组织释放或合成某些炎性介质,通过直接或间接的作用,激活不同的受体使痛觉感受器兴奋从而产生痛觉冲动并形成痛觉。有研究表明,IKKβ/IκBα/NF-κB信号转导途径是调控炎性痛发生发展的重要通路。在生理状态下,NF-κB与IκB结合在一起,IκB为NF-κB抑制蛋白,覆盖NF-κB核定位序列,使得NF-κB以无活性的形式存在于胞浆中。当细胞受损或在炎症因子和氧化剂等刺激下,胞浆内IKK被激活,促进IκBα的第32和36位丝氨酸残基发生磷酸化并快速泛素化,使NF-κB从复合体中游离出来,其核定位序列得以暴露从而被激活,然后转运至细胞核内,与DNA分子靶基因启动子或增强子特定位点结合,调控靶基因的转录和相应蛋白(如TNF-α和IL-1β等)的生成[12]。另外,NF-κB诱导生成的细胞因子如TNF-α和IL-1β等,又是NF-κB活化的刺激剂,可进一步激活NF-κB活性,使损伤和炎症反应持续放大,导致疼痛不断延续和加重[13-16]。研究证实,在炎性痛组织中,NF-κB信号通路被持续激活,抑制其活性可有效缓解炎性痛症状[17]。本研究发现白藜芦醇100 mg/kg可明显降低CFA诱导的炎性痛小鼠脊髓组织NF-κB、IκBα、IKKβ、TNF-α及IL-1β mRNA和蛋白表达水平,提示白藜芦醇缓解CFA炎性痛的作用机制与抑制NF-κB信号通路有关,但其具体的作用靶基因或蛋白还有待进一步的实验研究。
[1] Watanabe S, Iwai T, Tanabe M. Intraplantar injection of sialidase reduces mechanical allodynia during inflammatory pain[J]. J Pharmacol Sci, 2017, 133(1):49-52.
[2] 杨燕京, 李小军, 刘力维, 等. 野木瓜注射液对炎性疼痛小鼠背根神经节COX-2表达的影响[J]. 中国病理生理杂志, 2014, 30(7):1214-1217.
[3] Jahangirvand M, Yazdi F, Moradi M, et al. Intra-accumbal orexin-1 receptors are involved in antinociception induced by stimulation of the lateral hypothalamus in the formalin test as an animal model of persistent inflammatory pain[J]. Iran J Pharm Res, 2016, 15(4):851-859.
[4] Pinho-Ribeiro FA, Zarpelon AC, Mizokami SS, et al. The citrus flavonone naringenin reduces lipopolysaccharide-induced inflammatory pain and leukocyte recruitment by inhibiting NF-κB activation[J]. J Nutr Biochem, 2016, 33(7):8-14.
[5] Calixto-Campos C, Carvalho TT, Hohmann MS, et al. Vanillic acid inhibits inflammatory pain by inhibiting neutrophil recruitment, oxidative stress, cytokine production, and NFκB activation in mice[J]. J Nat Prod, 2015, 78(8):1799-1808.
[6] Liu D, Xie K, Yang X, et al. Resveratrol reverses the effects of chronic unpredictable mild stress on behavior, serum corticosterone levels and BDNF expression in rats [J]. Behav Brain Res, 2014, 264(5):9-16.
[7] 任应国, 唐石磊, 高园林. 白藜芦醇对氧化应激诱导的大鼠海马神经元损伤的影响[J]. 中国病理生理杂志, 2016, 32(6):1057-1061.
[8] 金海东, 戴 兵, 蔡建武, 等. 白藜芦醇通过PI3K/Akt通路及线粒体途径抑制软骨肉瘤[J]. 中国病理生理杂志,2014, 30(8):1379-1383.
[9] 金少举, 任丽平, 马奔晖, 等. 槐果碱对神经病理性疼痛小鼠GABA信号通路的影响[J]. 中药药理与临床, 2016, 32(3):24-28.
[10] Manchope MF, Calixto-Campos C, Coelho-Silva L, et al. Naringenin inhibits superoxide anion-induced inflammatory pain: role of oxidative stress, cytokines, Nrf-2 and the NO-cGMP-PKG-KATPchannel signaling pathway[J]. PLoS One, 2016, 11(4):e0153015.
[11] Ruiz-Miyazawa KW, Pinho-Ribeiro FA, Zarpelon AC, et al. Vinpocetine reduces lipopolysaccharide-induced inflammatory pain and neutrophil recruitment in mice by targeting oxidative stress, cytokines and NF-κB [J]. Chem Biol Interact, 2015, 237(7):9-17.
[12] 于文燕, 马小娟, 孙宏卫, 等. RNA结合蛋白HuR对NF-κB抑制因子α 转录后调控机制的初步研究[J]. 中国病理生理杂志, 2013, 29(4):688-694.
[13] Khan S, Shehzad O, Chun J, et al. Mechanism under-lying anti-hyperalgesic and anti-allodynic properties of anomalin in both acute and chronic inflammatory pain models in mice through inhibition of NF-κB, MAPKs and CREB signaling cascades[J]. Eur J Pharmacol, 2013, 718(1-3):448-458.
[14] Possebon MI, Mizokami SS, Carvalho TT, et al. Pimaradienoic acid inhibits inflammatory pain: inhibition of NF-κB activation and cytokine production and activation of the NO-cyclic GMP-protein kinase G-ATP-sensitive potassium channel signaling pathway[J]. J Nat Prod, 2014, 77(11):2488-2496.
[15] 陈 伟, 马 磊, 杨立山. 甘草次酸对哮喘大鼠的抗氧化应激作用及NF-κB信号通路的调控[J]. 郑州大学学报: 医学版, 2016, 51(6):762-765.
[16] 王依慰, 刘清珍, 陈春龙, 等. 白藜芦醇通过降低NF-κB p65乙酰化缓解大鼠神经病理性疼痛[J]. 中国药理学通报, 2016, 32(1):89-93.
[17] 洪辉华, 赵 玮, 朱渊红, 等. 芪冬活血饮对巨噬细胞TLR4/NF-κB炎性信号通路的影响[J]. 中华中医药杂志, 2016, 31(4):1394-1397.
