复方贞术调脂胶囊对兔腹主动脉再狭窄模型血脂及炎症因子的影响*
2018-03-01张仁丹黎土娣王加伟邓惠坚曾智桓
张仁丹, 黎土娣, 王加伟, 邓惠坚, 曾智桓
(广东药科大学附属第一医院, 广东 广州 510080)
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)作为冠状动脉粥样硬化性心脏病(简称冠心病)血运重建的主要治疗方式之一,可明显降低冠心病的死亡率,但术后血管再狭窄发生率高极大的限制了PCI术的临床疗效[1]。血管再狭窄的发生涉及不同程度的血管弹性回缩、内膜增厚、血管重塑、炎症及平滑肌细胞迁移和增殖等多项机制[2]。PCI术中球囊扩张或支架展开后,使血管内皮细胞表面破坏和剥脱,引起一系列的炎症介质和趋化因子释放等炎症级联反应;炎症反应的发生被认为是再狭窄的始动因素;因此,如何有效抑制炎症,是防止PCI术后再狭窄的关键[3]。有研究证实,PCI术后血脂高的患者再狭窄的发生率较高,心绞痛的复发时间与高脂血症密切相关,而且血脂控制不良可加速血管壁炎症进展[4]。复方贞术调脂胶囊(Fufang Zhenzhu Tiaozhi capsule,FTZ)依据中医药学理论进行组方,由女贞子、白术、丹参、三七和黄连等8味中药组成,可通过多途径、多靶点综合调节机体脂质代谢紊乱,治疗高脂血症和脂代谢紊乱相关疾病。前期临床实践和实验研究发现,该方有明显降低总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)及升高高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)的作用,可抑制动脉粥样硬化的形成[5]。本文主要通过建立动脉粥样硬化模型及血管球囊成形术后再狭窄模型,探索FTZ治疗对模型动物血脂及炎症因子的影响,明确FTZ是否通过降低血脂水平和抑制核因子κB(nuclear factor-κB,NF-κB)通路调控各种炎症因子起到治疗再狭窄的作用。
材 料 和 方 法
1实验动物
新西兰大白兔30只,雌雄不拘,体质量(2.0±0.2)kg,由广东省医学实验动物中心提供,动物合格证号为SYXK(粤)2012-0125。饲料均购自于广东省医学实验动物中心,许可证号SYXK(粤)2013-0002。分笼饲养,饲养温度20~26 ℃,相对湿度40%~70%,120 g·kg-1· d-1定量喂食,高脂饲料(配方为1.5%的胆固醇、0.5%的胆盐、8%的猪油和10%的蛋黄粉)以60 g·kg-1·d-1喂养,自由饮水。观察一般精神状况、饮食、皮毛、肥胖程度及有无腹泻等。
2主要药物及试剂
复方贞术调脂胶囊(批号为20160603,由广东药科大学药物研究所提供);阿托伐他汀钙片(批号H20051408,辉瑞制药有限公司);ELISA试剂盒(批号XO7015918和EI6015917,武汉华美生物工程有限公司);抗NF-KB p65多克隆抗体(批号SA2318595,Thermo Fisher)。
3主要仪器
Artis zee III ceiling数字减影X射线机(Siemens); 桡动脉穿刺包(包括穿刺套管针、细超滑钢丝和6F 桡动脉鞘,TERUMO);经皮冠状动脉腔内成形术球囊(Metronic);7108ISE型全自动生化分析仪(HITACHI);高倍显微镜(Olympus)。
4实验方法
4.1分组与模型制备 适应性喂养1周后,按随机数字表法分为5组,每组6只,即空白对照(blank control)组、再狭窄模型(restenosis)组、FTZ 组(0.66 g·kg-1·d-1)、阿托伐他汀(5 mg·kg-1·d-1)组及FTZ 和阿托伐他汀联合用药组。
4.1.1动脉粥样硬化模型制备 按照文献提供方法[6],除空白对照组外,其它4组均行以下操作,用戊巴比妥钠以1 mL/kg经耳缘静脉注射麻醉,仰卧位固定,采用TERUMO桡动脉穿刺包穿透法成功穿刺股动脉后轻柔地进入导丝,沿导引钢丝插入6F(1F=0.33 mm)桡动脉鞘管,取动脉血10 mL,检测血脂,并用ELISA法检测细胞因子,300 U肝素抗凝,在数字减影X射线机下,经动脉鞘管注入碘海醇注射液行动脉造影。再沿鞘送入Sprinter球囊(3.0 mm×20 mm)至腹主动脉,用303.975 kPa充盈球囊,在腹主动脉上下牵拉3次,充分剥离腹主动脉内皮。伤口用纱布卷加压包扎,大腿内侧肌肉注射青霉素钠(8×105U/d),注射3 d。继续高脂饲养4周。空白对照组实验步骤同上,但不予球囊损伤。
4.1.2腹主动脉球囊成形术建立再狭窄模型 高脂饲养4周后,再次采用上述方法麻醉、固定动物并穿刺股动脉,采动脉血检测血脂,并用ELISA法检测细胞因子,沿鞘送入球囊至腹主动脉,用607.95 kPa充盈球囊扩张腹主动脉损伤处,每次扩张30 s,扩张3次。伤口用纱布卷加压包扎,大腿内侧肌肉注射青霉素钠(8×105U/d),注射3 d。各服药组灌胃服用相应药物(1%的羧甲基纤维素钠溶液溶解阿托伐他汀;FTZ配成相应浓度的混悬液;模型组灌服1%羧甲基纤维素溶液)后,均予普通饲料饲养4周。最后再采用上述方法麻醉、固定及穿刺股动脉,采动脉血检测血脂,并用ELISA法检测细胞因子,取腹主动脉备用。
4.2血管造影血管狭窄分析 使用数字减影X射线机主机自带的二维定量冠脉造影原厂工作站对造影结果中2幅不同角度的造影图片进行定量分析,主要测量:(1)靶血管在不同投照角度的长度(取较充分暴露血管病变和没有明显短缩的为二维靶血管长度);(2)参考血管直径(reference vessel diameter,RVD;病变近段直径与远段直径之和均数);(3)直径狭窄率[即最小管腔直径(minimum lumen diameter,MLD)百分比,MLD%]=(1-MLD/RVD)×100%(2幅投照角度直径狭窄率之和均数);(4)面积狭窄率[即最小管腔面积(minimum lumen area, MLA)百分比,MLA%]=(1-MLA/参考管腔面积)×100%(2幅投照角度面积狭窄率之和均数)[7]。
4.3血清学指标的测定 取上述实验血标本5 mL,予全自动生化分析仪测定血清LDL-C、HDL-C、极低密度脂蛋白胆固醇(very-low-density lipoprotein cholesterol,VLDL-C)、TC和TG浓度。另取血标本5 mL,静置30 min后3 000 r/min 离心10 min后取血清,置于-80 ℃冰箱保存备用。按照ELISA试剂盒说明书步骤测定NF-κB抑制蛋白(inhibitor of NF-κB,IκB)、白细胞介素1(interleukin-1,IL-1)和单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)的含量。
4.4免疫组织化学染色 腹主动脉取材后,用生理盐水洗去血液,4%甲醇固定1 d后脱水,包埋蜡块,切片行免疫组织化学染色。免疫组织化学染色阳性表达的细胞显微镜下观察为棕黄色或棕褐色颗粒。每张切片随机选择10个视野(×400)观察,NF-κB染色强度用平均吸光度(A)表示,使用Image-Pro Plus 软件分析。
5统计学处理
采用SPSS 21.0的软件包对数据进行分析,计量数据用均数±标准差(mean±SD)表示, 实验数据先进行正态性检验和方差齐性检验,组间均数比较在方差齐时用单因素方差分析,方差不齐时用非参数检验。以P<0.05为差异具有统计学意义。
结 果
1实验动物的一般情况
在整个实验过程中,各组动物的体质量逐渐增加。为预防腹泻,每天以酵母片0.2 g喂食。本实验纳入新西兰兔30只,共 5 组,均顺利完成实验,进入结果分析。
2动脉粥样硬化模型和再狭窄模型的建立
与第1次血管造影相比,第2次血管造影球囊扩张前MLD%和MLA%显著升高(P<0.01),表明球囊损伤结合高脂饮食成功建立动脉粥样硬化模型;经球囊扩张治疗后,与第2次血管造影球囊扩张后相比,第3次手术中模型组的MLD%及MLA%显著升高(P<0.01),表明动脉再狭窄模型成功建立,见图1、表1。
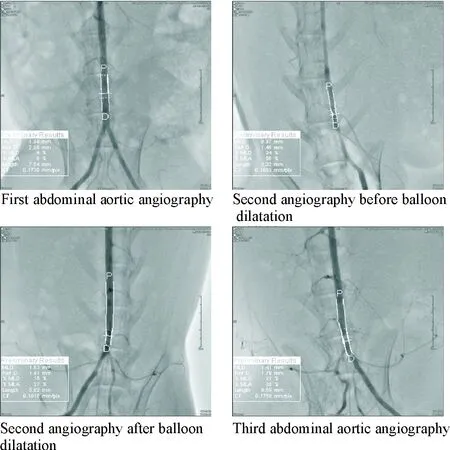
Figure 1. The angiographic images during modeling.
图1模型建立过程中的血管造影图像

表1 模型建立过程中的 MLD%和MLA%分析结果
**P<0.01vsfirst abdorminal aortic angiography;##P<0.01vssecond angiography after balloon dilatation.
3FTZ对兔腹主动脉造影成形术后血管的影响
与空白对照组相比,再狭窄模型组MLD%及MLA%显著升高(P<0.01);与模型组相比,FTZ治疗组、阿托伐他汀治疗组及联合用药组的MLD%及MLA%均明显下降(P<0.01);但各用药组间差异无统计学显著性(P>0.05),表明FTZ和阿托伐他汀均能明显改善球囊成形术后再狭窄的状况,抑制内膜增生,见图2、表2。
4FTZ对兔腹主动脉成形术后血脂的影响
与空白对照组相比,再狭窄模型组血清的TC、TG、HDL-C、LDL-C和VLDL-C浓度显著升高(P<0.05或P<0.01);与再狭窄模型组相比,FTZ组、阿托伐他汀组和联合用药组TC、LDL-C和VLDL-C浓度均显著降低(P<0.01),联合用药组HDL-C明显升高(P<0.05),各组间的TG浓度差异无统计学显著性,表明FTZ和阿托伐他汀均能降低血脂水平,且2种药物联合用药时有升高HDL-C作用;与阿托伐他汀组相比,FTZ组TC、TG、LDL-C和VLDL-C浓度的差异均无统计学显著性,表明FTZ与阿托伐他汀降低血脂的疗效相当;分别与FTZ组和阿托伐他汀组相比,联合用药组TC、LDL-C和VLDL-C均显著降低(P<0.05), HDL-C的差异无统计学显著性,表明FTZ和阿托伐他汀联合用药时降低血脂的作用更加明显,见表3。
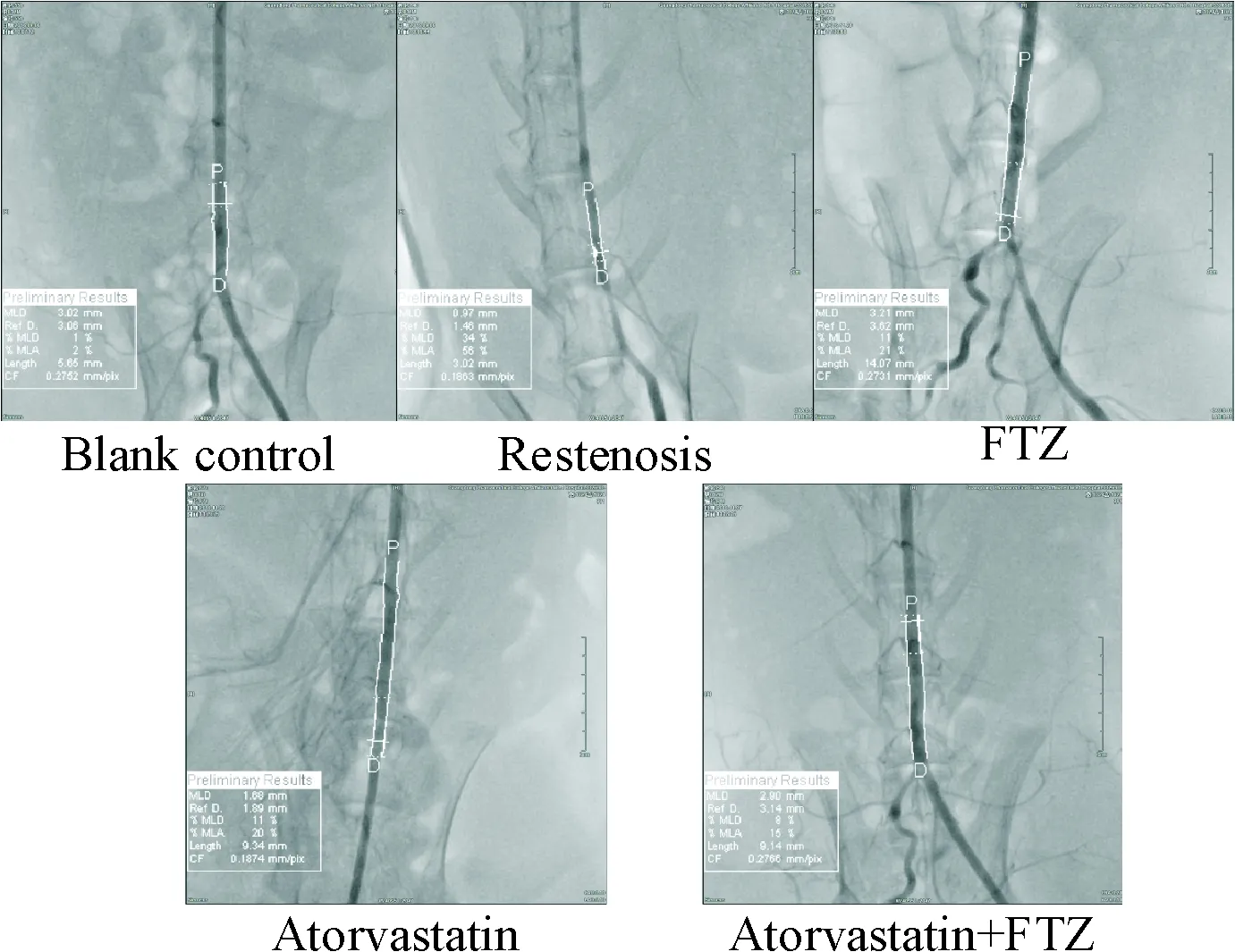
Figure 2. Rabbit abdominal aorta angiography analysis of vascular stenosis in each group.
图2各组兔腹主动脉血管造影分析血管狭窄情况
表2各组MLD%和MLA%分析结果
Table 2. Comparison of the abdominal aortic stenosis in each group (%. Mean±SD.n=6)

GroupMLD%MLA%Blankcontrol2.66±1.035.50±2.43Restenosis33.67±8.52∗∗57.17±9.62∗∗FTZ10.17±4.16##12.83±3.43##Atorvastatin9.33±4.67##16.33±7.00##Atorvastatin+FTZ7.00±1.67##20.66±5.64##
**P<0.01vsblank control group;##P<0.01vsrestenosis group.
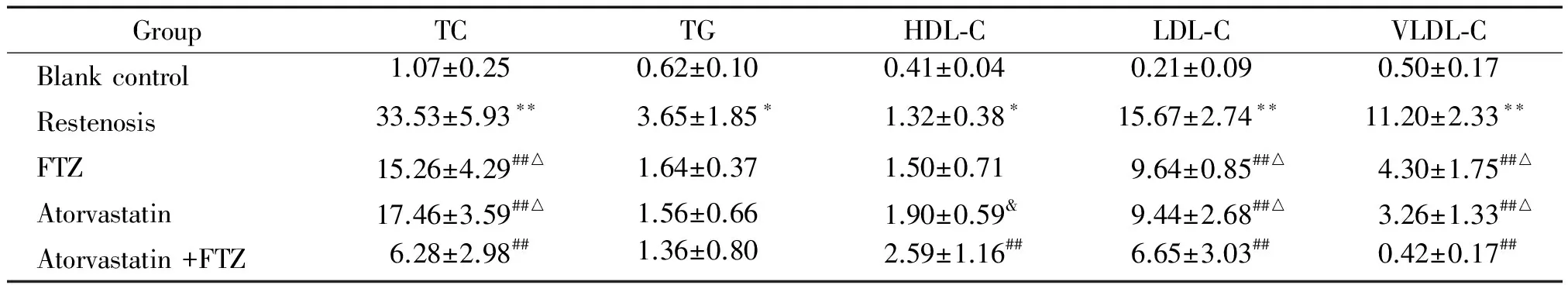
表3 各组血脂的比较
*P<0.05,**P<0.01vsblank control group;##P<0.01vsrestenosis group,&P<0.05vsFTZ group;△P<0.05vsatorvastatin+FTZ group.
5FTZ对兔腹主动脉成形术后细胞因子的影响
与空白对照组相比,再狭窄模型组的IL-1和MCP-1含量显著升高(P<0.01),IκB明显降低(P<0.05),表明再狭窄模型组中存在明显的炎症反应;与再狭窄模型组相比,FTZ组、阿托伐他汀组和FTZ +阿托伐他汀组血清中IL-1和MCP-1的含量显著降低(P<0.01),各组间IκB的含量无显著差异,表明FTZ与阿托伐他汀均有显著抑制炎症反应的作用;与阿托伐他汀组相比,FTZ组IL-1和MCP-1含量的差异均无统计学显著性,表明FTZ与阿托伐他汀抑制炎症反应的效果相当;分别与FTZ组和阿托伐他汀组相比,联合用药组IL-1显著降低(P<0.05),表明两者联合用药时可能对抑制炎症反应的效果更显著,见表4。

表4 各组炎症因子的比较
*P<0.05,**P<0.01vsblank control group;##P<0.01vsrestenosis group;△P<0.05vsatorvastatin+FTZ group.
6腹主动脉免疫组织化学检测结果
再狭窄模型组中NF-κB表达显著高于空白对照组及各治疗组(P<0.01),表明与空白对照组相比,再狭窄模型组中炎症反应导致的内膜增生明显,与模型组相比,各用药组均有抑制炎症反应,从而抑制内膜增生;FTZ组与阿托伐他汀组NF-κB表达未见明显差异(P>0.05),表明FTZ与阿托伐他汀抑制内膜增生作用的效果相当;联合用药组较单用药组NF-κB表达明显减少(P<0.05),表明FTZ与阿托伐他汀联合用药有更强的抑制内膜增生作用,见图3。

Figure 3. The results of immunohistochemical staining for determining the expression of nuclear factor-κB in rabbit arota in each group (×400). Mean±SD.n=6.*P<0.05vsblank control group;#P<0.05vsrestenosis group;△P<0.05vsatorvastatin+FTZ group.
图3各组兔腹主动脉NF-κB表达的免疫组化染色结果
讨 论
PCI术后再狭窄的高发生率明显限制了其临床疗效,现研究认为再狭窄的主要病理基础是PCI术后引起的血管内膜的剥脱损伤,导致中膜血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增殖和迁移、细胞外基质(extracellular matrix,ECM)大量积聚及新生内膜增生[8]。动脉粥样化形成的第一阶段的特征在于内皮细胞功能障碍,该病变导致循环中起免疫防御能力的炎症细胞,通过复合信号级联反应被招募到损伤的内皮表面,从而内皮细胞开始表达其表面黏附分子等相关因子[9]。单核细胞进入血管壁已被视为动脉粥样硬化发生的关键步骤,激活的单核细胞可改变细胞功能,出现黏附和增殖等炎症反应的特征。PCI术中球囊扩张或支架展开后,使血管内皮损伤剥脱、斑块压碎,致斑块内炎症介质和化学趋化因子释放。释放的细胞因子和炎症介质可诱导单核细胞和淋巴细胞等炎症细胞向损伤部位趋化,血管内膜表面吸附了大量的单核细胞和白细胞等炎症细胞,诱发了早期的炎症反应。随后,巨噬细胞浸润血管内膜并围绕损伤部位聚集成簇,聚集于损伤部位的血小板、巨噬细胞及组织细胞分泌大量趋化因子、生长因子诱导VSMCs从中膜迁移入内膜,VSMCs大量增殖,不断的产生细胞因子、生长因子和ECM,最终导致新生内膜的增生[10]。本研究比较了各实验组第1次球囊扩张与第2次球囊扩张前的MLD%和MLA%,及第2次球囊扩张后及第3次血管造影的指标,差异都具有统计学意义,说明成功建立了动脉粥样硬化模型及腹主动脉球囊成形术再狭窄模型。
我们的前期研究发现FTZ对动脉粥样硬化(atherosclerosis,AS)兔有抗脂质过氧化及保护血管内皮功能的作用,这可能是其抗AS作用的机制之一。韦燕萍[5]等也证明FTZ可通过恢复肝酯酶活性,加快清除血液中的脂蛋白残粒,降低血浆中的甘油三酯,同时对HDL代谢也进行调节,使HDL-C回升,从而发挥其抗动脉硬化作用[11]。本实验结果显示,经FTZ和阿托伐他汀治疗后,与再狭窄模型组相比,其血脂浓度出现明显改变,表现为TC、TG和LDL-C下降,HDL-C有所升高,FTZ的降脂作用与上述报道相符。高脂血症在再狭窄中起重要作用,PCI术后血脂的良好控制是防止再狭窄的目标之一。本实验通过FTZ与阿托伐他汀对比,结果表明FTZ有降低血脂从而发挥预防再狭窄的作用。
在内皮剥脱后早期,炎症细胞如MCP-1就会发生浸润,并进一步刺激单核细胞增殖,从而导致再狭窄;IL-1由粥样斑块内激活的巨噬细胞产生,可促进VSMCs增殖和向粥样斑块和内皮细胞招募更多炎性细胞[1];NF-κB作为真核细胞中普遍存在的一种转录因子,在细胞内调控许多生物反应过程,有研究证明其是重要的促动脉粥样硬化因子,可调控动脉粥样硬化所有过程阶段的基因[12]。激活NF-κB可以通过调节MCP-1等基因的表达来促进血管平滑肌细胞的增殖,通过抑制NF-κB通路,血管损伤后新生内膜形成减少[13]。可见,NF-κB的产生可加速再狭窄的进程,本实验结果也显示,与对照组相比,再狭窄模型组血清中NF-κB靶基因表达产物如IL-1和MCP-1等相应增高,表明球囊损伤后,NF-κB被激活且引起了一系列靶基因的激活,介导炎症反应。且经免疫组化验证,NF-κB在组织表达量模型组较空白对照组明显升高,而用药组都相应的减少NF-κB的表达量,表明FTZ可能通过抑制NF-κB通路,抑制炎症因子的产生,从而减少球囊损伤术后炎症反应引起的内膜损伤,抑制血管成形后再狭窄。
总而言之,血管内皮损伤和炎症反应是PCI术后血管再狭窄的重要病理生理机制,控制血脂水平、抑制炎症反应是防治PCI术后再狭窄的重要策略。本实验研究发现,FTZ对兔腹主动脉再狭窄模型有降低血脂并抑制炎症反应的作用,而且FTZ的作用机制可能与抑制NF-κB从而调节炎症因子有关。不仅如此,结合血脂及细胞因子检测,FTZ联合阿托伐他汀抑制再狭窄的效果比单用药物更加显著,该点可为中西医结合治疗动脉粥样硬化及PCI术后内膜增生提供理论及实验依据。
[1] Looser PM, Kim LK, Feldman DN. In-stent restenosis: pathophysiology and treatment[J]. Curr Treat Options Cardio Med, 2016, 18(2):10.
[2] Guildford AL, Stewart HJ, Morris C, et al. Substrate-induced phenotypic switches of human smooth muscle cells: aninvitrostudy of in-stent restenosis activation pathways[J]. J R Soc Interface, 2011, 8(58):641-649.
[3] Welt FG, Rogers C. Inflammation and restenosis in the stent era[J]. Arterioscler Thromb Vasc Biol, 2002, 22(11):1769.
[4] Maibaum T. The treatment of disorders of lipid metabolism[J]. Dtsch Arztebl Int, 2016, 113(38):642-642.
[5] 韦燕萍, 江 涛, 唐春萍, 等. 复方贞术调脂胶囊对动脉粥样硬化兔脂质过氧化及内皮功能的影响[J]. 中国中西医结合杂志, 2011, 31(6):816-819.
[6] 曾智桓, 董吁刚, 赵艳群, 等. 西洛他唑调节核因子κB通路抑制炎症因子治疗兔髂动脉成形后的血管内再狭窄[J]. 中国组织工程研究, 2010, 14(35):6573-6577.
[7] Shah R, Jones WS, Kohl LP, et al. TCT-284 comparison of visual assessment of coronary stenosis with independent quantitative coronary angiography: findings from the PROspective Multicenter Imaging Study for Evaluation of chest pain (PROMISE) Trial[J]. Am Heart J, 2017, 184:1-9.
[8] Monraats PS, RP Agema W, Jukema JW. Genetic predictive factors in restenosis[J]. Pathol Biol, 2004, 52(4):186-195.
[9] Landmesser U, Hornig B, Drexler H. Endothelial function: a critical determinant in atherosclerosis?[J]. Circulation, 2004, 109(21 Suppl 1):II27-II23.
[10] Park SJ, Kang SJ, Virmani R, et al. In-stent neoatherosclerosis: a final common pathway of late stent failure[J]. J Am Coll Cardiol, 2012, 59(23):2051-2057.
[11] Ridker PM, Lüscher TF. Anti-inflammatory therapies for cardiovascular disease[J]. Eur Heart J, 2014, 35(27):1782-1791.
[12] Pamukcu B, Lip GY, Shantsila E. The nuclear factor-κB pathway in atherosclerosis: a potential therapeutic target for atherothrombotic vascular disease[J]. Thromb Res, 2011, 128(2):117-123.
[13] Yu XH, Zheng XL, Tang CK. Nuclear factor-κB activation as a pathological mechanism of lipid metabolism and atherosclerosis[J]. Adv Clin Chem, 2015, 70:1-30.
