和肽素水平对大鼠心肾综合征的早期预测价值*
2018-03-01盛晓生丁明星郭方明俞章平蒋李珍方远书
盛晓生, 林 丽, 丁明星, 郭方明, 俞章平, 蒋李珍, 华 仙, 方远书
(1金华市人民医院心内科, 2金华市人民医院麻醉科, 3金华职业技术学院医学院, 4金华市实验动物中心, 浙江 金华 321000)
心肾综合征(cardiorenal syndrome,CRS)是指患者同时存在心功能不全和肾损害,且两者之间存在复杂相互作用的临床综合征[1]。CRS包括不同的心脏和肾脏的病理生理障碍,任一器官的急、慢性功能障碍均可导致另一器官的急慢性功能障碍,两者互为临床发病危险因素,相互加重导致心肾功能急剧恶化而增加死亡率,因而寻求早期特异和敏感的生物标志物预测“心肾共损”,极为迫切[2]。和肽素(copeptin,CPP)是精氨酸加压素(arginine vasopressin,AVP)原C末端的一部分,在体内稳定,便于检测,已发现其在急性心肌梗死等心脑血管疾病的早期诊断及预后判断方面有重要的临床价值[3-4],但与CRS发病及诊疗的相关研究较少,尤其缺乏动物模型的数据。因此,本项目应用部分肾切除术(subtotal nephrectomy,SNX)合并心肌梗死(myocardial infarction,MI)的合并术式(SNX+MI)加重脏器损伤来建立CRS大鼠模型,观察血浆及尿液中CPP浓度的动态变化,并与脑钠肽(brain natriuretic peptide,BNP)等指标对比分析以评价CPP水平对CRS大鼠的预测价值,为寻找对CRS的诊断及预后的新标志物提供依据。
材 料 和 方 法
1材料
雄性SD大鼠60只,体重250~280 g,SPF级,购自上海斯莱克实验动物有限责任公司,许可证号为SCXK(沪)2012-0002,合格证号为0278317。BP-300型大鼠应用尾静脉无创血压测量系统购自成都泰盟软件有限公司。血尿素氮(blood urea nitrogen,BUN)测试盒(南京建成生物工程研究所有限公司);肌酐测定试剂盒(宁波瑞源生物科技有限公司);CPP和BNP ELISA试剂盒(USCN)。
2方法
2.1动物造模及分组 60只实验大鼠在动物房环境中适应6 d后,采用随机抓取方法(进行数字编号,从每窝中随机抓取2只放入1组)共分4组(每组15只),包括空白对照(blank control,Con)组、肾衰组(SNX组)、心衰组(MI组)和心衰+肾衰组(CRS组),按照文献报道的方法采用复合术式建模[5]。空白对照组进行常规喂养,不做任何其余处理。SNX组用10%水合氯醛(3 mL/kg)腹腔麻醉后,打开腹腔,结扎左侧肾脏肾动脉、肾静脉和输尿管后,切除左侧5/6肾脏,关闭腹腔,术后3 d肌注10万单位青霉素钠抗感染。MI组用10%水合氯醛(3 mL/kg)腹腔麻醉后, 肢体Ⅱ导联监测ECG;口鼻部戴自制呼吸面罩,连接呼吸机维持呼气末正压呼吸(呼吸机参数设置为呼吸频率55~60次/分,呼吸比为1∶2,潮气量为20 mL/kg);左侧 3、4肋间开胸器撑开开胸,暴露心脏, 左心耳下缘2~3 mm处进针, 深度1.5~2 mm,宽度2~3 mm,结扎左冠状动脉主干;肉眼观察左心室壁变白,ECG QRS波形变高变宽,S波与T波交点(J点)明显抬高,或者出现R波消失,呈典型QS波形时,提示结扎成功;术后3 d肌注10万单位青霉素钠抗感染。CRS组切除左侧5/6肾脏并结扎冠状动脉建模。所有的实验程序按照实验动物批准协议进行。
2.2心功能与血压(blood pressure,BP)评估 各组大鼠于造模后9 d和第5周处死前,用10%水合氯醛(3 mL/kg)腹腔麻醉后,颈部正中纵行切开2 cm切口,暴露右颈总动脉,PE50导管插管至左心室,采用生物信号处理系统分析心功能参数[心率(heart rate,HR)、左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)等]的变化。各组大鼠应用尾静脉无创血压测量系统测量BP的变化,每周1次,共5次。
2.3肾功能评价 建模成功后,通过大鼠眼眶取血,收集尿液,每周1次,共5次,进行肾功能检测。应用BUN测试盒以生化法检测血清中各组大鼠BUN的水平;应用肌酐测定试剂盒以肌氨酸氧化酶法检测各组大鼠血清及尿液中的肌酐水平。
2.4ELISA检测CPP和BNP水平 建模成功后,眼眶取血及收集尿液,每周1次,共5次。分别采用CPP和BNP ELISA试剂盒按照试剂盒说明操作,检测各组大鼠血清及尿液中CPP和BNP水平。
2.5心和肾的组织学观察 分别于建模后第9天和第5周杀死大鼠,取心和肾组织进行常规HE染色切片组织光镜检查,以确认CRS大鼠心和肾组织病理形态的改变。
3统计学处理
所有数据使用SPSS 22.0统计软件包进行统计分析。计量资料采用均数±标准差(mean±SD)表示,组间均数比较用单因素方差分析(one-way ANOVA),进一步两两比较采用SNK-q检验;非正态分布资料采用非参数检验;正态分布资料的相关分析采用Pearson直线相关,非正态分布资料的相关分析采用Spearman秩相关。应用受试者工作特征 (receiver operating characteristic, ROC)曲线确定CPP、BNP及BUN对CRS的早期诊断价值。以P<0.05为差异具有统计学意义。
结 果
1各组大鼠心功能和血压的变化
血流动力学检测结果显示,与Con组相比,SNX组大鼠的LVEDP在9 d时显著升高(P<0.05),MI组大鼠LVSP在9 d时显著降低,LVEDP显著升高(P<0.05),CRS组大鼠LVSP在9 d时显著降低,LVEDP显著升高(P<0.05或P<0.01)。血压检测结果示,与Con组比,SNX组大鼠的收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)和平均动脉压(mean arterial pressure,MAP)在1周时显著降低(P<0.05),MI组大鼠的SBP、DBP和MAP在3周时显著降低(P<0.05),而CRS组大鼠的SBP、DBP和MAP在各时点的差异无统计学显著性,见表1。
2各组大鼠肾功能的变化
与Con组比,SNX组在造模后3周BUN显著升高(P<0.05), CRS组在造模后1和3周BUN显著升高(P<0.05);与Con组相比,SNX组大鼠的血清肌酐(serum creatinine,SCr)在造模3周显著升高(P<0.05),尿肌酐(urinary creatinine,UCr)在1周、3周时间点均显著升高(P<0.05),MI组大鼠的UCr在1周时间点均显著升高(P<0.05),CRS组大鼠的UCr在1周、3周时间点均显著升高(P<0.05或P<0.01),见表2。

表1 各组大鼠血流动力学和血压的变化
*P<0.05,**P<0.01vsCon group.

表2 各组大鼠第1、3周肾功能的变化
*P<0.05,**P<0.01vsCon group.
3CPP与BNP水平的变化及其与其它指标的关系
与Con组相比,SNX组在造模3和5周血清和尿液中CPP均显著升高(P<0.05);MI组在造模后3周血清中CPP显著升高(P<0.05);CRS组在造模后1、3和5周血清中CPP显著升高(P<0.05),造模后3周尿液中CPP显著升高(P<0.05),见表3。同时,与Con组相比,SNX组在造模后1和3周血清中BNP显著升高(P<0.05),造模后5周尿液中BNP显著升高(P<0.05);MI组在造模后1、3和5周尿液中BNP显著升高(P<0.05);CRS组在造模后1和3周血清中BNP显著升高(P<0.05),造模后5周尿液中BNP显著升高(P<0.05),见表4。
相关分析显示,CRS组在造模后1周血清中CPP与BNP和BUN无相关性(r分别为0.109和0.683,P>0.05),尿液中CPP与BNP和BUN亦无相关性(r分别为-0.342和0.293,P>0.05)。
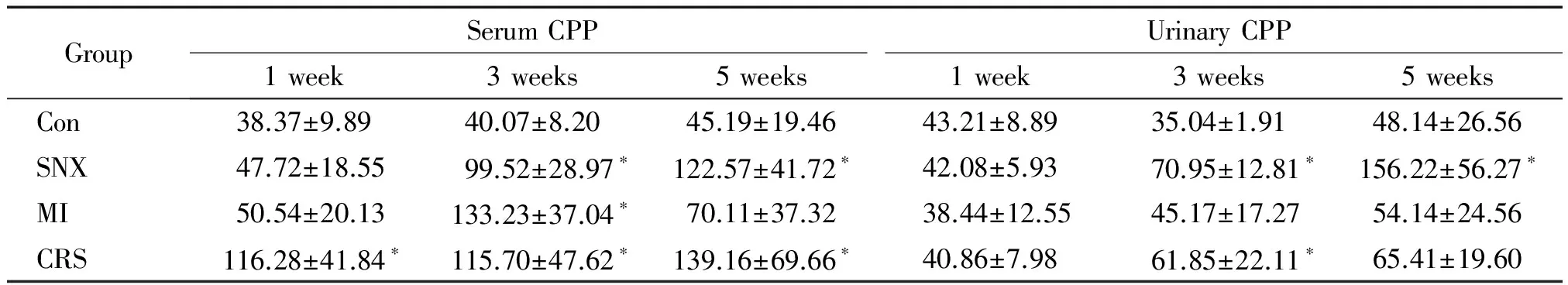
表3 各组大鼠CPP水平的变化
*P<0.05vsCon group.

表4 各组大鼠BNP水平的变化
*P<0.05vsCon group.
4CPP与BNP水平对CRS的早期诊断价值
选取各模型组血清CPP(sCPP)及尿液 CPP(uCPP)与BNP在造模后1周和3周的检测结果为检验变量,以组别为状态变量,定义SNX组和MI组为组别0、CRS组为组别1,进行ROC曲线分析。结果显示,上述各指标检测诊断CRS时,sCPP在1周时的曲线下面积(area under the curve,AUC)为 0.908(95% CI为0.789~1.028),以56.59 ng/L为阈值,其诊断敏感性为87.5%,特异性为80.0%。而sCPP在3周及 uCPP 与BNP在1和3周的检测结果显示,在相应的阈值下的AUC及其诊断敏感性与特异性均低,无诊断价值,见图1、表5。
Figure 1. ROC curves of serum CPP (sCPP), urinary CPP (uCPP) and BNP in the diagnosis of CRS. A: at 1 week, the areas under the curve (AUC) of sCPP, uCPP and BNP were 0.908, 0.475 and 0.617, respectively. B: at 3 weeks, the AUC of sCPP, uCPP and BNP were 0.489, 0.422 and 0.489, respectively.
图1血清CPP及尿液CPP与BNP诊断CRS的ROC曲线

表5 血清及尿液CPP与BNP诊断CRS的ROC曲线分析
5各组大鼠心和肾的组织病理学改变
心脏组织 HE 染色显示,CK组未见明显的病理改变,SNX组、MI组和CRS组均见心肌组织紊乱,少数心肌变性、溶解及断裂,毛细血管充血、扩张,以CRS组最为明显,见图2A。肾脏 HE 染色显示,CK组无明显病理改变,SNX组和MI组可见轻度损伤,CRS组最为严重,见图2B。
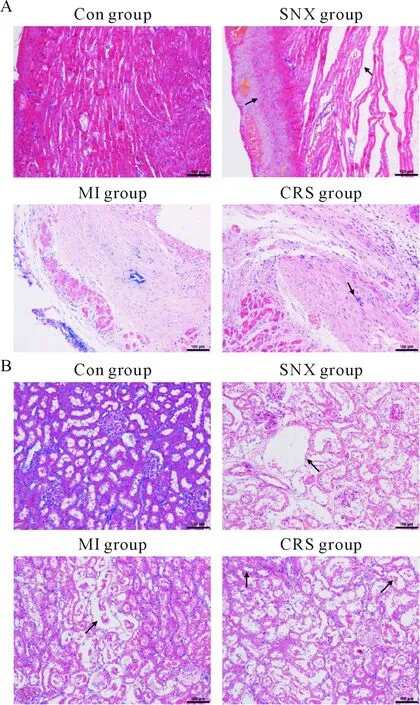
Figure 2. Pathological changes of the cardiac (A) and renal (B) tissues in each group at 5 weeks (HE staining, ×200).
图2各组大鼠第5周时心和肾的组织病理学改变
讨 论
本研究证实,SNX+MI的合并术式加重脏器损伤,可用于建立CRS大鼠模型。该模型能体现心肾的双向互动作用,可以用来评估CRS的诊疗效应。通过造模后1~5周动态观察血清及尿液中CPP浓度的变化,证实检测CRS大鼠血清CPP水平有助于早期发现心肾并损程度,从而起到预警作用。CPP可以作为CRS早期诊断的潜在生物标志物,具有较高的敏感性和特异性。
近来随着CRS概念的提出,心肾疾病之间的关系已被广泛关注,临床上进一步的研究迫切需要稳定可靠的动物模型。CRS的大鼠模型最早始于2004年,采用心肌梗死术合并单侧肾切除术,但该模型未观察出心功能伴随肾功能减退的进行性损伤[6]。而本文采用的SNX+MI方法由Entin-Meer等[7]在CRS模型研究中创建,通过部分肾切除术合并心肌梗死术造模显示出其优势,能体现心肾的双向互动作用。本项目中,我们采用大鼠造模后1~5周血液动力学、血压及肾功能指标的动态观察,发现造模后1周即出现心肾功能的减退,提示大鼠在较短时间内实现心肾功能的共损和互损,因而该模型能高度模拟临床CRS的病变特点,可为CRS 的病理生理机制与药物研究提供动物实验方法。部分肾切除术后肾功能已有损伤的大鼠,其心肌更容易缺血损伤,尿毒症大鼠的心肌梗死面积明显增加,这与临床上肾脏疾病患者并发心梗死亡率更高的特点一致。由于部分肾切除,肾分泌的红细胞生成素减少,血氧容量下降,心脏射血加剧,心脏及各组织器官回血量增加,血管收缩,加重心肌肥厚,并引发血压升高,内皮损伤导致冠脉营养功能下降,加重心肌缺血。同时,心脏功能障碍反过来会加速肾脏固有损伤[8]。
CRS的发生会伴有不同的生物学标志物的相应改变,对其早期诊断、危险评估、判断预后有重要意义。因容量负荷及钠潴留,心钠素(atrial natriuretic peptide,ANP)、AVP)原和肾素-血管紧张素系统(renin-angiotensin system,RAS)的不适当激活,CRS导致机体水代谢紊乱更为突出。其中AVP系统可能是除RAS和交感神经系统以外,另一个与急性心肌梗死(acute myocardial infarction,AMI)或心力衰竭预后不良密切相关的神经内分泌系统[9]。CPP检测方便易行,结果稳定,可在各级医院开展,可取代对AVP的直接测量。本项目在造模后1~5周动态检测血清和尿液中CPP浓度的变化,发现CRS组在造模后1 周和3周血清和尿液中CPP显著升高,造模后5周仅血清中升高,ROC曲线分析显示造模后1周血清CPP预测CRS具有较高的特异性(87.5%)和敏感性(80%),提示CPP在心肾损伤早期有变化,晚期趋于平稳,有望为CRS早期诊断提供一种新的较好的生物标志物,具有广阔的应用前景。实际上,新近CPP已被证明在多种临床疾病预测的价值,主要包括心血管疾病,如心脏衰竭、心肌梗死等[4, 10-11]。而肾脏疾病的相关报道甚少,仅见Kim等[12]证实CPP可以作为血液透析患者左心室功能障碍诊断的有用指标,ROC分析显示,AUC为0.737,临界值为125.48 ng/L,敏感性和特异性分别为0.7和0.8;但也有相反的结论,认为CPP对慢性肾脏病患者血管外科围手术期心血管并发事件的风险预测潜力不足[13],或者新生儿与围产期窒息动物模型中,CPP不能作为诊断急性肾损伤的特异标志物[14]。本文进一步的相关分析显示,血清与尿液中的CPP与BNP和BUN均不具备相关性,可能与CRS的复杂病理生理机制有关,BNP在临床上公认是心力衰竭临床诊断性标志,尽管有报道认为在CRS的早期诊断中有一定的应用价值[2, 15],但在CRS患者体内是否会因为心衰或肾小球滤过率下降而在体内蓄积引起,以及对肾功能不全的诊断价值等方面,有待进一步研究[16]。
[1] Bongartz LG, Braam B, Gaillard CA, et al. Target organ cross talk in cardiorenal syndrome: animal models[J]. Am J Physiol Renal Physiol, 2012, 303(9):F1253-F1263.
[2] 徐建国, 徐 敏, 李 钰, 等. 氨基末端B型利钠肽前体联合胱抑素C在1型心肾综合征早期诊断中的应用价值[J]. 中华急诊医学杂志, 2015, 24(5):518-523.
[3] Niizuma S, Iwanaga Y, Yahata T, et al. Renocardiovascular biomarkers: from the perspective of managing chro-nic kidney disease and cardiovascular disease[J]. Front Cardiovasc Med, 2017, 4:10.
[4] Morawiec B, Kawecki D. Copeptin: a new marker in cardiology[J]. J Cardiovasc Med (Hagerstown), 2013, 14(1):19-25.
[5] Windt WA, Henning RH, Kluppel AC, et al. Myocardial infarction does not further impair renal damage in 5/6 nephrectomized rats[J]. Nephrol Dial Transplant, 2008, 23(10):3103-3110.
[6] van Dokkum RP, Eijkelkamp WB, Kluppel AC, et al. Myocardial infarction enhances progressive renal damage in an experimental model for cardio-renal interaction[J]. J Am Soc Nephrol, 2004, 15(12):3103-3110.
[7] Entin-Meer M, Ben-Shoshan J, Maysel-Auslender S, et al. Accelerated renal fibrosis in cardiorenal syndrome is associated with long-term increase in urine neutrophil gelatinase-associated lipocalin levels[J]. Am J Nephrol, 2012, 36(2):190-200.
[8] Liu S, Kompa AR, Kumfu S, et al. Subtotal nephrectomy accelerates pathological cardiac remodeling post-myocardial infarction: implications for cardiorenal syndrome[J]. Int J Cardiol, 2013, 168(3):1866-1880.
[9] Lipinski MJ, Escárcega RO, D’Ascenzo F, et al. A systematic review and collaborative meta-analysis to determine the incremental value of copeptin for rapid rule-out of acute myocardial infarction[J]. Am J Cardiol, 2014, 113(9):1581-1591.
[10] Boeckel JN, Oppermann J, Anadol R, et al. Analyzing the release of copeptin from the heart in acute myocardial infarction using a transcoronary gradient model[J]. Sci Rep, 2016, 6:20812.
[11] 陈 学,龙 静,韩朝辉,等. 和肽素脑钠肽及高敏肌钙蛋白T在急性心肌梗死中的早期诊断价值[J]. 中国急救医学, 2016, 36(7):634-638.
[12] Kim JS, Yang JW, Chai MH, et al. Copeptin in hemo-dialysis patients with left ventricular dysfunction[J]. Yonsei Med J, 2015, 56(4):976-980.
[13] Schrimpf C, Gillmann HJ, Sahlmann B, et al. Renal function interferes with copeptin in prediction of major adverse cardiac events in patients undergoing vascular surgery[J]. PLoS One, 2015, 10(4):e0123093.
[14] Baumert M, Surmiak P, Więcek A, et al. Serum NGAL and copeptin levels as predictors of acute kidney injury in asphyxiated neonates[J]. Clin Exp Nephrol, 2017, 21(4):658-664.
[15] 李晓慧, 黄海燕. 尿微量蛋白和 BNP 联合诊断心肾综合征的意义[J]. 现代检验医学杂志, 2015, (3):136-138.
[16] Santos-Araújo C, Leite-Moreira A, Pestana M. Clinical value of natriureticpeptides in chronic kidney disease[J]. Nefrologia, 2015, 35(3):227-233.
