短链酰基辅酶A脱氢酶在高血压血管重构中的作用*
2018-03-01李忠洪舒朝辉廖英勤刘培庆王桂香潘雪刁臧林泉周四桂
李忠洪, 舒朝辉, 廖英勤, 刘培庆, 路 静, 王 平, 王桂香 , 潘雪刁, 兰 天, 臧林泉, 周四桂△
(1广东药科大学临床药学系, 2中山大学药学院药理与毒理学实验室, 广东 广州 510006; 3深圳市药品检验研究院, 广东 深圳518029)
高血压(hypertension)是最常见的心脑血管疾病之一,是引起心脏、血管、大脑和肾脏等器官结构和功能发生病变的主要诱因。高血压血管重构(vascular remodeling)是指高血压引起血管结构和功能的改变,主要包括血管壁增厚和血管壁腔比值增高等特征,随之产生血管功能异常[1],可导致高血压、动脉粥样硬化、脑卒中和循环功能紊乱等多种疾病。血管重构是高血压等疾病的病理基础,其发生机制复杂,活性氧簇(reactive oxygen species,ROS)在体内蓄积引起的氧化损伤是导致血管重构的重要因素[2]。有研究表明,ROS的水平与体内游离脂肪酸的变化密切相关,游离脂肪酸增加时ROS随之增加[3]。
短链酰基辅酶A脱氢酶(short-chain acyl-CoA dehydrogenase,SCAD)是酰基辅酶A脱氢酶家族中的一员,是脂肪酸氧化的关键酶,能特异性地分解短链酰基辅酶A底物,是脂肪酸β氧化的第一个限速步骤[4]。在前期研究中,我们采用定量蛋白质组学技术对16周龄自发性高血压大鼠(spontaneously hypertensive rats,SHR)和血压正常的Wistar-Kyoto(WKY)大鼠心肌蛋白质进行比较,首次发现SCAD在SHR肥厚心肌中的表达明显降低[5]。进一步研究发现,SCAD 对病理性心肌肥厚和心肌细胞凋亡具有负性调控作用[6-7]。然而,SCAD 在高血压血管重构中的作用尚不清楚。
本研究采用SHR作为高血压模型,观察SCAD在高血压血管重构中的变化,探讨游泳(swim)运动训练对血管重构的影响,以期为高血压血管重构寻找新的分子标志物,并为血管重构防治寻找新的药物作用靶点。
材 料 和 方 法
1材料
1.2实验动物 16只健康雄性15周龄Wistar大鼠购于南方医科大学动物实验中心,许可证编号为SCXK(粤)2016-0041(No.44002100010357);16只雄性15周龄SHR购于北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2012-0001(No.11400700187880)。实验分为: (1)正常(Wistar)组:8只雄性15周龄Wistar大鼠正常饲养9周;(2)正常游泳(Wistar+swim)组:8只雄性15周龄Wistar大鼠试游泳运动1周后进行游泳耐力训练,试游泳运动阶段的时间从第1天的15 min逐渐增加到第5天的60 min,从第2周开始每天上午9时持续游泳60 min,每周进行6次游泳训练,游泳池体积和水深分别为100 cm×60 cm×60 cm和50 cm,水温控制到30 ℃~35 ℃,维持此运动量8周;(3)SHR组:8只雄性15周龄自发性高血压正常饲养大鼠9周;(4)SHR游泳(SHR+swim)组:8只雄性15周龄自发性高血压大鼠,试游泳运动1周后进行游泳耐力训练8周,游泳耐力训练方法同正常游泳组。
2方法
2.1鼠尾收缩压的测定 利用大鼠尾动脉间接测量法测定各组大鼠尾动脉收缩压,每隔2周测定一次,直至第9周结束,所用大鼠无创血压仪(CODA Monitor)购于Kent。
2.2血清和主动脉游离脂肪酸含量的测定 戊巴比妥钠(45 mg/kg)麻醉动物后,开腹腔暴露腹主动脉,立即用真空采血管于腹主动脉取血大约5 mL,3 500 r/min离心10 min,小心收集血清并分装至EP管中,-80 ℃超低温冰箱保存血清。取血后用预冷的生理盐水充分灌注心脏,迅速分离大鼠主动脉组织,剥离主动脉周围多余脂肪组织,生理盐水清洗干净,液氮速冻后-80 ℃保存,以备进行后续游离脂肪酸含量测定。严格按照游离脂肪酸测定试剂盒说明书进行血清和主动脉游离脂肪酸含量测定,根据吸光度(A)值计算血清和主动脉中游离脂肪酸的含量。
2.3ROS含量测定 采用二氢乙啶(dihydroethi-dium,DHE)染色法检测ROS水平。DHE可自由通过活细胞膜进入细胞内,并被细胞内的ROS氧化,形成氧化乙啶;氧化乙啶可进一步掺入染色体DNA中,产生红色荧光。根据活细胞中红色荧光的水平,可以判断细胞内ROS含量的多少和变化。取血后用预冷的生理盐水充分灌注心脏,迅速分离大鼠主动脉组织,剥离主动脉周围多余脂肪组织,并用生理盐水清洗干净,取一部分液氮速冻后-80 ℃保存进行后续实验,剩余部分冰冻切片,采用DHE染色,荧光显微镜观察并拍摄图像,分析ROS在胸主动脉的产生情况。
2.4主动脉形态学研究 取血后用预冷的生理盐水充分灌注心脏,迅速分离大鼠主动脉组织,剥离主动脉周围多余脂肪组织,并用生理盐水清洗干净,置于4%多聚甲醛中固定,石蜡包埋后切片,利用HE染色进行后续的主动脉形态学分析,在光学显微镜下通过图像分析仪测量管腔内径和血管壁中层厚度,计算中层厚度与管腔直径比值。
宽带通用接收机设计中,原理架构设计是设计的关键,它关系到宽带接收系统的抗干扰性能及系统的设计难易程度,需要在各项指标间均衡。对于跨越多个倍频程宽带接收机,本文给出了一种分段折叠多中频混频的方案,其电路框架结构如图1所示。
2.5Real-time PCR检测主动脉SCAD的mRNA表达 严格按照Trizol 试剂盒说明书提取主动脉组织中总RNA,260 nm和280 nm波长下紫外分光光度计测定RNA样品A值,检测RNA纯度并计算出RNA浓度。参照RT-PCR试剂盒说明书进行逆转录反应,两步法进行PCR扩增反应,按照SYBR Green 说明书反应体系加入荧光染料、引物和cDNA后在Bio-Rad CFX96 PCR仪中进行real-time PCR反应。反应程序为:95 ℃ 10 s, 95 ℃ 5 s,, 60 ℃ 30 s,循环40次。采用2-ΔΔCt方法计算结果,实验重复3次。引物由上海生工合成,SCAD的上游引物序列为5’-CCAGTCTGTGGAACTACCTGAG-3’,下游引物序列为5’-CCCTTCTTCTTCACCTGCGA-3’;内参照GAPDH的上游引物序列为5’-AGGAGTAAGAAACCCTGGAC-3’,下游引物序列为5’-CTGGGATGGAATTGTGAG-3’。
2.6Western blot法检测SCAD蛋白表达 提取各组主动脉组织总蛋白,利用BCA试剂盒检测蛋白含量,定量后以适当浓度分装并置于-20 ℃备用。分离胶和浓缩胶的浓度分别为10%和5%,配胶后进行电泳,电泳后将蛋白转膜至PVDF膜(Bio-Rad),之后用BSA封闭2 h,加入Ⅰ抗(SCAD,1∶1 000)4 ℃冰箱过夜, 漂洗后加入对应的Ⅱ抗室温条件下孵育1 h,化学发光试剂孵育适当时间,压片、曝光、显影、定影,结果采用ImageJ图像分析系统对条带进行分析,实验重复3次。
2.7SCAD酶活性检测 SCAD酶活性的检测严格按照SCAD活性比色法定量测定试剂盒说明书进行,裂解主动脉组织,以BCA蛋白试剂盒定量上清液蛋白,采用酶标仪测定法检测主动脉中SCAD酶活性。
2.8ATP含量测定 严格按照试剂盒说明书测定ATP含量。ATP检测试剂盒根据萤火虫萤光素酶(firefly luciferase)催化萤光素发光时需要ATP提供能量的原理, 当萤火虫萤光素酶和萤光素都过量时,在一定的浓度范围内发光的强度和ATP的浓度成正比,可以高灵敏地检测溶液中的ATP浓度。
3统计学处理
采用SPSS 13.0统计软件处理,数据以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,运用Bonferronit检验进行组间两两比较,以P<0.05为差异有统计学意义。
结 果
1各组大鼠收缩压的变化
与正常组相比,SHR组大鼠的血压明显升高(P<0.01);经过游泳训练8周后,与SHR组相比,SHR游泳组血压明显降低,差异具有统计学显著性(P<0.01),见图1。
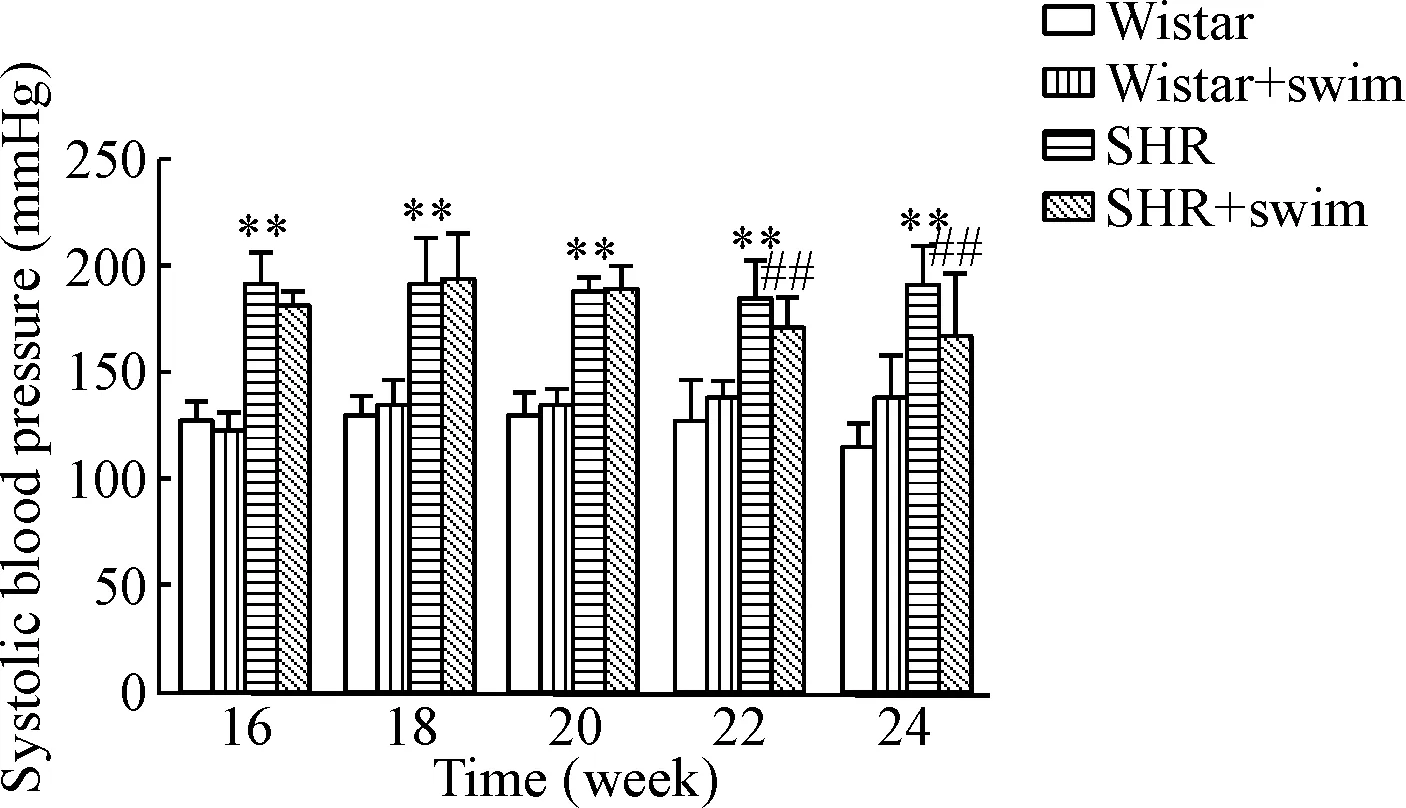
Figure 1. The systolic blood pressure of the rats at different weeks. Mean±SD.n=8.**P<0.01vsWistar group;##P<0.01vsSHR group.
图1各组大鼠血压的变化
2各组大鼠主动脉形态学的变化
与正常组相比,SHR组血管中层厚度明显增大,血管腔直径明显减小,血管中层厚度与血管腔比值明显增加(P<0.01),血管纤维排列紊乱,分层不清且出现断裂等现象,血管内膜增生脱落明显,血管内膜光滑程度明显下降;然而,SHR通过游泳运动训练8周后,大鼠血管中层厚度明显减小,血管腔直径明显增加,血管中层厚度与血管腔直径比值明显减小(P<0.01),血管内膜增生脱落减少,血管内膜不光滑程度减轻。以上结果表明,持续游泳运动训练可以明显改善高血压引起的血管重构,见图2。

Figure 2. The histopathological examination of the aorta in each group (HE staining). Mean±SD.n=6.*P<0.05,**P<0.01vsWistar group;##P<0.01vsSHR group.
图2各组大鼠胸主动脉形态学变化
3各组大鼠主动脉SCAD的mRNA和蛋白水平及SCAD酶活性的变化
与Wistar大鼠相比,运动组大鼠主动脉SCAD的mRNA 和蛋白表达均明显上调,SCAD酶活性增加(P<0.05);而SHR组主动脉SCAD的mRNA和蛋白表达均明显下调,SCAD酶活性下降(P<0.01)。此外,与SHR组相比,SHR通过游泳训练8周后,主动脉SCAD的mRNA和蛋白表达均明显上调,SCAD酶活性增加(P<0.01)。以上结果表明,SCAD 表达下调可能与高血压血管重构的发生发展密切相关, 游泳运动训练可能通过上调SCAD的表达,从而改善高血压血管重构,见图3。
4各组大鼠主动脉ATP和游离脂肪酸含量的变化
与Wistar组相比,游泳运动组大鼠主动脉ATP含量显著增高,血清和主动脉游离脂肪酸含量明显减少(P<0.05);而SHR组主动脉ATP含量显著降低,血清和主动脉游离脂肪酸含量明显增加(P<0.05或P<0.01)。与SHR组相比,SHR游泳组大鼠主动脉的ATP含量显著增高,血清和主动脉的游离脂肪酸含量明显减少(P<0.01)。表明运动组大鼠主动脉SCAD 蛋白的表达及酶活性的增加可能导致了主动脉脂肪酸β 氧化能力增强,从而引起ATP合成增加,血清和主动脉游离脂肪酸含量减少;而SHR组主动脉SCAD 蛋白表达及酶活性的下降,可能导致了主动脉脂肪酸β 氧化能力下降,从而引起ATP合成减少,血清和主动脉游离脂肪酸含量增加,见图4。
5各组大鼠主动脉ROS含量的变化
DHE染色法检测ROS在主动脉的变化情况,红色荧光代表ROS水平,绿色荧光代表动脉弹性纤维的自发荧光。与正常组相比,SHR组主动脉的红色荧光明显增强,平均荧光强度增加,表明SHR组高游离脂肪酸刺激引起主动脉的ROS生成增加;与SHR组相比,SHR游泳组主动脉的红色荧光明显减弱,平均荧光强度降低,表明游泳运动训练通过降低游离脂肪酸含量,从而减少ROS的产生,见图5。

Figure 3. The activity (A), and mRNA (B) and protein (C) expression levels of SCAD in the aorta. Mean±SD.n=3.*P<0.05,**P<0.01vsWistar group;##P<0.01vsSHR group.
图3各组大鼠胸主动脉SCAD的mRNA和蛋白表达及SCAD酶活性变化
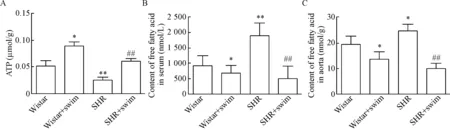
Figure 4. The contents of ATP in the aorta (A) and free fatty acid in the serum (B) and aorta (C). Mean±SD.n=3.*P<0.05,**P<0.01vsWistar group;##P<0.01vsSHR group.
图4各组大鼠胸主动脉中ATP及胸主动脉和血清中游离脂肪酸含量
讨 论
高血压是严重危害人类健康的常见心血管疾病之一,可引起血管结构和功能的改变,即高血压血管重构,促进高血压进展和心血管致残率和死亡率升髙。目前,对于髙血压血管重构的发病机制仍不明确,如何预防与逆转血管重构,已成为目前抗髙血压治疗及预防高血压并发症的重要课题。Dzau等[8]将血管重构分为血管壁(包括内膜和中膜)增厚、血管腔内径减小、血管壁厚度与血管腔直径比值增大等4种类型。高血压导致的血管内膜受损、中膜厚度和外膜基质成分的重新排列都是血管重构发生的重要因素,也是维持和促进血管重构进一步发展的主要机制之一[9]。

Figure 5. The ROS production assessed by staining with dihydroethidium in fresh frozen section of aorta (×200). Mean±SD.n=3.**P<0.01vsWistar group;##P<0.01vsSHR group.
图5各组大鼠主动脉ROS含量的变化
氧化应激是由于氧自由基过量生成或细胞内抗氧化防御系统受损,导致氧自由基及其相关代谢产物过量聚集,从而对细胞产生多种毒性作用的病理状态。氧化应激与多种疾病密切相关,包括癌症、心血管疾病、糖尿病和神经系统疾病等[10]。血管和心脏组织是ROS的丰富来源,血管氧化应激是高血压血管重构的主要病理机制之一[11-12]。多种器官如心、肾和血管(血管内皮细胞、平滑肌细胞和血管外膜)均能生成ROS。病理情况下,ROS过多或抗氧化能力降低,使得ROS大量蓄积而引起氧化损伤,可损害血管内皮细胞,导致血管内皮细胞功能障碍和顺应性降低等血管功能及结构发生改变,最终促进了高血压的发生和发展[13-14]。有研究证实,ROS过量蓄积的原因之一是沉积于细胞内的游离脂肪酸以一种特殊的方式进入线粒体,以该方式进入线粒体的游离脂肪酸不能以正常的方式进行代谢提供能量,其氧化产物为阴离子,因不能转移出线粒体膜,破坏了线粒体内部的电梯度,影响线粒体呼吸链中的电子传递,使机体活性氧生成增加[15]。
大量证据表明,有氧运动是目前预防和治疗高血压病最有效的一种非药物疗法。有氧运动能够降低血压,改善高血压的风险因素,特别是对于血压正常高值人群和高血压患者[16]。有氧运动可有效地减少ROS 水平,降低ROS 相关疾病的发生[17]。
在本研究中,我们以24周龄的SHR和正常Wistar大鼠、持续游泳运动训练8周的24周龄SHR及Wistar大鼠作为研究对象,通过主动脉形态学变化观察血压变化与血管重构之间的关系。结果发现,血压变化与血管形态变化密切相关,通过持续运动可以一定程度地逆转血压升高和血管形态学的变化。SHR主动脉血管中层厚度增加,血管腔直径减小,血管内膜增生脱落不光滑,血管纤维排列紊乱,血管分层不清晰,都可能是导致血压升高的原因;然而,通过游泳训练16周龄的SHR大鼠8周之后,SHR大鼠血压明显下降,血管形态明显得到改善,血管中膜厚度减小,血管腔直径增加,血管内膜趋于光滑,内膜增生脱落现象明显得到改善。因此,高血压与血管重构密不可分,高血压会导致血管重构,同时,血管重构也是导致高血压进展的重要因素之一。此外,通过运动训练可以改善高血压及其血管重构现象。
SCAD作为脂肪酸氧化的关键酶,参与脂肪酸β氧化的第一步脱氢过程,是酰基辅酶A脱氢酶家族中的重要成员之一[18]。我们通过前期的研究发现,在生理性和病理性心肌肥厚中,SCAD呈现不一致的变化趋势。由于高血压与血管重构的发生密切相关,而SCAD是否参与高血压血管重构尚未见报道。因此,我们进一步探讨了SCAD在高血压血管重构中的作用。
本研究中,运动组大鼠主动脉SCAD的mRNA 和蛋白表达及酶活性均明显增加,而SHR组主动脉的SCAD的mRNA 和蛋白表达及酶活性均明显减少,二者之间差异具有统计学显著性。SCAD 在高血压血管重构组和运动组大鼠主动脉中的表达呈现出不一致的变化趋势,表明SCAD 表达失调可能与高血压血管重构的发生发展密切相关。同时,高血压大鼠组主动脉的ATP含量下降,血清和主动脉游离脂肪酸含量明显增加,ROS生成增多,表明自发性高血压大鼠主动脉SCAD蛋白表达及酶活性的下降,可能导致了主动脉脂肪酸β 氧化能力下降,脂肪酸利用减少,从而引起游离脂肪酸含量的增加。大量游离脂肪酸刺激的后果是ROS生成增多,从而启动了氧化应激机制,导致高血压血管重构的发生。此外,SHR通过游泳训练8周后,高血压血管重构得到明显改善,主动脉的SCAD mRNA和蛋白表达均明显上调,SCAD酶活性增加。主动脉ATP含量生成增加,血清和主动脉游离脂肪酸含量明显减少,ROS生成降低。以上结果表明,游泳运动训练可能通过上调SHR组大鼠主动脉的SCAD 蛋白表达及其酶活性,增强主动脉脂肪酸β 氧化水平,引起ATP合成增加,血清和主动脉游离脂肪酸含量减少,ROS生成降低,减轻氧化应激对主动脉的损伤,从而改善高血压血管重构。
综上所述,SCAD的表达下调在高血压血管重构中可能发挥了至关重要的作用,为我们进一步研究SCAD与高血压血管重构之间的关系奠定了基础。然而,SCAD的表达失调在高血压血管重构中的具体作用机制还有待进一步研究。
[1] 林忠伟, 王 卓, 李瑞莹, 等. 血清Fibulin-3水平与脉搏波传导速度在高血压血管重构中的作用[J]. 实用医学杂志, 2015, 31(5):743-745.
[2] 葛良清, 石端正, 张国刚. NADPH 氧化酶家族与高血压血管重构[J]. 国际病理科学与临床杂志, 2013, 33(5):442-448.
[3] 马诗玥, 钮晋红. 血清游离脂肪酸测定与冠状动脉硬化相关性的研究[J]. 中国医药指南, 2016, 14(29):20-21.
[4] 舒朝辉, 曾振华, 黄秋菊, 等. 短链酰基辅酶A脱氢酶在心脏成纤维细胞胶原表达和细胞增殖中的作用[J]. 中国病理生理杂志, 2017, 32(12):2184-2191.
[5] 黄金贤, 罗佳妮, 刘培庆, 等. AMPK/PPARα/SCAD信号途径对心肌肥大的调控研究[J]. 中国病理生理杂志, 2014, 30(5):769-778.
[6] 周四桂, 王 平, 路 遥, 等. 短链酰基辅酶A脱氢酶在大鼠生理性和病理性心肌肥大中的作用[J]. 中国病理生理杂志, 2012, 28(11):1921-1927.
[7] Zeng Z, Huang Q, Shu Z, et al. Effects of short-chain acyl-coA dehydrogenase on cardiomyocyte apoptosis [J].J Cell Mol Med, 2016, 20(7):1381-1391.
[8] Dzau VJ, Gibbon GH, Morishita R, et al. New perspectives in hypertension research. Potentials of vascular biology[J]. Hypertension, 1994, 23(6 Pt 2):1132-1140.
[9] 文绍勋, 尹雪艳. 高血压血管重构研究进展[J]. 医学信息, 2015, 28(12):344-345.
[10] Jomova K, Valko M. Advances in metal-induced oxidative stress and human disease[J]. Toxicology, 2011, 283(2-3):65-87.
[11] Montezano AC, Tsiropoulou S, Dulak-Lis M, et al. Rodox signaling, Nox5 and vascular remodeling in hypertension[J]. Curr Opin Nephrol Hypertens, 2015, 24(5):425-433.
[12] Martinez AA, Herrador MSA, Alonso AMB, et al. Reactive oxygen species and vascular remodeling in cardiovascular diseases[J]. An Real Acad Nac Farm, 2015, 81(2):129-144.
[13] Montezano AC, Dulak-Lis M, Tsiropoulou S, et al. Oxidative stress and human hypertension: vascular mechanisms, biomerkers, and novel therapies[J]. Can J Car-diol, 2015, 31(5):631-641.
[14] Cave AC, Brewer AC, Panicker AN, et al. NADPH oxidases in cardiovascular health and disease[J]. Antioxid Redox Signal, 2006, 8(5-6):691-727.
[15] Goglia F, Skulachev VP. A function for novel uncoupling proteins: antioxidant defense of mitochondrial matrix by translocating fatty acid peroxides from the inner to the ou-ter membrane leaflet[J]. FASEB J, 2003, 17(12):1585-1591.
[16] Korsager Larsen M, Matchkov VV. Hypertension and physical exercise: the role of oxidative stress[J]. Medicina, 2016, 52(1):19-27.
[17] Roque FR, Briones AM, García-Redondo AB, et al. Ae-robic exercise reduces oxidative stress and improves vascular changes of small mesenteric and coronary arteries in hypertension[J]. Br J Pharmacol, 2013, 168(3):686-703.
[18] 黄秋菊, 黄金贤, 罗佳妮, 等. ERK1/2/PPARα/SCAD 信号途径对生理性和病理性心机肥大的调控[J]. 中国病理生理杂志, 2014, 30(8):1427-1432.
