吴茱萸碱抑制Huh7细胞生长并增强细胞对TRAIL的敏感性*
2018-03-01张庆然周昭伶潘振海马亚鹏马志强费洪荣
张庆然, 周昭伶, 潘振海, 马亚鹏, 马志强, 费洪荣
(泰山医学院药学院, 山东 泰安 271016)
吴茱萸又称吴萸或曲药子,为芸香科吴茱萸[Euodiarutaecarpa(Juss.) Benth.]或疏毛吴茱萸[E.rutaecarpaBenth. var.bodinieri(Dode) Huang]的干燥近成熟果实,具有抗炎、抑菌和抗肿瘤等活性[1]。吴茱萸碱(evodiamine,Evo)是吴茱萸中的主要活性成分,属于色胺吲哚类生物碱,具有抗炎镇痛、降血糖和免疫增强等活性,能够调控包括肺癌细胞A549和肝癌细胞HepG2等多种肿瘤细胞的增殖与凋亡[2-4]。本研究以肝癌细胞株Huh7为研究对象,观察吴茱萸碱对Huh7细胞的活力与凋亡的影响,确定吴茱萸碱协同促进肿瘤坏死因子凋亡诱导配体(tumors necrosis factor-related apoptosis-inducing ligand,TRAIL)的抗肿瘤活性,并初步阐明其内在的分子机制,为其临床应用提供理论依据。
材 料 和 方 法
1实验材料
吴茱萸碱购自北京百灵威科技有限公司;胎牛血清购自Gibco;MTT和抗β-actin抗体购自Sigma;DNA片段末端标记法(TUNEL)凋亡检测试剂盒购自Roche;ECL化学发光试剂盒购自Merck Millipore;抗p-细胞分裂周期蛋白2(cell division cycle protein 2, Cdc2)、caspase-3、多聚ADP核糖聚合酶[poly (ADP-ribose) polymerase, PARP]和死亡受体5(death receptor 5,DR5)抗体购自Cell Signaling Technology;抗p27抗体购自BD Biosciences;抗cyclin B1、Cdc2和DR4抗体购自Santa Cruz;II抗均购自北京中杉金桥生物技术有限公司;重组人TRAIL蛋白购自R&D Systems。
2实验方法
2.1细胞培养 人肝癌细胞Huh7购自中国科学院上海生命科学研究院细胞资源中心,在含10% 胎牛血清的DMEM培养基中,5% CO2、37 ℃条件下常规培养。
2.2MTT法检测细胞活力 接种Huh7细胞于96 孔板中,24 h后加入不同剂量的吴茱萸碱,对照组加入DMSO;终止培养前4 h加20 μL 5 g/L的 MTT 于各孔中,然后吸去孔中的培养液,再加入150 μL 的DMSO,室温振荡10 min;用酶标仪(波长490 nm)测定各孔的吸光度(A)值,以同样的方法测6个平行孔,计算细胞活力抑制率。
2.3流式细胞术分析细胞周期分布 Huh7细胞经吴茱萸碱(0、0.5、1和5 mg/L)处理24 h后,胰酶消化并制备单细胞悬液,然后用75% 的冷无水乙醇 4 ℃固定过夜。离心除去乙醇后,细胞加入RNase A并于37 ℃孵育30 min;加入碘化丙啶室温染色15 min;最后用流式细胞仪检测细胞周期。
2.4TUNEL法检测细胞凋亡 Huh7细胞经吴茱萸碱(0、1和5 mg/L)作用24 h后,PBS洗涤细胞3次,于4 ℃固定细胞1 h,0.2% Triton X-100 打孔2 min。然后按照TUNEL凋亡检测试剂盒说明书对细胞进行凋亡染色,倒置荧光显微镜观察细胞的TUNEL染色结果,并对结果进行统计分析。
2.5Western blot实验 Huh7细胞经吴茱萸碱作用24 h,用含有蛋白酶抑制剂的 RIPA 裂解液冰上裂解20 min,4 ℃、13 000×g离心 20 min,收集上清定量分析。取30~40 μg总蛋白进行 SDS-PAGE,电转移至硝酸纤维素膜上,5%脱脂奶粉封闭过夜。加入I抗室温孵育3 h后,加入II抗室温孵育1 h;最后用ECL显色试剂盒曝光显影。实验重复3次。
3统计学处理
采用SPSS 18.0 软件分析,数据用均数±标准差(mean±SD)表示,多组数据比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05 为差异有统计学意义。
结 果
1吴茱萸碱抑制Huh7细胞活力
肝癌细胞Huh7经不同浓度的吴茱萸碱处理24 h后,MTT法检测细胞活力。结果表明,与对照组相比,吴茱萸碱可明显抑制Huh7细胞活力(P<0.05),见图1。
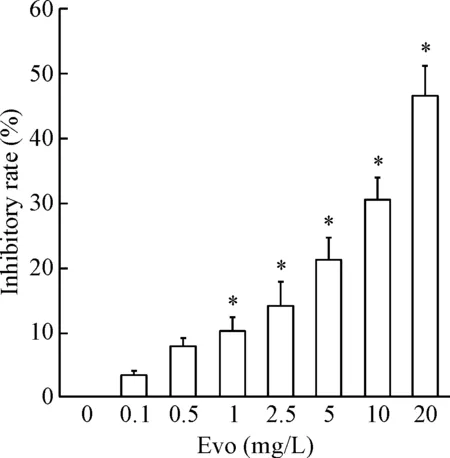
Figure 1. Evodiamine (Evo) inhibited the viability of Huh7 cells. Mean±SD.n=3.*P<0.05vs0 mg/L group.
图1吴茱萸碱抑制肝癌细胞Huh7活力
2吴茱萸碱诱导Huh7细胞阻滞于G2/M期
用流式细胞术检测吴茱萸碱对Huh7细胞周期的影响。从图2和表1可以看出,与对照组比较,Huh7细胞经吴茱萸碱作用24 h后,处于G2/M期的细胞数量明显增多,而G1期和S期的细胞数目则相应减少(P<0.05),表明吴茱萸碱阻滞Huh7细胞于G2/M期,进而抑制Huh7细胞生长。
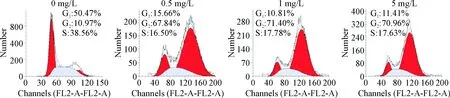
Figure 2. The effect of evodiamine on the cell cycle distribution of Huh7 cells.
图2吴茱萸碱对Huh7细胞周期的影响
表1吴茱萸碱对Huh7细胞周期分布的影响
Table 1. After exposure to evodiamine (Evo) for 24 h, the cell cycle distribution of Huh7 cells was determined by flow cytometry analysis (%. Mean±SD.n=3)
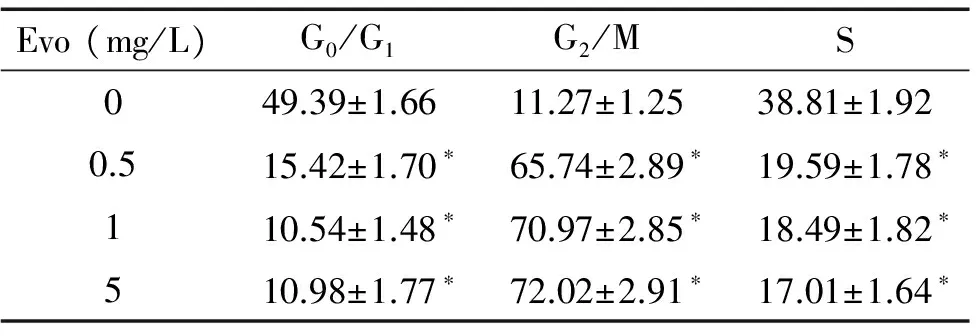
Evo(mg/L)G0/G1G2/MS049.39±1.6611.27±1.2538.81±1.920.515.42±1.70∗65.74±2.89∗19.59±1.78∗110.54±1.48∗70.97±2.85∗18.49±1.82∗510.98±1.77∗72.02±2.91∗17.01±1.64∗
*P<0.05vs0 mg/L group.
为进一步阐明吴茱萸碱诱导细胞周期阻滞的分子机制,本研究采用Western blot实验检测细胞周期相关蛋白的表达,结果表明,Huh7细胞经吴茱萸碱处理24 h后,与对照组比较,p27、Cdc2、p-Cdc2和cyclin B1的蛋白水平均明显升高(P<0.05),见图3。
3吴茱萸碱诱导Huh7细胞发生凋亡
TUNEL染色法检测了吴茱萸碱对 Huh7细胞凋亡的影响。结果表明,与对照组相比,经吴茱萸碱作用24 h后,凋亡细胞的数量明显增加,见图4。

Figure 3. The effect of evodiamine (Evo) on the expression levels of cell cycle-related proteins. Mean±SD.n=3.*P<0.05vs0 mg/L group.
图3吴茱萸碱对Huh7细胞周期相关蛋白表达水平的影响
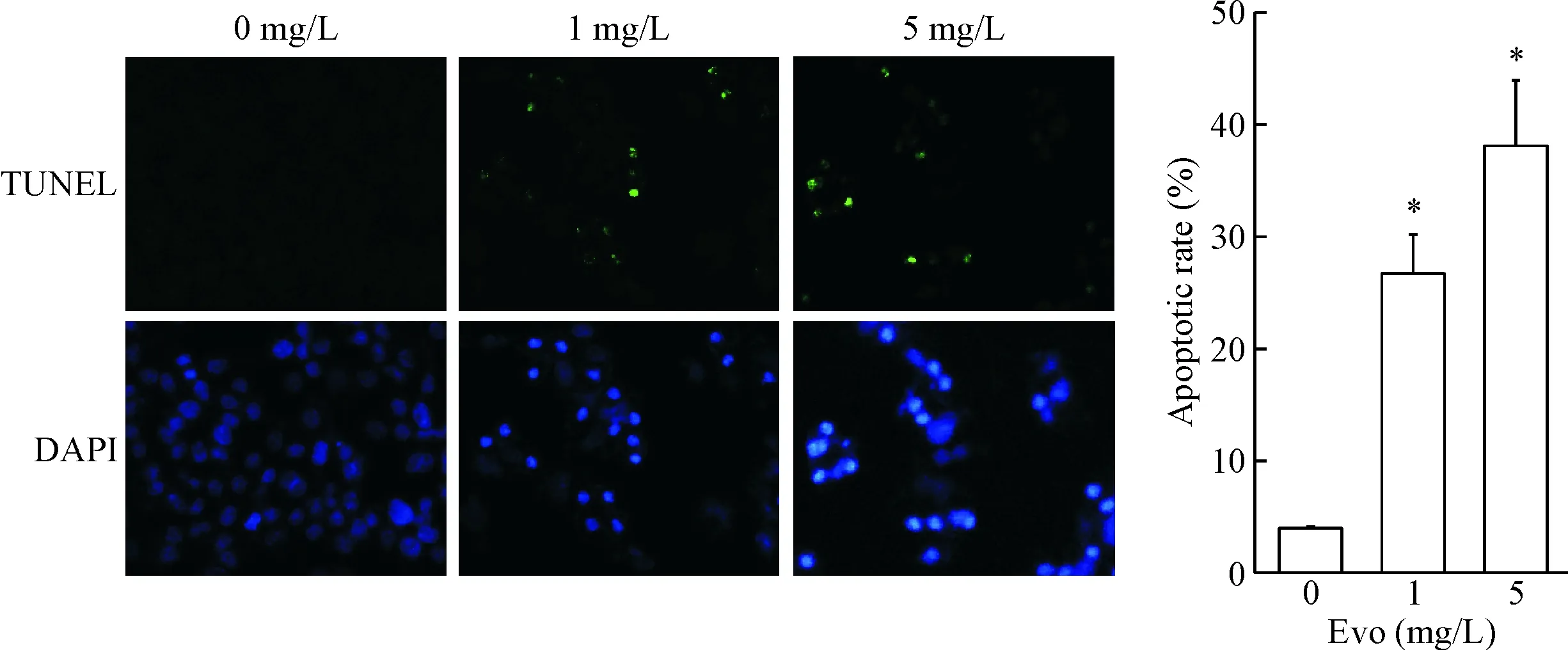
Figure 4. Evodiamine (Evo) induced the apoptosis of Huh7 cells. The cells were incubated with the indicated concentrations of Evo for 24 h, and induction of apoptosis was determined by TUNEL staining (×200). Mean±SD.n=3.*P<0.05vs0 mg/L group.
图4吴茱萸碱诱导Huh7细胞发生凋亡
Western blot实验结果表明,经吴茱萸碱作用24 h后,caspase-3和PARP的切割明显增多(P<0.05),提示吴茱萸碱促进Huh7细胞的凋亡可能与促进caspase-3和PARP的切割有关,见图5。
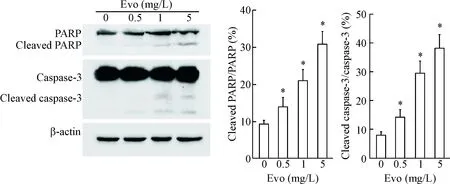
Figure 5. Cleavage of caspase-3 and PARP in Huh7 cells treated with evodiamine (Evo) was determined by Western blot. Mean±SD.n=3.*P<0.05vs0 mg/L group.
图5吴茱萸碱促进Huh7细胞中caspase-3和PARP的剪切
4吴茱萸碱促进TRAIL对Huh7细胞活力的抑制作用
MTT实验结果发现,与TRAIL(100 μg/L)或吴茱萸碱(1 mg/L)单独处理组相比,TRAIL和吴茱萸碱共同处理组对Huh7细胞活力的抑制作用显著提高,见图6。
同时,Western blot实验发现,吴茱萸碱与TRAIL联用后,Huh7细胞中caspase-3和PARP的切割明显增加(P<0.05),见图7。
5吴茱萸碱上调Huh7细胞中死亡受体5的表达
为进一步探讨吴茱萸碱增加Huh7细胞对TRAIL 敏感性的机制,Western blot检测了DR4和DR5的表达。与对照组相比,吴茱萸碱明显提高DR5的蛋白表达(P<0.05),而DR4的表达水平未见明显变化,见图8。
讨 论
细胞周期调控异常是肿瘤发生的生物学基础之一。调控细胞周期的进程也成为抗肿瘤药物活性设计的一个新途径。细胞周期蛋白和细胞周期蛋白依赖性激酶是2大主要的细胞周期调控分子[5]。Cyclin B1是激酶Cdc2的调节亚基,与Cdc2形成活性复合物,在S期和G2/M期合成并累积,参与调控G2/M期转换[6-7]。本研究结果表明,不同浓度的吴茱萸碱作用于Huh7细胞24 h后,细胞发生G2/M期阻滞,同时Cdc2、cyclin B1和p27的表达水平升高,表明吴茱萸碱可能通过调控上述细胞周期相关蛋白而诱导细胞阻滞于G2/M期。
Huh7细胞经吴茱萸碱作用24 h后,Western blot结果显示caspase-3和PARP的剪切水平增加。Caspase-3是线粒体介导的细胞凋亡途径和死亡受体途径的共同交汇点,是诱导细胞发生凋亡的关键蛋白酶。当凋亡信号通过各种途径传递到caspase-3后,在各种蛋白水解酶的作用下,caspase-3发生裂解而活化,进一步切割不同的底物(如PARP等),最终诱导细胞发生凋亡[8-9]。
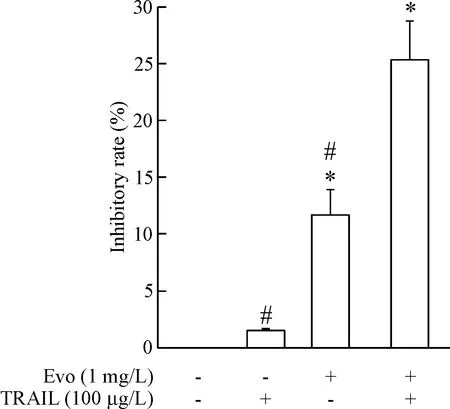
Figure 6. The Huh7 cells were treated with TRAIL at 100 μg/L alone or combined with evodiamine (Evo) at 1 mg/L for 24 h, and then the cell viability was measured by MTT assay. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsEvo+TRAIL group.
图6吴茱萸碱与TRAIL联用对Huh7细胞活力的影响
TRAIL是肿瘤坏死因子超家族成员之一,因其能够选择性地诱导肿瘤细胞凋亡而成为临床抗肿瘤研究的热点之一。虽然许多肿瘤细胞对TRAIL表现出耐药性,但通过深入研究其耐药机理并与其它药物联合可增加TRAIL 抗肿瘤敏感性,可以极大地提高TRAIL的临床应用价值[10]。TRAIL对应受体中,死亡受体DR4和DR5参与诱导细胞凋亡[11]。有研究发现,吴茱萸碱能够通过调控哺乳动物雷帕霉素靶蛋白/S6K1信号通路而抑制Mcl-1的表达,进而促进TRAIL对膀胱癌细胞的敏感性[12];而在胶质瘤细胞中,吴茱萸碱协同促进TRAIL的抗肿瘤活性则与其增加DR4和DR5的表达相关[13]。
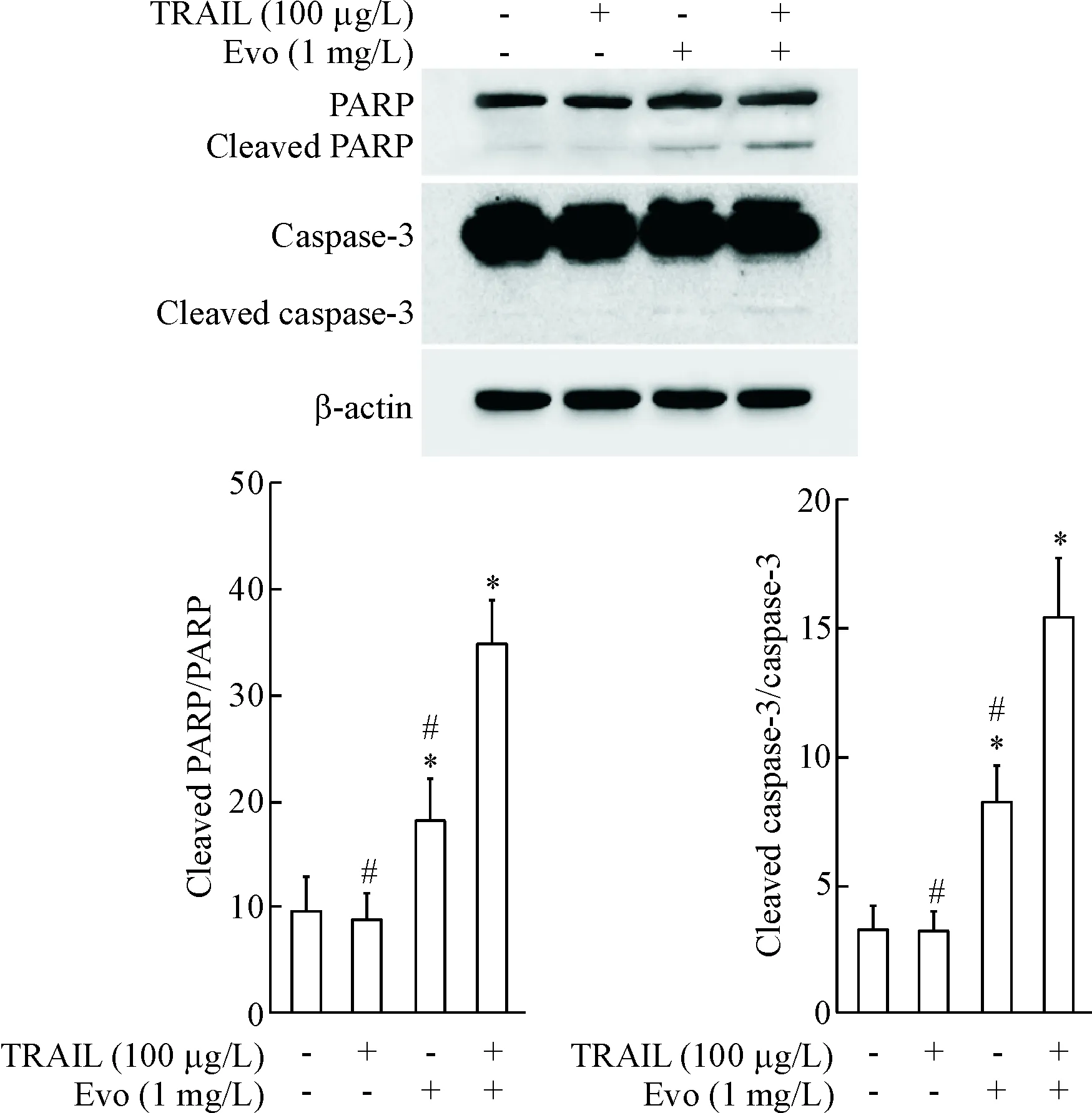
Figure 7. Evodiamine (Evo) enhanced TRAIL-induced cleavage of caspase-3 and PARP in the Huh7 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsEvo+TRAIL group.
图7吴茱萸碱与TRAIL联用促进caspase-3和PARP的切割
本研究初步表明,吴茱萸碱能够上调肝癌细胞Huh7中DR5 的表达,但对DR4的蛋白水平影响不显著。当吴茱萸碱与TRAIL共同作用Huh7细胞后,细胞活力显著下降;同时caspase-3和PARP的剪切水平明显增加,提示吴茱萸碱促进TRAIL的抗肿瘤活性可能与其上调DR5的表达相关,但吴茱萸碱上调DR5表达的分子机制则需进一步深入研究。
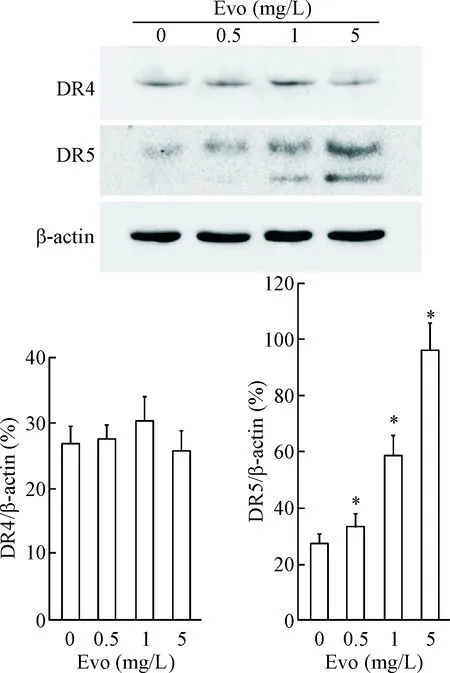
Figure 8. Western blot was used to detect the protein expression of DR4 and DR5 in the Huh7 cells. Mean±SD.n=3.*P<0.05vs0 mg/L group.
图8Westernblot检测细胞内DR4和DR5的蛋白表达
[1] 赵 楠, 李达翃, 李占林, 等. 吴茱萸化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2016, 33(2):103-109.
[2] 袁 龙, 陈 益, 刘泽洪, 等. 吴茱萸碱抑制HDAC6促进人白血病K562细胞周期阻滞和凋亡的机制研究[J]. 中草药, 2016, 47(17):3044-3050.
[3] Shi CS, Li JM, Chin CC, et al. Evodiamine induces cell growth arrest, apoptosis and suppresses tumorigenesis in human urothelial cell carcinoma cells[J]. Anticancer Res, 2017, 37(3):1149-1159.
[4] Yang F, Shi L, Liang T, et al. Anti-tumor effect of evo-diamine by inducing Akt-mediated apoptosis in hepatocellular carcinoma[J]. Biochem Biophys Res Commun, 2017, 485(1):54-61.
[5] Otto T, Sicinski P. Cell cycle proteins as promising targets in cancer therapy[J]. Nat Rev Cancer, 2017, 17(2):93-115.
[6] 王 君, 常利红, 李 霞, 等. 汉防己甲素对人鼻咽癌CNE1和CNE2细胞株的放疗增敏作用[J]. 中国病理生理杂志, 2017, 33(9):1611-1618.
[7] 孙 珂, 褚翠英, 郑梦琦, 等. CP466722抑制HepG2细胞增殖并诱导细胞凋亡[J]. 中国病理生理杂志, 2017, 33(4):655-660.
[8] Khazaei S, Ramachandran V, Abdul Hamid R, et al. Flower extract ofAlliumatroviolaceumtriggered apoptosis, activated caspase-3 and down-regulated antiapoptoticBcl-2 gene in HeLa cancer cell line[J]. Biomed Pharmacother, 2017, 89:1216-1226.
[9] 李若彤, 王 丽, 曹 亭, 等. Perifosine通过抑制PI3K/Akt途径调节人胶质瘤U251细胞增殖、凋亡与自噬[J]. 中国病理生理杂志, 2016, 32(4): 644-650.
[10] von Karstedt S, Montinaro A, Walczak H. Exploring the TRAILs less travelled: TRAIL in cancer biology and therapy[J]. Nat Rev Cancer, 2017, 17(6):352-366.
[11] Mert U, Sanlioglu AD. Intracellular localization of DR5 and related regulatory pathways as a mechanism of resis-tance to TRAIL in cancer[J]. Cell Mol Life Sci, 2017, 74(2):245-255.
[12] Zhang T, Qu S, Shi Q, et al. Evodiamine induces apoptosis and enhances TRAIL-induced apoptosis in human bladder cancer cells through mTOR/S6K1-mediated downregulation of Mcl-1[J]. Int J Mol Sci, 2014, 15(2):3154-3171.
[13] Khan M, Bi Y, Qazi JI, et al. Evodiamine sensitizes U87 glioblastoma cells to TRAIL via the death receptor pathway [J]. Mol Med Rep, 2015, 11(1):257-262.
