保留踝关节的自体瘤骨灭活再植重建胫骨下段骨肉瘤切除后骨缺损二例报道并文献复习
2018-03-01杨毅贾俊秀郭卫杨荣利汤小东燕太强王军陈忠岩
杨毅 贾俊秀 郭卫 杨荣利 汤小东 燕太强 王军 陈忠岩
胫骨下段并非骨肉瘤的好发部位,约占全身骨肉瘤的 4%[1-2],由于局部软组织覆盖较差,加之复杂的血管神经和肌腱等解剖结构,膝下截肢术一直是临床首选术式[3]。随着新辅助化疗和外科技术发展,有学者开始尝试应用异体骨、自体瘤骨灭活再植、肿瘤型假体、腓骨移植等技术实施保肢治疗,其中一些方法获得较好功能。但关于保肢术后的复发率、功能是否优于膝下截肢以及并发症问题,目前尚存在争议。
自体瘤骨灭活再植是一种简单、经济、有效的重建大段骨缺损的手术方式,以往在胫骨下段实施灭活再植手术时,顾忌于灭活骨折断和关节软骨磨损问题,大多数情况会选择踝关节融合术式。本研究尝试非融合重建踝关节灭活再植一种手术方法,功能方面较满意。现报告如下。
临床资料
一、一般资料
2 例,女,平均年龄 12.5 岁。平均胫骨下段截骨长度 11.5 cm。1 例术后因伤口皮缘坏死,愈合延迟,行二次缝合,未出现深部感染。2 例术后病理报告显示肿瘤坏死率均>90%,延续原方案化疗 4 个疗程。随访 13 个月、9 个月,局部未见复发,无远处转移迹象。2 例灭活胫骨与宿主骨均实现完全愈合,平均愈合 6 个月 ( 4 个月、8 个月 )。患者末次随访时均不需要佩戴支具行走,不需要扶拐,无局部疼痛症状,行走功能及踝关节屈伸正常。MSTS-93 评分平均 95.00% ( 96.67% 和 93.33% )( 表 1、2 )。
二、手术方法
1. 术前准备:治疗前均有明确穿刺或切开活检的骨肉瘤病理结果。手术前接受 2 个疗程阿霉素、顺铂、甲氨蝶呤及异环磷酰胺的序贯化疗。术前化疗期间应用支具进行肢体制动,避免发生病理性骨折。术前温碘伏水泡脚,减少足踝部定植细菌,术前行常规全麻准备。
2. 体位及麻醉:患者接受全身麻醉后取仰卧位,双下肢止血带,消毒范围均至大腿中段,患侧备取腓骨。
3. 手术操作:( 1 ) 广泛切除肿瘤:手术采用小腿下段前内侧切口,梭形切除活检切口。2 例术前化疗效果满意,局部软组织肿块基本消失,术中均获得广泛外科边界,根据术前 MRI 决定截骨长度,距离肿瘤>2 cm。踝关节囊及内侧韧带切除范围>1 cm。术后送检髓腔和软组织外科边界均无肿瘤残留。( 2 ) 瘤骨灭活:去除瘤骨表面骨膜及软组织成分,刮除髓腔内肿瘤,软钻扩髓至皮质骨。将瘤骨完全浸入 20%、恒温 65 ℃、高渗盐水灭活 30 min。灭活结束后庆大霉素生理盐水浸泡 5 min ( 图 1c )。( 3 ) 灭活骨回植和腓骨移植:另备手术器械,截取对侧腓骨 10 cm,原位回植灭活瘤骨,腓骨置于髓腔内连接灭活骨及宿主骨。截骨面周围植入异体骨条 ( 图 1c )。( 4 ) 内固定和踝关节重建:胫骨外侧钢板跨越截骨面,下胫腓关节植骨融合,LARS 韧带和( 或 ) 带线铆钉重建踝关节内侧韧带,其中 1 例腓骨骨骺未闭合患者行骨骺毁损以避免外踝腓骨生长造成踝内翻畸形 ( 图 1c )。
2 例手术平均术中出血 200 ml,手术时间 2.5 h,局部软组织覆盖满意,留置引流。

表1 患者一般情况Tab.1 Clinical details of all patients

表2 患者 MSTS 评分Tab.2 MSTS scores

图1 患儿,女,9 岁,右胫骨下端骨肉瘤 a:术前 X 线片,右胫骨下端骨肉瘤;b:化疗后 MRI 显示软组织包块消失,病变局限于骨内;c:术中完整切除胫骨远端肿瘤后刮除髓腔内肿瘤、65 ℃ 20% 高f渗盐水灭活 30 min 后原位回植、对侧自体腓骨置于髓腔中心、钢板内固定、LARS 韧带重建内踝软组织、下胫腓关节融合;d:术后即刻 X 线片;e:术后 6 个月 X 线片显示截骨面已愈合;f:术后踝关节功能良好,术后 4 个月不需要支具辅助可正常行走Fig.1 Female, 9 years old, osteosarcoma of the distal tibia a - b: Pre-operative X-rays and MRI; c: The segmental tumor bone was resected, and then devitalized in 20% sterile saline at 65 ℃ for 30 mins when the tumor tissue was removed. The recycling bone was implanted back into the defect with a non-vascularized fibular strut graft. Plate, nail and artificial ligament were used for the stabilization of the tibia and ankle; d: Postoperative X-rays; e: X-ray at 6 months follow-up showed complete healing of the recycling bone; f: Functions of the ankle were excellent. The patient can walk without brace 4 months postoperatively
4. 术后处理与康复:术后第 2 周开始踝关节屈伸锻炼,第 3 周开始佩戴支具半负重站立行走,每个月复查 X 线片,直至骨愈合后去除支具,佩戴护踝行走。
文献资料
一、检索方法
计算机检索 Pubmed、中国知网、万方数据库等近 20 年 ( 1997~2017 年 ) 公开发表文献,同时手工检索已发表骨科学术论文,检索词为骨肉瘤 ( osteosarcoma );胫骨 ( tibia );外科手术( surgical procedures );踝关节 ( ankle joint );再植术( replantation );灭活 ( devitalized )。共有 12 篇外科治疗胫骨远端恶性骨肿瘤的回顾性队列研究文献,合计 157 例,其中保肢 131 例,截肢 26 例。
二、检索结果
重建方法包括肿瘤型假体重建 ( 3 篇 ) 和生物重建 ( 9 篇 ),生物重建中绝大多数作者选择异体骨移植+自体腓骨移植的方法,仅 1 篇使用灭活再植技术;踝关节重建方面绝大多数采用踝关节融合,仅2 篇文献作者选择非融合的方法。全部文献中未见笔者设计使用的非踝关节融合的灭活再植法。
与其它重建方式相比较,笔者使用的非踝关节融合灭活再植法的并发症发生率较低 ( 50.0% ),其余 12 篇文献中并发症发生率最高达 92.3%,术后功能优良率高于其它文献报道。笔者采用的高渗盐水灭活技术可有效彻底杀灭肿瘤,同时降低不愈合率( 0% ),并缩短愈合时间 ( 6 个月 ) ( 表 3 )。
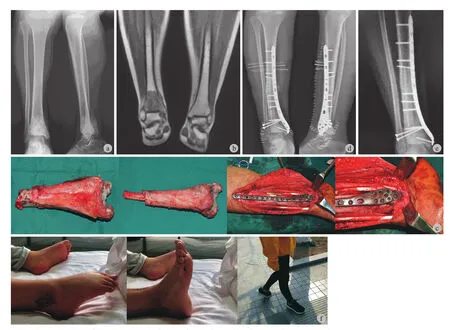
图2 患者,女,16 岁,右胫骨下端骨肉瘤 a:术前 X 线片,右胫骨下端骨肉瘤,后方软组织包块影伴肿瘤性成骨;b:化疗后MRI 显示胫骨下端异常信号影;c:术中完整切除胫骨远端肿瘤后刮除髓腔内肿瘤、65 ℃、20% 高f渗盐水灭活 30 min 后原位回植、对侧自体腓骨置于髓腔中心、钢板内固定、LARS 韧带重建内踝软组织、下胫腓关节融合;d:术后即刻 X 线片;e:术后 8 个月 X 线片显示截骨面已模糊;f:术后踝关节功能良好,术后 7 个月不需要支具辅助可正常行走Fig.2 Female, 16 years old, osteosarcoma of the distal tibia a - b: Pre-operative X-rays and MRI; c: The segmental tumor bone was resected, and then devitalized in 20% sterile saline at 65 °C for 30 mins when the tumor tissue was removed. The recycling bone was implanted back into the defect with a non-vascularized fibular strut graft. Plate, nail and artificial ligament were used for the stabilization of the tibia and ankle; d: Postoperative X-rays; e: X-ray at 8 months follow-up showed complete healing of the recycling bone; f: Functions of the ankle were excellent. The patient can walk without brace 7 months postoperatively
讨 论
胫骨是仅次于股骨为骨肉瘤的好发部位,约占全身骨肉瘤的 19%。其中 20% 发生于胫骨远端[1-2]。踝关节区域解剖复杂,毗邻胫骨神经、血管、肌腱和韧带,使其广泛切除非常困难。胫骨下段软组织覆盖条件差,在植入假体或异体骨等重建材料后,常常出现伤口并发症。以往观点认为:膝下截肢术可以提供安全的外科边界,佩戴假肢可以获得相对满意的术后功能。随着外科技术的发展,对于新辅助化疗有效的胫骨下段骨肉瘤患者来说,保肢手术可能获得更好的功能。Abudu 等[4]建议胫骨远端病变保肢适应证包括:( 1 ) Enneking 3 级侵袭性良性骨肿瘤;( 2 ) 原发恶性骨肿瘤病变局限于骨内,无软组织包块;( 3 ) 患者拒绝截肢手术。禁忌证包括:( 1 ) 血管神经、重要肌腱受侵,病变累及踝关节内;( 2 ) 对于化疗效果欠佳和局部皮肤条件差的患者更倾向于接受截肢手术。回顾既往文献,截肢( 50%~100%,随访 6~288 个月 ) 和保肢 ( 84%~100%,随访时间 36~60 个月 ) 患者的生存率差异无统计学意义[4-14]。两组患者术后 MSTS 功能评分差异无统计学意义 ( 保肢 50%~100% vs. 截肢 53%~90% )[4-17]( 表 3 )。
胫骨远端病变切除后大段骨缺损的重建方法包括异体骨、自体瘤骨灭活再植、肿瘤型假体、腓骨移植等,在中国,自体瘤骨灭活再植作为一种简单、经济、有效的手术方式被广泛应用。本研究采用了改良的巴氏灭活方法,20% 高渗盐水在彻底杀灭肿瘤细胞的同时,更好地保护了成骨活性蛋白[18-20]。本组病例在半年左右均实现了骨愈合,患者可在无支具保护下行走。
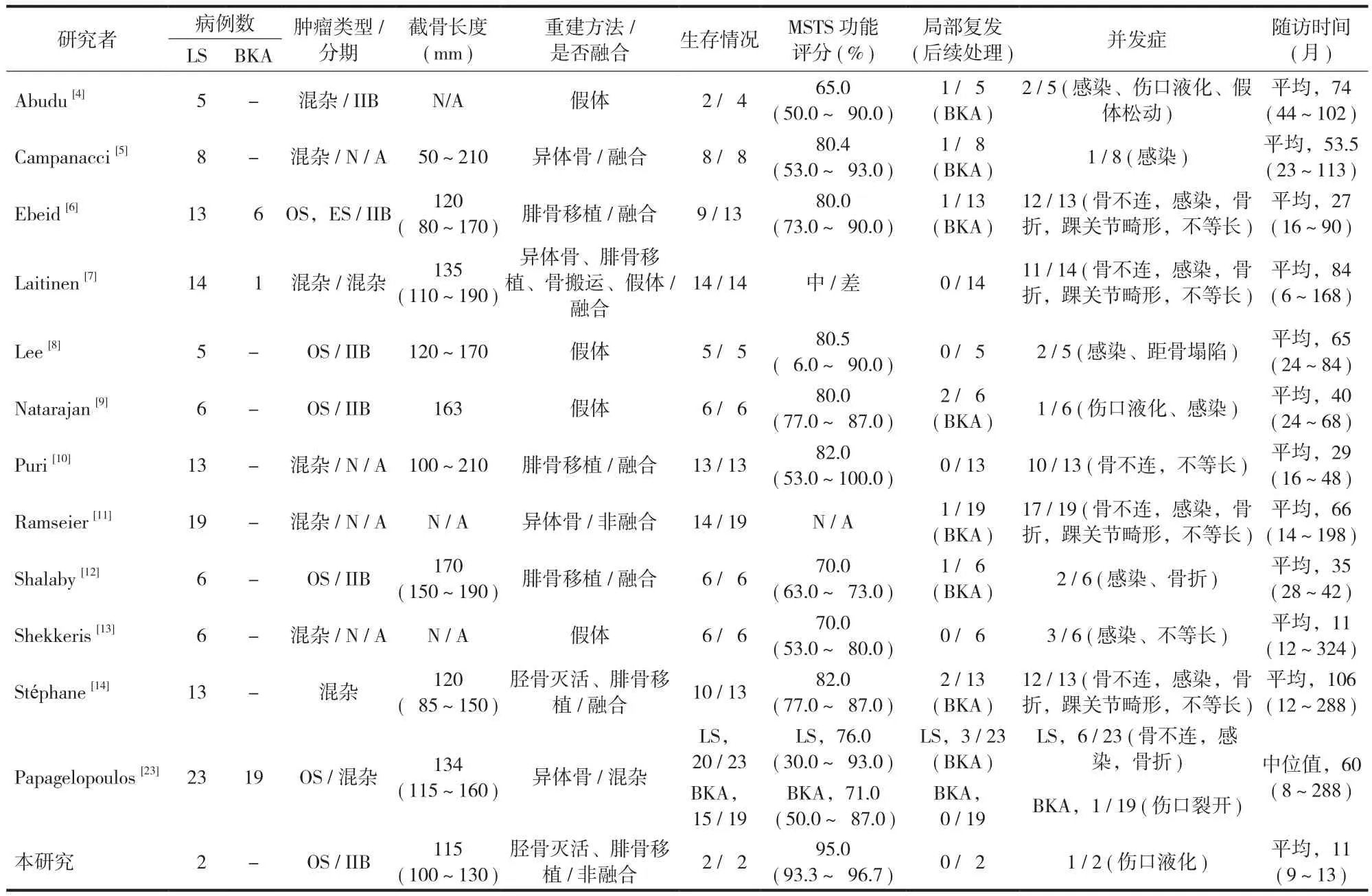
表3 胫骨远端肿瘤切除及功能重建文献回顾Tab.3 A summary of published studies on limb salvage and amputation for tumors of the distal tibia
以往在胫骨下段实施灭活再植手术时,顾忌灭活骨折断、关节软骨磨损问题,大多数情况下会选择踝关节融合术式。本研究尝试了一种非融合重建踝关节的灭活再植手术方法,早期随访内,患者获得较满意功能,并未出现关节软骨磨损导致的疼痛及关节退变问题。Igarashi 等[21]应用液氮灭活后同样未发现严重的关节软骨退变的情况,这说明常规的灭活方法在彻底杀灭肿瘤的时候,可能并未对关节软骨造成不可逆损伤。
胫骨下端骨肉瘤患者接受保肢治疗后常见并发症包括:感染[4-7,9,11-12,14,22]、移植骨骨折[6-7,11-12,14,22]、骨不连[6-7,10,14,22]、伤口愈合延迟和皮瓣坏死[4,7,10,14]、踝关节畸形和不稳[4,7,14,23]、肢体不等长[4,7,13]、踝关节软骨退变[11]、距骨塌陷[5]等。过去经验认为踝关节融合术后并发症相对较低,但近期一些研究[24]和本组结果均证实,在实施下胫腓融合和三角韧带重建后,踝关节功能更为理想,同时并不增加并发症的发生率。本组患者化疗效果显著,无骨外软组织包块,局部皮肤条件较好,可能是本组患者并发症低的另一原因。另外,值得一提的是,对于腓骨下段骨骺未闭合的患者,在手术过程中务必行骨骺毁损术,否则腓骨的继续生长将造成踝关节畸形和功能障碍等问题。
综上所述,胫骨下端骨肉瘤患者应根据病情和化疗效果恰当选取截肢或保肢治疗。本组研究报道了一个新的灭活再植重建术式,非融合的踝关节重建可以提供良好的早期功能。65 ℃、20% 高渗盐水、灭活 30 min 是一种简单、经济、有效的灭活技术,骨内活性蛋白的保存有利于骨愈合,同时可能促进关节软骨的修复。但就远期疗效和基础方面问题,还有待进一步研究探讨。
[1] Zeytoonjian T, Mankin HJ, Gebhardt MC, et al. Distal lower extremity sarcomas: frequency of occurrence and patient survival rate[J]. Foot Ankle Int, 2004, 25(5):325-330.
[2] Papagelopoulos PJ, Savvidou OD, Mavrogenis AF, et al.Lateral malleolus en bloc resection and ankle reconstruction for malignant tumors[J]. Clin Orthop Relat Res, 2005, (437):209-218.
[3] Ebeid W, Amin S, Abdelmegid A, et al. Reconstruction of distal tibial defects following resection of malignant tumours by pedicled vascularised fibular grafts[J]. Acta Orthop Belg, 2007,73(3):354-359.
[4] Abudu A, Grimer RJ, Tillman RM, et al. Endoprosthetic replacement of the distal tibia and ankle joint for aggressive bone tumours[J]. Int Orthop, 1999, 23(5):291-294.
[5] Campanacci DA, Scoccianti G, Beltrami G, et al. Ankle arthrodesis with bone graft after distal tibia resection for bone tumors[J]. Foot Ankle Int, 2008, 29(10):1031-1037.
[6] Ebeid W, Amin S, Abdelmegid A, et al. Reconstruction of distal tibial defects following resection of malignant tumours by pedicled vascularised fibular grafts[J]. Acta Orthop Belg, 2007,73(3):354-359.
[7] Laitinen M, Hardes J, Ahrens H, et al. Treatment of primary malignant bone tumours of the distal tibia[J]. Int Orthop, 2005,29(4):255-259.
[8] Lee SH, Kim HS, Park YB, et al. Prosthetic reconstruction for tumours of the distal tibia and fibula[J]. J Bone Joint Surg Br,1999, 81(5):803-807.
[9] Natarajan MV, Annamalai K, Williams S, et al. Limb salvage in distal tibial osteosarcoma using a custom mega prosthesis[J].Int Orthop, 2000, 24(5):282-284.
[10] Puri A, Subin BS, Agarwal MG. Fibular centralisation for the reconstruction of defects of the tibial diaphysis and distal metaphysis after excision of bone tumours[J]. J Bone Joint Surg Br, 2009, 91(2):234-239.
[11] Ramseier LE, Malinin TI, Temple HT, et al. Allograft reconstruction for bone sarcoma of the tibia in the growing child[J]. J Bone Joint Surg Br, 2006, 88(1):95-99.
[12] Shalaby S, Shalaby H, Bassiony A. Limb salvage for osteosarcoma of the distal tibia with resection arthrodesis,autogenous fibular graft and Ilizarov external fixator[J]. J Bone Joint Surg Br, 2006, 88(12):1642-1646.
[13] Shekkeris AS, Hanna SA, Sewell MD, et al. Endoprosthetic reconstruction of the distal tibia and ankle joint after resection of primary bone tumours[J]. J Bone Joint Surg Br, 2009,91(10):1378-1382.
[14] Stéphane S, Eric M, Philippe W, et al. Resection arthrodesis of the ankle for aggressive tumors of the distal tibia in children[J].J Pediatr Orthop, 2009, 29(7):811-816.
[15] Aksnes LH, Bauer HC, Jebsen NL, et al. Limb-sparing surgery preserves more function than amputation: a Scandinavian sarcoma group study of 118 patients[J]. J Bone Joint Surg Br,2008, 90(6):786-794.
[16] Davis AM, Devlin M, Griffin AM, et al. Functional outcome in amputation versus limb sparing of patients with lower extremity sarcoma: a matched case-control study[J]. Arch Phys Med Rehabil, 1999, 80(6):615-618.
[17] Eiser C, Darlington AS, Stride CB, et al. Quality of life implications as a consequence of surgery: limb salvage, primary and secondary amputation[J]. Sarcoma, 2001, 5(4):189-195.
[18] 杨毅, 彭长亮, 孙馨, 等. 高渗盐水灭活自体骨再植的动物实验[J]. 北京大学学报 (医学版), 2012, 44(6):950-953.
[19] Qu H, Guo W, Yang R, et al. Reconstruction of segmental bone defect of long bones after tumor resection by devitalized tumorbearing bone[J]. World J Surg Oncol, 2015, 13(1):282.
[20] Qu H, Guo W, Yang R, et al. Cortical strut bone grafting and long-stem endoprosthetic reconstruction following massive bone tumour resection in the lower limb[J]. Bone Joint J, 2015,97-B(4):544-549.
[21] Igarashi K, Yamamoto N, Tsuchiya H. The long-term outcome following the use of frozen autograft treated with liquid nitrogen in the management of bone and soft-tissue sarcomas[J]. Bone Joint J, 2014, 96-B(4):555-561.
[22] Mavrogenis AF, Abati CN, Romagnoli C, et al. Similar survival but better function for patients after limb salvage versus amputation for distal tibia osteosarcoma[J]. Clin Orthop Relat Res, 2012, 470(6):1735-1748.
[23] Papagelopoulos PJ, Savvidou OD, Mavrogenis AF, et al.Lateral malleolus en bloc resection and ankle reconstruction for malignant tumors[J]. Clin Orthop Relat Res, 2005, (437):209-218.
[24] Hintermann B. Medial ankle instability[J]. Foot Ankle Clin,2003, 8(4):723-738.
