专一脱硫菌催化氧化原油脱硫的研究
2018-02-28徐岚清黎贤彬孙佳欣谢纤羽
唐 琼,徐岚清,冯 昊,黎贤彬,孙佳欣,谢纤羽
( 乐山师范学院化学学院,四川 乐山 614000)
引 言
石油中的硫含量达2%以上[1],而燃烧石油产品时所产生的SO2正是引起酸雨、PM2.5 超标等一系列环境问题的主要污染物之一[2]。因此,原油的深度脱硫已成为世界急需解决的问题[3]。目前,工业上常用的脱硫方法是加氢脱硫,它是在金属催化剂的作用下,通过高温、高压催化加氢将油中的有机硫转化成H2S 而脱去。但此法运行条件苛刻,能耗高,且难以脱除杂环化合物中的硫[4-5]。近年来迅速发展起的生物脱硫技术是在不影响燃油固有结构的基础上选择性脱除有机硫,它不影响燃油的热值,且能够有效脱除二苯并噻吩( Dibenzothiophene,DBT) 及其衍生物中的硫[6-7],因此被认为是21 世纪降低石油产品硫含量的有效途径,越来越受到国内外研究者的关注。
噻吩及其衍生物是石油中的主要含硫化合物,其含硫量占原油中有机硫总量的50% ~90%,而苯并噻吩和DBT 占噻吩类的70%以上,是含硫杂环化合物中最典型的代表[8]。此类物质结构复杂,化学性质稳定,尤其是4位和6 位有取代基的DBT 系列,由于具有空间位阻效应,是公认的最难脱除的有机硫化物[9]。本文采用生物催化氧化对原油中含硫化合物DBT 进行脱硫研究,着重探讨微生物驯化富集、DBT 初始浓度、温度、摇床转数和微生物接种量等因素对生物催化脱硫效率的影响,并对氧化脱硫机理进行了探讨。
1 实验部分
1.1 试剂与仪器
纯度为99%的二苯并噻吩( Sigma,中国) ; 正己烷、甲酸、乙腈、甲醇、甘油及培养基,均为分析纯,产自成都市科龙化工试剂厂,用前没有进一步纯化。
立式高压灭菌锅( YXQ-LS-50S11,博迅) ;高速离心机( TDZ4 -WS,Cence) ; ZP-A 摇床( 开元) ;PHS -3型pH 计( 雷磁) ;紫外-可见分光光度计( Jasco V -550 UV/vis,Jasco) ;高效液相色谱仪( LC -2010A HT,日本岛津) ;气相色谱-质谱联用仪( ISQLT Single Quadrupole Mass Sepectrometer,TRACE 1310 Gas Chromatograph,Thermo.) 。
1.2 培养基的成分
经过对培养基进行分析比较,最后选用由2.44 g·L-1的KH2PO4,4.76 g·L-1的NaHPO4,0.4 g·L-1的MgCl2.6H2O,2.0 g·L-1的NH4Cl,1.0 mg·L-1的CaCl2.2H2O,1.0 mg·L-1的FeCl3.6H2O,4.0 mg·L-1的MnCl2.4H2O,10 g·L-1的甘油组成的无硫无机盐基础培养基( Basal Salts Medium,BSM)[10]。
1.3 微生物的驯化、富集
微生物的驯化富集以甘油为碳源,DBT 为硫源作为培养体系,过程如下:
取10 g 被石油污染的土壤与100 mL BSM,于250 mL锥形瓶中混合,再加入作为唯一硫源的DBT 乙醇溶液形成混合液,其中DBT 的终浓度为0.2 mmol·L-1。将装有混合液的锥形瓶放在摇床上,在室温下以200 rpm 的转速进行富集培养5 天,然后将混合液在4000 rpm 下离心10 min。取上清液5 mL,加入到装有100 mL 新鲜BSM培养基和硫源的锥形瓶中,继续富集培养5 天。再取上清液重复进行富集培养,这样重复培养4 次后,将所富集到的微生物培养液作为生物催化脱硫的微生物种子。
1.4 微生物脱硫实验
在250 mL 锥形瓶中,将一定量的培养基和DBT 溶液混合,并接种一定量的脱硫微生物。将装有混合液的锥形瓶放在摇床上,在一定转速和温度下进行培养。7天后,取一定量的培养液用等体积的正己烷进行萃取。将萃取后的有机相用高效液相色谱仪分析其中DBT 的浓度。每个样品做三个平行样。
1.5 分析检测方法
(1) 菌液浓度由分光光度法在620 nm 下测定吸光度,用离心后的培养液做空白调零。依据吸光度及其和细胞干重绘制成的标准曲线,通过计算得到菌液细胞干重,从而获得细胞浓度。
(2) 用高效液相色谱仪( HPLC) 分析DBT 及其产物2 -羟基联苯( 2 -HBP) 的浓度。将培养后的微生物混合液用等体积正己烷萃取,萃取后的有机相用HPLC 分析测定。分析条件:分离柱为XBridge-C18 柱(150 mm×4.6 mm,粒径3.5 nm) ,柱温30°C; 流动相为乙腈与0.2%甲酸的混合物( 两者的比为6∶4) ,流速为1 mL/min。DBT 检测波长为275 nm,进样量5.0 μL。
(3) 用GC-MS 分析氧化产物。GC 条件:进样口温度320 ℃; 载气为高纯He,恒流模式,流速1 mL/min;1∶20分流进样,进样量1 μL;色谱柱为TG-SQC ( Thermo PN 26070 -1300,30 m × 0.25 mm × 0.25 m ) ;柱升温程序:初始温度80 ℃,保持0.5 min,以40 ℃/min 的速率升温至200 ℃,保持0.5 min,以5 ℃/min 的速率升温至210 ℃,保持8 min,再以40 ℃/min 的速度升温至300 ℃,保持2 min。MS 条件: 电子轰击电离( EI) 源,电子能量70 eV;离子源温度280 ℃,质谱传输线温度280 ℃,溶剂延迟时间5 min,扫描荷质比范围为为40 ~300。产物的鉴定采用GC-MS 中自带的Nist -05 标准谱图库,匹配度大于90%。
2 结果与讨论
2.1 微生物驯化富集
微生物的驯化富集以甘油为碳源,DBT 为硫源。从被石油污染的土壤表面收集的微生物,在添加了DBT(0.2 mmol·L-1) 作为唯一硫源的BSM 中,经一系列的培养、驯化后,微生物和DBT 的含量随培养时间的变化如图1 所示。
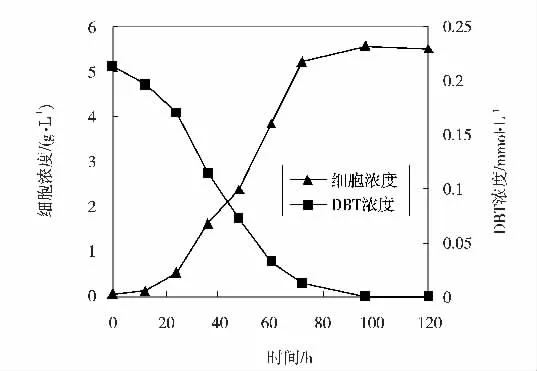
图1 微生物和DBT 浓度随培养时间的变化
从图1 可知,随着微生物浓度的增加,DBT 浓度下降,当培养四天( 即96 小时) 时,培养液中DBT 浓度接近于零,此时微生物细胞浓度达到最大值,为5.57 g·L-1,由此表明微生物的生长与DBT 脱硫是一个相关过程,两者是同时发生的,这说明微生物在生长繁殖的新陈代谢过程中,需要消耗DBT 中的硫源来满足合成细胞机体对硫元素的需要。研究结果表明驯化富集到的微生物对DBT 的生物脱硫效果很显著。
2.2 温度对DBT 生物氧化脱硫的影响
在培养基体积为100 mL、DBT 终浓度为0.6 mmol·L-1、微生物接种量为5 mL、摇床转速为200 rpm 的条件下,分别设置20 ℃、25 ℃、30 ℃、35 ℃和40 ℃的温度梯度,培养7 天,考察培养温度对DBT 生物脱硫效率的影响,结果如图2 所示。
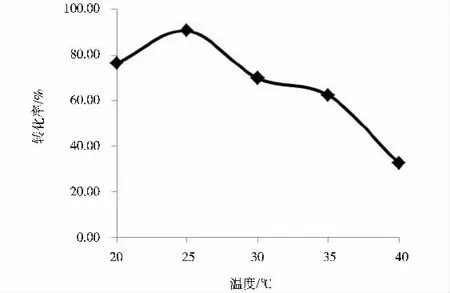
图2 温度对DBT 脱硫转化的影响
从图2 可知,微生物的脱硫效率随着温度的上升而先增加后降低,当温度升高到25 ℃时,DBT 的脱硫转换率达到了最高,为90.74%; 但当温度继续增加时,DBT的转化率急剧下降,当温度为40 ℃时,DBT 的转换率仅为32.53%。其主要原因是微生物的生长代谢与温度息息相关,一般情况下,一定温度范围内,微生物的酶活性随温度的升高而上升,但是当温度超过这一范围后,会抑制酶的活性,从而降低催化效率,甚至使其失活。研究结果表明所筛选、富集出的微生物其酶活性最适温度在25 ℃左右,低于此温度,酶活性降低,而当温度达到40 ℃时,微生物的生长会受到严重的影响,从而降低DBT 的转化率。
2.3 转速对DBT 生物氧化脱硫的影响
在培养基体积为100 mL、DBT 终浓度为0.6 mmol·L-1、微生物接种量为5 mL、培养温度为25 ℃的条件下,分别设置160 rpm、180 rpm、200 rpm 和220 rpm 的摇床转速,培养7 天,考察转数对DBT 生物脱硫效率的影响,结果如图3 所示。
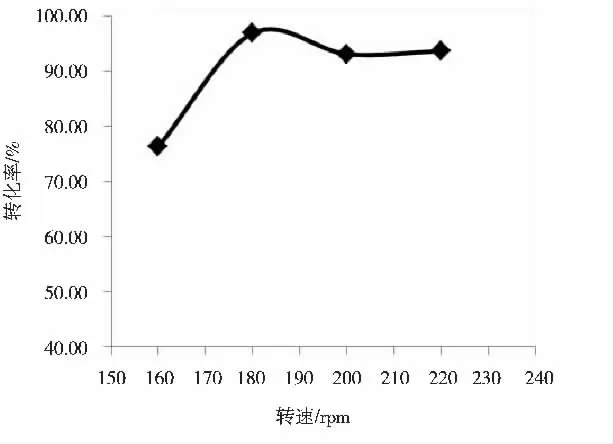
图3 转速对DBT 脱硫转化的影响
从图3 可知,当摇床转数从160 rpm 增加到220 rpm的过程中,微生物对DBT 的脱硫转化率呈现先增加后轻微降低的现象。转速在180 rpm 时,DBT 转换率达到了最高,为96.83%。其主要原因是摇床的转速决定了培养基中溶解氧的含量,对于好养微生物,氧气浓度的变化对生长代谢和催化速率有影响,但是水中溶解氧浓度是有上限的,达到这个上限后摇速再增加溶解氧也不会明显增加;而另一方面,摇床转数过高,锥形瓶里的液体在高速旋转下产生较强的剪切作用力,这会影响微生物的生长代谢,从而导致脱硫效率不会继续增加甚至略有降低。
2.4 微生物初始浓度对DBT 生物氧化脱硫的影响
在培养基体积为100 mL、DBT 终浓度为0.6 mmol·L-1、培养温度为25 ℃、摇床转速为180 rpm 的条件下,分别接种0.5 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL 和5.0 mL的生物富集培养物,培养7 天,考察微生物初始浓度对DBT 生物脱硫效率的影响,结果如图4 所示。
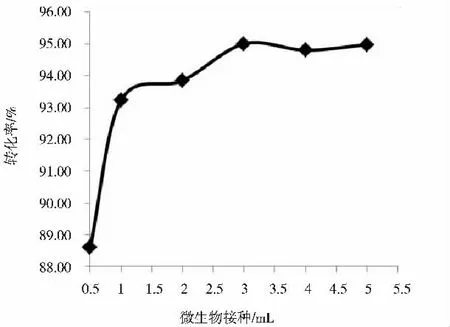
图4 微生物接种量对DBT 脱硫转化的影响
从图4 可知,接种量在0.5 mL 增加到3 mL 的过程中,脱硫效率逐渐上升,接种量为3.0 mL 时DBT 转换率达到了最高,为95.01%,之后继续增大接种量,转化率略有波动。其主要原因是在接种量为0.5 mL ~3 mL时,微生物量随着时间的增加呈几何数增长,初始接种量越大,微生物浓度也就越高,所以催化效率也越高。而当接种量超过3 mL 时,DBT 转化率不再增加,这主要是因为:随着反应产物2 -羟基联苯和的增加,整个体系的传质速率受到影响,从而影响反应的正向进行,使反应速率降低[11]; 此外,还存在一些不确定的因素,比如微生物已经利用完了碳源和其它营养物质[12],从而也会影响其生长代谢。
2.5 微生物脱硫机理的探讨
为了考察微生物对DBT 氧化脱硫的机理,在最优条件下,将脱硫微生物培养4 天,然后,用等体积正己烷萃取微生物混合液,将萃取后的有机相用GC -MS 分析测定。其色谱、质谱图分别如图5、图6 所示。
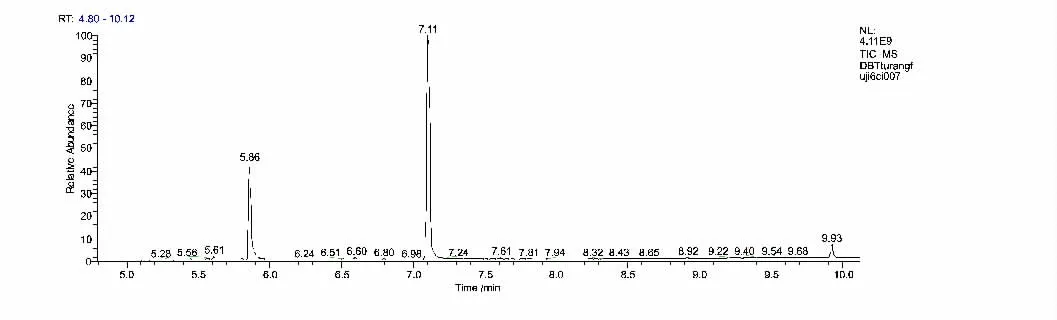
图5 GC-MS 分析得到的氧化产物色谱图
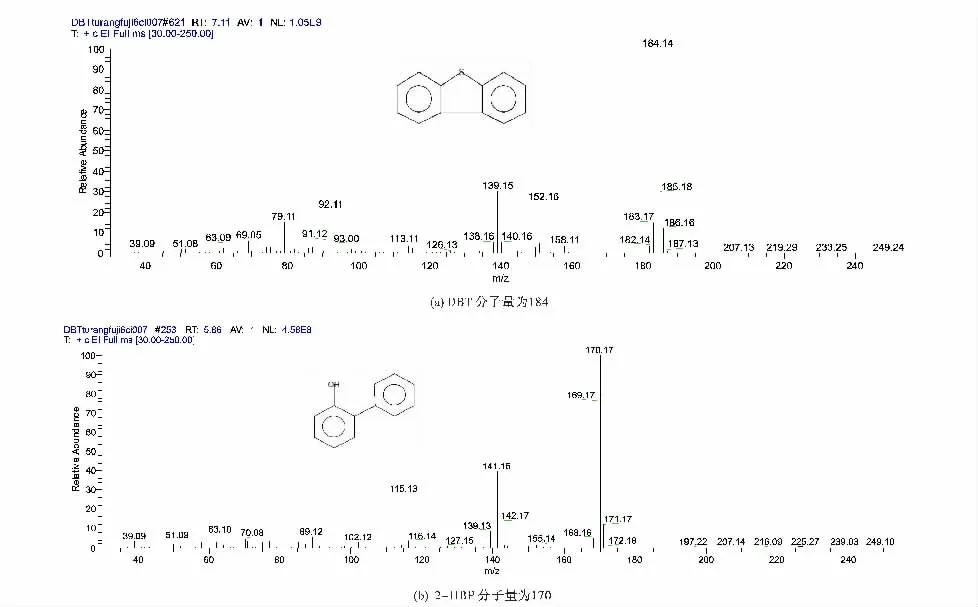
图6 保留时间为7.11 min 和5.86 min 物质的质谱图
从图5、图6 可知,从被油污染的土壤里通过筛选、驯化、富集得来的脱硫菌株能够将DBT 催化氧化脱硫,最终产物为2 -羟基联苯(2 -HBP) 。有研究表明,微生物脱除DBT 类硫需要4 种酶: DBT 单加氧酶( dszC) 、DBT 砜单加氧酶( dszA) 、黄素还原酶( dszD) 和HPBS脱硫酶的共同参与[13-14]。dszC 和dszA 的活力依赖于dszD。在dszD 的存在下,dszC 和dszA 将DBT 依次氧化为相应的亚砜类( DBTO) 、砜类( DBTO2) 和磺酸盐类( HPBS) ; dszB 进一步将HPBS 氧化脱硫,生成2 -HBP和。其详细脱硫途径如图7 所示。
从图7 可知,在这一反应过程中,噻吩类化合物只是作为硫源而不是碳源,微生物选择性地攻击DBT 中的C-S 键,使C-S 键断裂,释放出硫元素,生成油溶性的2 -羟基联苯( 此物又回到油相) 。整个反应中碳碳结构不受到破坏,使得烃类化合物的碳骨架完好保存下来,从而最大限度地保留了石油产品的燃烧值。
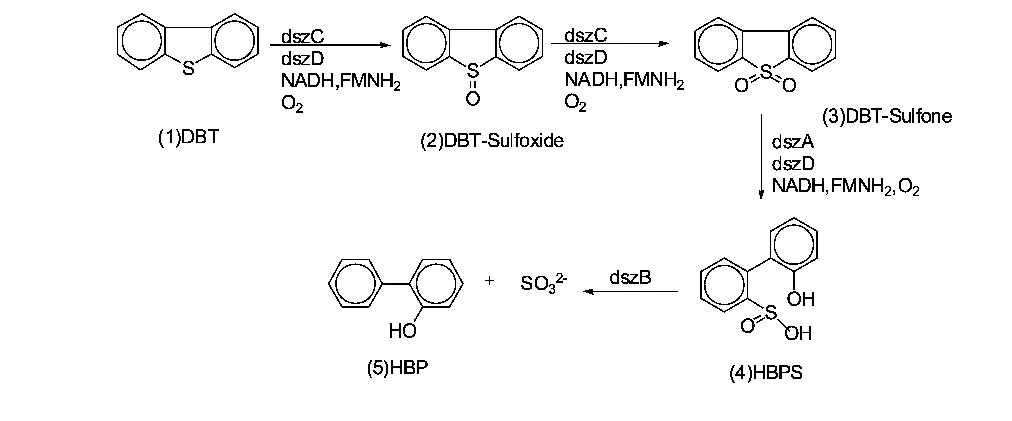
图7 生物催化DBT“4S”脱硫途径
3 结 论
本文采用生物催化氧化,对原油中含硫化合物二苯并噻吩进行了脱硫研究,着重探讨了微生物驯化、富集,温度,转速和生物接种量等因素对生物催化脱硫效率的影响,并对其催化脱硫机理进行了探讨。结论如下:
(1) 以甘油作为碳源、DBT 作为唯一硫源的培养体系来驯化、富集得到的微生物能够有效脱除DBT 分子中的硫元素,微生物生长和DBT 脱硫同时发生。
(2) 微生物的脱硫率随培养温度、摇床转速、生物接种量的变化而不同。随着培养温度、摇床转速的增加,脱硫效率先增加后降低。生物接种量越大,脱硫效率越高,直至平缓。生物催化脱硫反应条件优化为: 温度25 ℃,摇床转速180 rpm,生物接种量3 mL,使DBT 的脱硫率达到了95.01%。
(3) 微生物催化脱硫的机理是:催化反应通过4S 途径,将DBT 转化成油溶性的2 -羟基联苯( 2 -HBP) 并释放出硫来,同时烃类化合物碳骨架得以保存完好,从而不影响原油的热值。
