魔芋葡甘聚糖/纳米SiO2复合涂膜配方及其对芒果贮藏品质的影响
2018-02-28麦馨允陈庆金谭彦妮张花贾桂康
麦馨允,陈庆金,谭彦妮,张花,贾桂康
(百色学院 农业与食品工程学院,广西 百色,533000)
芒果(MangiferaL.)属漆树科,原产于南亚,目前已成为热带地区栽培较多的水果之一,风味和营养价值备受人们喜爱,具有巨大的经济效益[1-3]。芒果果实属于呼吸跃变型水果,外形为椭圆,易损伤。大量研究表明低温贮藏可以延迟水果的衰老,将芒果置于在10~15 ℃下,其货架期为3~4周[1,3],但过低的温度容易引起芒果冷害,果皮褐变[4]。ZHANG等对芒果进行低温锻炼(12 ℃预冷24 h),再将芒果置于5 ℃下贮藏,可以有效降低芒果冷害的发生[5]。但这种方法很难商业化,需要在采后运输过程中大量使用冷链。因此,开发常温保藏技术,更具有现实意义。
魔芋葡甘聚糖(konjac glucomannan,KGM)是一种天然多糖,来源于南天星科草本植物魔芋的块茎[6]。KGM具有凝胶性、成膜性、抗菌性、可食用性等多种独特的理化性质,用于涂膜技术可以帮助果蔬减少水分损失,抑制呼吸作用。然而,想要作为理想的果蔬成膜材料,有效延长果蔬保质期,抑制生鲜食品微生物的繁殖,单一KGM涂膜的机械性能和抗菌能力还有不足[7]。
目前,具有机械屏障和抗微生物的纳米材料给采后果蔬保鲜提供了新的包装技术[8]。为进一步改善KGM的理化性质,可以加入一些纳米材料,以改善KGM物理性能,防止微生物入侵,减缓衰老,提高食品外观质量。SiO2无毒,无污染,是我国现行的食品安全国家标准[9]中允许使用的食品加工助剂。将纳米SiO2加入到壳聚糖等生物成膜材料中,可以极大地增强涂膜的抗微生物性能,减少水果的腐烂[10],降低果实褐变,减少丙二醛的生成[11]。因此,KGM/纳米二氧化硅复合材料可以作为果蔬涂膜保鲜的新型生物材料。研究了常温下涂抹KGM/纳米SiO2对芒果品质的影响。
1 材料与方法
1.1 原材料预处理方法
实验所用的芒果采自百色市某果园,桂七品种,绿熟级(100%绿),果实质量在850~900 g之间,表面无破损,采收后立即运回实验室进行预冷处理(12 ℃,24 h),以除去田间热。
1.2 试剂
魔芋葡甘聚糖(分析纯),合肥博美生物科技有限责任公司;纳米SiO2(分析纯),上海阿拉丁生化科技股份有限公司;甘油(分析纯),成都市科龙化工试剂厂;抗坏血酸(分析纯),天津市化学试剂一厂;2,6-二氯酚靛酚(分析纯),国药集团化学试剂有限公司。
1.3 仪器设备
PGX-450B型智能光照培养箱,上海百典仪器设备有限公司;ColorTec-PCM色度计,美国Accuracy Microsensors公司;JJ2000电子称,常熟双杰测试仪器厂;AL204精密电子天平,梅特勒-托利多仪器(上海)有限公司;GY-3硬度计,黑龙江科研社;PR-101α手持式糖度计,日本Atago(爱宕)公司;EL2手持pH计,梅特勒-托利多仪器(上海)有限公司;DS-1高速组织捣碎机,上海精科实业有限公司。
1.4 方法
1.4.1 复合涂膜的制备
在蒸馏水中加入甘油和纳米SiO2,超声波混匀,再边搅拌边缓慢加入魔芋葡甘聚糖,搅拌均匀后水浴加热溶胀,水浴温度50 ℃,时间1 h。取出,用搅拌器搅拌1 min,至均匀不结块为止,即配成不同浓度的复合涂膜溶液。
1.4.2 单因素试验
选取KGM、纳米SiO2、甘油3种试剂分别对芒果进行涂膜保鲜单因素试验,因素使用的质量浓度见表1,每个因素4个水平,以清水处理作为对照组,共13个处理组,每组6个芒果果实。在经1.1处理过的芒果外表皮涂抹上不同浓度的复合涂膜溶液,捞出沥干,放在培养箱中贮藏(25 ℃,相对湿度90%),测定不同处理组的芒果在12 d时的失重率,以此来初步筛选正交试验因素水平的范围。

表1 单因素实验水平表
1.4.3 复合涂膜组合正交试验
在单因素试验结果基础上,进行3因素3水平正交试验,以清水处理作为对照组,共10个处理组。处理组经涂膜后,放置于培养箱中贮藏(25 ℃,相对湿度90%)。每个处理组每3 d随机选取3个果实测定其贮藏期间的理化指标,除色差设5个重复、VC设4个重复外,其余的指标(失重率、硬度、可溶性固形物含量和pH)设3个重复。

表2 正交试验因素及水平编码表 单位:g/L
1.5 测定项目与方法
1.5.1 色差测定[12]
利用色度计进行测定,采用CIE1976L*a*b*色度坐标值来表示测定结果,色差用来表征用测量值和初始值之间果皮色泽的变化程度,公式为:

(1)
式中:L0表示芒果的初始L值;L*表示芒果的第i天测定的L值;a0表示芒果的初始a值;a*表示芒果的第i天测定的a值;b0表示芒果的初始b值;b*表示芒果的第i天测定的b值。
1.5.2 失重率测定[13]
(2)
式中:W0表示芒果的初始质量,g;Wi表示第i天测量的芒果质量,g。
1.5.3 果实硬度的测定[14]
削去芒果果实赤道处的果皮,用GY-3硬度计测定其硬度,单位为0.1 MPa。
1.5.4 可溶性固形物含量(SSC)的测定[13]
采用手持式糖度计测定,数值表示为20 ℃时的质量分数(%)。
1.5.5 pH值测定[15]
取10.0 g芒果果肉和50 mL蒸馏水置于组织捣碎机中捣碎,抽滤后用pH计测定滤液的pH值。
1.5.6 VC的测定[16]
取10.0 g芒果果肉,加入少量20 g/L草酸溶液,磨成匀浆后定容到100 mL容量瓶,抽滤后取10.00 mL滤液用2,6-二氯酚靛酚溶液滴定,根据2,6-二氯酚靛酚滴定消耗量,计算芒果果实中VC的含量,单位为mg/100 g。
1.6 数据分析
采用SPSS 13.0进行因子分析和方差分析,差异显著性分析采用Tukey法,结果以算数平均值表示。
2 结果与分析
2.1 单因素结果分析
由表3可以看出,KGM处理组中,9 g/L浓度的KGM溶液可以明显抑制芒果贮藏过程中失重率。同理,8 g/L纳米SiO2、6 g/L甘油的溶液可以明显抑制芒果贮藏过程中的失重率。因此,确定了KGM、纳米SiO2、甘油这3个因素的最适浓度范围:KGM为8、9、10 g/L,纳米SiO2为6、8、10 g/L,甘油为4、6、8 g/L,采用这几个水平进行正交试验,研究最佳复合涂膜的配方。

表3 单因素试验结果
2.2 复合涂膜组数据的因子分析
由于指标较多,采用因子分析,主成分抽取,最大方差法进行旋转,将多指标转化为少数几个公共因子来对因素之间和各处理组之间的相关关系进行分析。本次试验对采后芒果贮藏12 d的指标进行因子分析,相关数据见表4,试验号10为清水对照组。

表4 正交试验及对照组的数据
由表5和图1的方差解释表和碎石图可以看出,保留特征值大于1的公共因子,前2个公共因子解释了全部方差的83.91%,说明可以用前2公共因子来代替原来的6个指标(色差、失重率、硬度、SSC、pH、VC)对芒果贮藏品质进行评价。对公共因子进行方差最大化正交旋转,得到旋转因子载荷矩阵表(表6)

表5 方差解释表
注:提取因子方法:主成分法;因子旋转方法:方差最大正交旋转法。
和旋转载荷图(图2)。
从表6和图2中可以看出,pH、SSC、硬度在公共因子1上的载荷较大,即与公共因子1的正相关程度较高;色差在公共因子1上的载荷绝对值较大,即负相关程度较高。VC在公共因子2的载荷值较大,即与公共因子2的正相关程度较高;失重率在公共因子2的载荷绝对值较大,即与公共因子2的负相关程度较高。因此,可将公共因子进行如下命名:公共因子1:“pH—SSC—硬度”公共因子;公共因子2:“VC”公共因子。
采后水果pH值的变化趋势一般为先增大后减小:pH值在一定范围内增大,部分原因是由于芒果接近成熟时,有机酸在逐渐减少,pH增大,使芒果有适合的糖酸比,增强芒果风味;后期的减小可能是由于贮藏后期果实腐烂变质,微生物繁殖导致。对于表4的数据来说,所有处理都处于呼吸跃变后或正出在呼吸跃变阶段,芒果的pH值越高,说明其新鲜程度就越高。

图1 碎石图Fig.1 Scree plot

图2 旋转载荷图Fig.2 Component plot in rotated space
表6 旋转成分矩阵
Table 6 Rotated component matrix
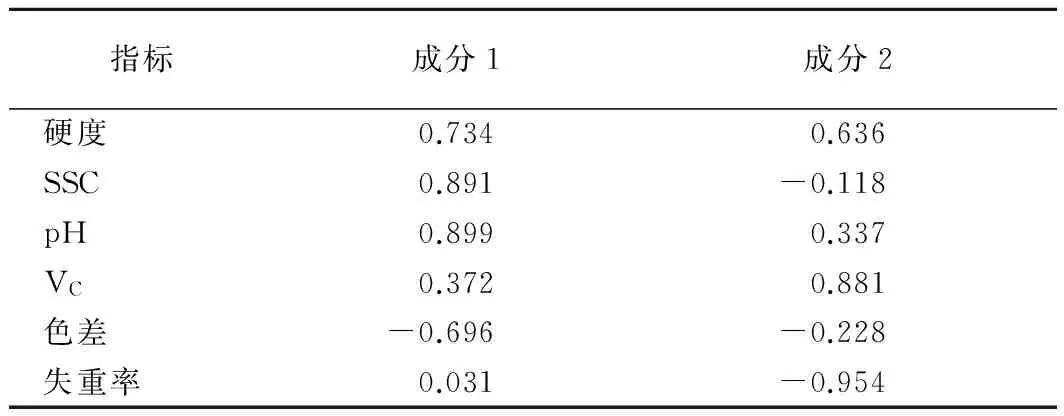
指标成分1成分2硬度0.7340.636SSC0.891-0.118pH0.8990.337VC0.3720.881色差-0.696-0.228失重率0.031-0.954
许多水果的风味大部分取决于SSC含量和成熟果实中可溶性糖的含量,例如草莓的甜度与SSC呈正相关,SSC下降会降低消费者对该水果的可接受程度[17]。果实的成熟是一个不可逆的生理过程,在这个过程前期,水果质量逐渐得到提高,达到最佳可食状态,然后下降,直到水果变得不可食用。SSC在这一过程中,其值逐渐升高,在跃变时达到最大,这一阶段是芒果逐渐进入完熟阶段,淀粉水解,含糖量增加,SSC相应增大;这一阶段之后SSC随之下降,芒果自身代谢消耗能量,因而SSC随之减少。
水果的质构是影响消费者接受程度的重要指标之一。质构与细胞壁结构的物质有关,细胞壁多糖主要由果胶、半纤维素和纤维素等物质组成[18-19]。果实在成熟期间,果胶不断水解,细胞壁中的原果胶含量不断减少,生成水溶性果胶,致使细胞壁完整性被破坏,细胞间隙增加,从而使果实软化,硬度下降[20],果实的软化,意味着果蔬正不断的走向成熟、完熟甚至衰老。
VC是重要的水溶性维生素,具有抗氧化作用[21],天然存在于蔬菜和水果中,不能由人体合成[22-23],生鲜果蔬或者某些VC强化食品就成了日常膳食中VC的主要来源[24]。公共因子2中得分越高,说明VC的含量越高,抗氧化作用越大,营养价值越大,其品质越好。
由此可见,公共因子1可以认为是与芒果风味和质地有关的公共因子,而公共因子2可以认为是与芒果营养有关的公共因子。根据对公共因子的合理定义,接下来进一步分析各处理在2个公共因子上的得分和综合得分。得分表见表7。

表7 因子分析中因子、主成分、综合得分表
在公共因子1(风味质地公共因子)上得分最高的是处理1,得分为2.62,远远高于其他处理。一般来说,pH值在贮藏期间经历了先增高后降低的过程。而因子分析的数据是芒果贮藏12 d时的数据,此时各处理的芒果已经过了或者正处在呼吸峰值,在12 d时维持着较高pH值意味着该处理的芒果的呼吸峰值比其他处理组来得晚,说明了处理1可有效延迟芒果呼吸峰值,延长芒果货架期。同理,处理1中公共因子1的因子得分较高,还意味着处理1的SSC和硬度仍然维持着较高的水平。因此,处理1的芒果在风味和质地上都优于其他处理组。
在公共因子2(营养公共因子)上得分最高的前3个处理分别是:处理2、处理3和处理1,即这3个处理可以较大程度维持采后芒果果实的VC含量。处理10(清水对照组)在公共因子2上的因子得分最低,得分为-1.91,说明用清水处理的芒果不能有效得延缓芒果VC的消耗。
将各处理在2个公共因子上的得分进行加权综合,得到了综合得分,根据综合得分得知,处理1(A1B1C1)的得分最高,说明处理1对保持芒果采后的风味、质地、营养有较突出的作用,因此,处理1是最佳的芒果涂膜保鲜的处理,即:KGM 8 g/L、纳米二氧化硅6 g/L、甘油4 g/L。因子分析的结果与极差分析、方差分析的结果一致。
2.3 最佳涂膜配方对芒果贮藏品质的影响
2.3.1 芒果色泽的变化
色差ΔΕ是果蔬贮藏后的L*、a*、b*与初始的L*、a*、b*之间的差距。ΔΕ越大,说明贮藏过程中果皮颜色变化越大。对照组在贮藏的第3天,色差就和初始值有显著区别(p≤0.05),色差从0增大到11.93;而涂膜组在贮藏第6天时,其色差才与初始值有明显的差异(p≤0.05)。涂膜组在一定程度上抑制了色差的增大,在贮藏后期,涂膜组色差低于对照组,差异显著(p≤0.05)。由此可见,涂膜能抑制芒果果皮色泽的变化,其原因可能有:KGM用于果蔬保鲜,可以有效抑制PPO和POD的活性,延缓酶促褐变反应[25];芒果果皮色差变化加剧的另一个原因是由于真菌等微生物的存在,真菌渗透到芒果果实的生长过程,在芒果采后容易引起芒果炭疽病、蒂腐病等采后病害,在果皮表面生成黑褐色斑点,严重影响果皮的色泽[26-27]。目前,KGM作为抗菌材料的研究十分热门[28-29],而抗菌功能的纳米可食材料无论从安全性还是从解决环境问题而言,都具有十分重要的地位。涂膜组将KGM和纳米SiO2结合使用,抑菌作用得到增强,可有效抑制芒果采后的腐烂。因此,涂膜组的芒果色差变化没有对照组快。
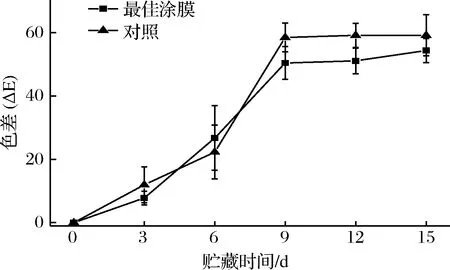
图3 不同处理组芒果的ΔΕ在贮藏过程中的变化Fig.3 Changes in color ΔΕ of different treatments during storage
2.3.2 芒果失重的变化
由图4可以看出,芒果失重率随时间逐渐增加。总体而言,对照组和涂膜组在失重率上有着显著的差异(p≤0.05);对照组在贮藏第3天时,其失重率就与涂膜组的失重率有显著差异(p≤0.05),前者失重率比后者增长了1.14个百分比。和对照组相比,涂膜组的失重率增长的速率较慢。贮藏到第18天时,对照组的失重率高达18.49%,而在整个贮藏期间,涂膜组的失重率一直维持在10%以下。果蔬的失重主要有2方面的原因,一是水分蒸腾作用,二是离体果蔬自身的呼吸消耗;前者占较大比例。表皮内存在大量的气孔、皮孔等自然孔洞,水分可以通过孔洞进行蒸腾作用[30]。对照组由于是清水处理,芒果表面自然孔洞进行着蒸腾作用,因而失重率极高。最佳涂膜组做了涂膜处理,由于KGM/纳米SiO2具有良好的成膜性,可以作为食品和水果保鲜的成膜材料,降低果实表面孔洞的蒸腾作用,从而延缓果实的失重。
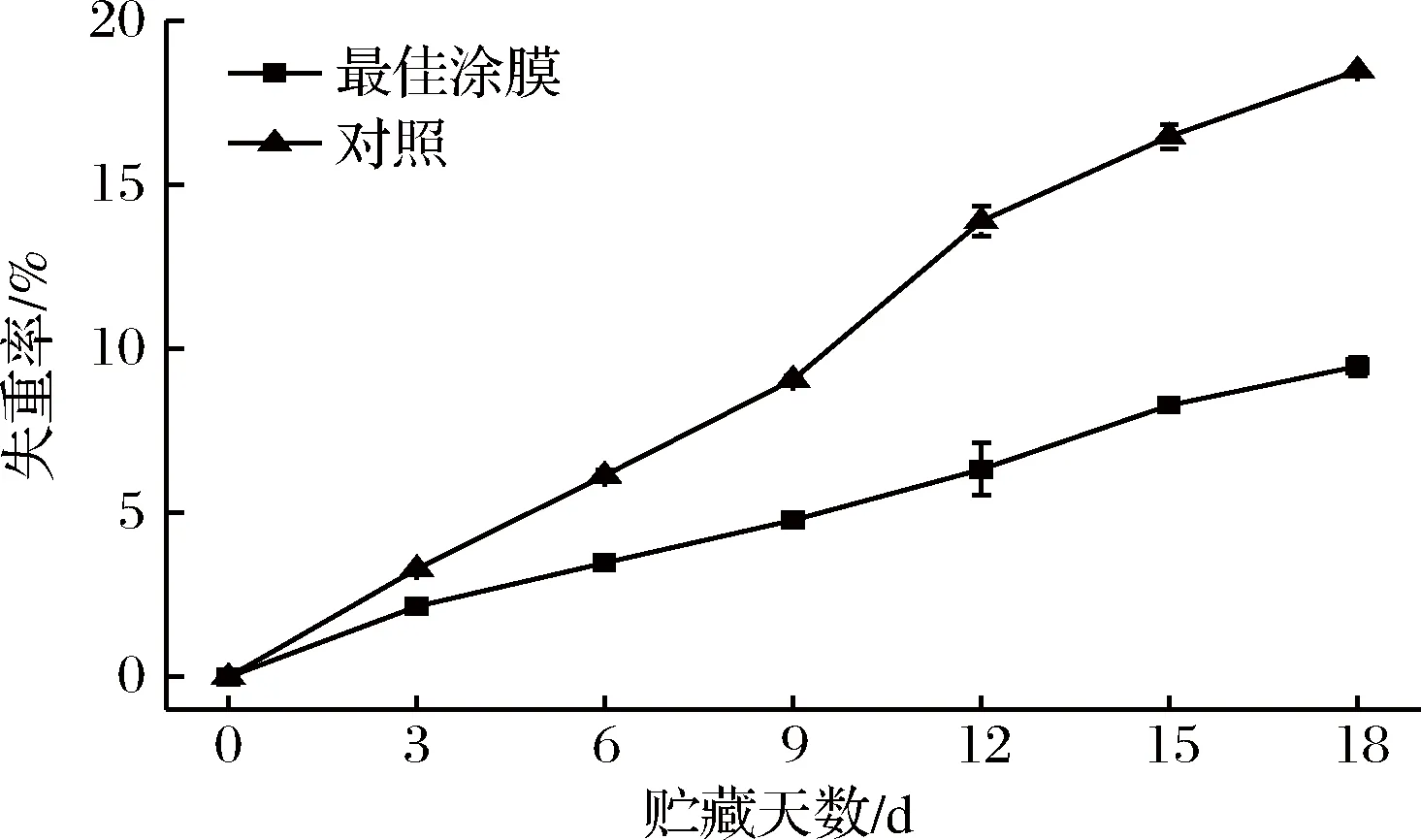
图4 不同处理组芒果的失重在贮藏过程中的变化Fig.4 Changes in weight loss of different treatments during storage
2.3.3 芒果硬度的变化
由图5可知,对照组在贮藏第3天时,硬度下降的程度就达到了显著差异(p≤0.05),下降了14.00%;而涂膜组在第3天时硬度下降没有显著差异。从整个贮藏阶段来看,涂膜组的硬度总体比对照组的要大,其下降趋势比对照组要平缓,贮藏12 d时,对照组的硬度小于0.05 MPa,硬度计已无法读数。果实的软化主要是由于果实内的原果胶被多种水解酶水解导致[31],涂膜除了有效抑制芒果的失水,还能在芒果果皮表面形成低氧高二氧化碳的微环境,降低氧气浓度,可以抑制果蔬的呼吸作用,削弱芒果的新陈代谢,降低了与芒果硬度相关酶的活性,从而延缓了芒果果实的软化。
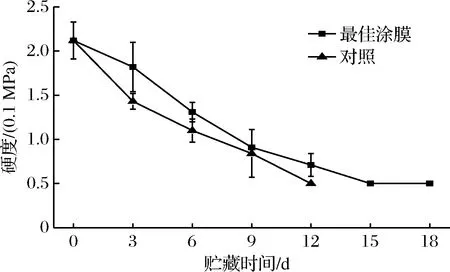
图5 不同处理组芒果的硬度在贮藏过程中的变化Fig.5 Changes in firmness of different treatments during storage
2.3.4 芒果可溶性固形物含量(SSC)的变化
由图6可知,SSC经历了一个先上升后下降的过程。芒果属于呼吸跃变型果实,在贮藏过程中,其淀粉、纤维素等多糖降解转化为可溶性糖,贮藏前期SSC会有所上升。贮藏后期,SSC下降是由于芒果新陈代谢的消耗。在贮藏12 d时,对照组与涂膜组的差异显著(p≤0.05),这有可能是因为对照组在12 d时,已达到呼吸峰值。所以涂膜可以延缓其呼吸峰值的出现时间,这对芒果采后商品化很重要。涂膜组可以推迟SSC达到峰值的时间,在贮藏15 d时,其SSC仍然维持着较高的水平,其SSC是15 d对照组的1.47倍。这一现象在WANG等的研究中也得到证实[32]。
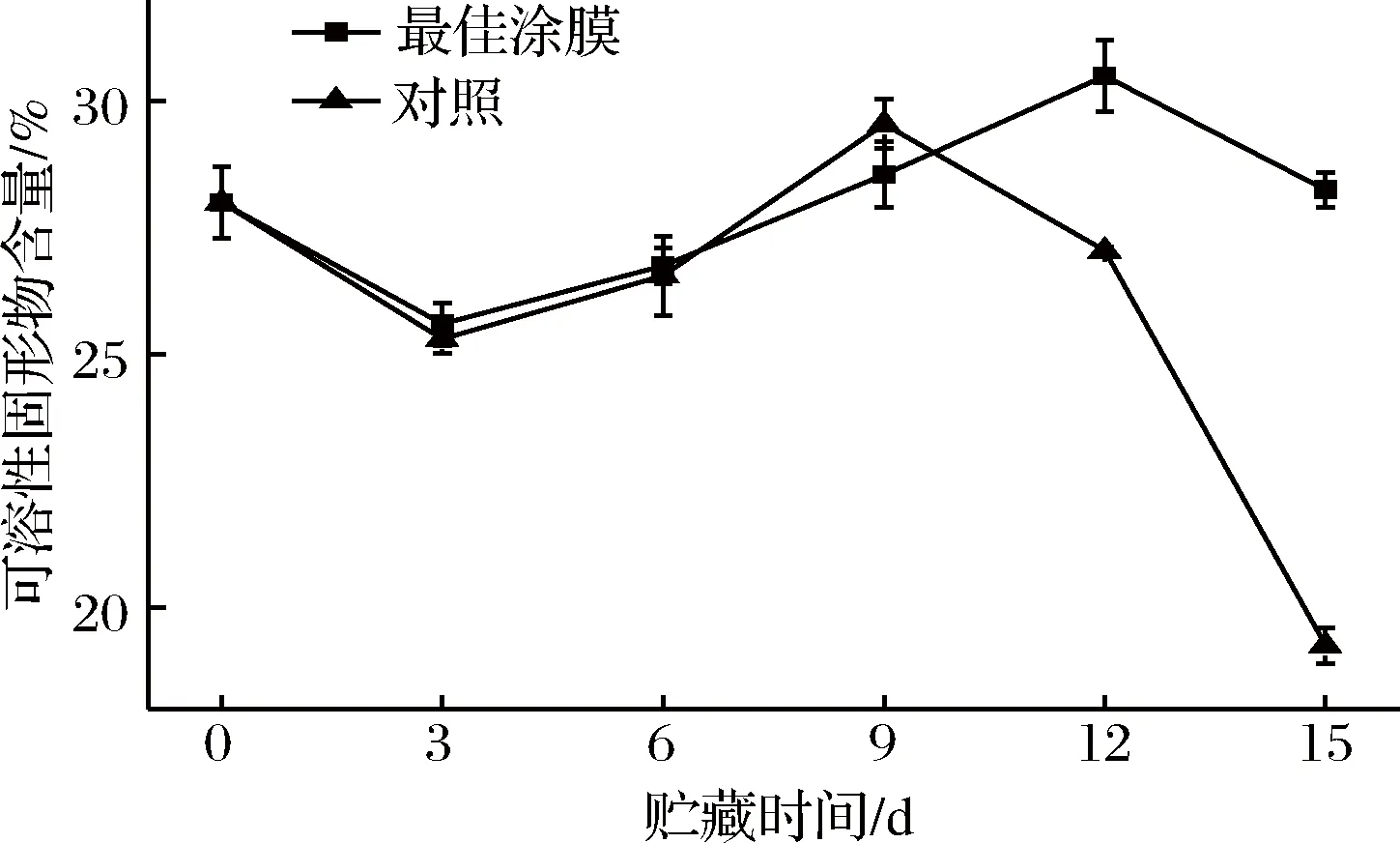
图6 不同处理组芒果的SSC在贮藏过程中的变化Fig.6 Changes in SSC of different treatments during storage
2.3.5 芒果pH的变化
由图7可知,在贮藏第3天,对照组的pH就比涂膜组增大了8.47%。整个贮藏期内,涂膜组pH增大的速率较缓慢,且涂膜组在数值上与对照组显著差异(p≤0.05),说明与对照组相比,涂膜在一定程度上抑制了pH值的增大,这意味着延缓了芒果呼吸跃变,从而延长芒果货架期。

图7 不同处理组芒果的pH值在贮藏过程中的变化Fig.7 Changes in pH of different treatments during storage
2.3.6 芒果VC含量的变化
从图8可知,芒果VC经历了先上升后下降的过程,在第9 d后,对照组VC含量下降的程度和涂膜组的下降程度有显著差异(p≤0.05),和涂膜组相比,对照组VC已下降了80.62%。当第12天时,对照组的VC含量降至最低,结合前面的分析,第9天可能是对照组的呼吸峰值期间,一旦过了跃变点,芒果果实进入衰老阶段,VC含量降至3.17 mg/100 g;而12天时,涂膜组的VC含量还维持在16.37 mg/100 g的水平。由此可见,涂膜组维持VC含量的效果较好。

图8 不同处理组芒果的VC在贮藏过程中的变化Fig.8 Changes in VC of different treatments during storage
3 结论
在25 ℃下,采用单因素试验和正交试验研究不同涂膜处理对芒果品质的影响,通过因子分析(主成分提取,最大方差法旋转),将6个芒果采后品质指标(色差、失重率、硬度、SSC、pH、VC)提取为2个公共因子成分,并分别把他们定义为芒果风味和质地公共因子、芒果营养公共因子,通过对2个公共因子的分析可知,在25 ℃下,芒果保鲜最佳涂膜配方为:KGM 8 g/L、纳米SiO26 g/L、甘油4 g/L。
KGM/纳米SiO2涂膜处理过的芒果,其色差的变化没有对照组剧烈,在一定程度上延缓了芒果衰老,果皮的褐变也得到抑制;KGM/纳米SiO2涂膜对芒果失重的抑制效果十分特出,失重率维持在10%以下;从贮藏初期就显著维持芒果果实的硬度,延缓了芒果果实的软化;涂膜对芒果SSC、pH和VC的影响体现在涂膜有效推迟了芒果的呼吸跃变,使SSC、pH和VC在贮藏中后期还维持着较高的水平。
[1] BRECHT J K, SARGENT S A, KADER A A, et al. Mango postharvest best management practices manual[J]. Gainesville: Univ. of Fla. Horticultural Sciences Department, 2010, 78.
[2] JHA S N, JAISWAL P, NARSAIAH K, et al. Authentication of mango varieties using near-infrared spectroscopy[J]. Agricultural Research, 2013, 2(3): 229-235.
[3] PRUSKY D, FUCHS Y, KOBILER I, et al. Effect of hot water brushing, prochloraz treatment and waxing on the incidence of black spot decay caused byAlternariaalternatain mango fruits[J]. Postharvest Biology and Technology, 1999, 15(2): 165-174.
[4] CHONGCHATUPORN U, KETSA S, VAN DOORN W G. Chilling injury in mango (Mangiferaindica) fruit peel: Relationship with ascorbic acid concentrations and antioxidant enzyme activities[J]. Postharvest Biology and Technology, 2013, 86: 409-417.
[5] ZHANG Zheng-ke, ZHU Qing-gang, HU Mei-jiao, et al. Low-temperature conditioning induces chilling tolerance in stored mango fruit[J]. Food Chemistry, 2017, 219: 76-84.
[6] 覃海强,林伟泉,麦馨允. 响应面法优化超声波辅助提取魔芋葡甘聚糖的工艺[J]. 轻工科技,2016(12):16-19.
[7] CHEN Jian-guang, LIU Chang-hua, CHEN Yan-qing, et al. Structural characterization and properties of starch/konjac glucomannan blend films[J]. Carbohydrate Polymers, 2008, 74(4): 946-952.
[8] SILVESTRE C, DURACCIO D, CIMMINO S. Food packaging based on polymer nanomaterials[J]. Progress in Polymer Science, 2011, 36(12): 1 766-1 782.
[9] GB 2760—2014, 食品添加剂使用标准[S].北京:中国标准出版社,2014.
[10] DHANASINGH S, MALLESHA J, HIRIYANNAIAH J. Preparation, characterization and antimicrobial studies of chitosan/silica hybrid polymer[J]. Biointerface Res Appl Chem, 2011, 1(2): 48-56.
[11] SHI Sheng-you, WANG Wei, LIU Li-qin, et al. Effect of chitosan/nano-silica coating on the physicochemical characteristics of longan fruit under ambient temperature[J]. Journal of Food Engineering, 2013, 118(1): 125-131.
[12] AN Jian-shen, ZHANG Min, LU Qi-rui, et al. Effect of a prestorage treatment with 6-benzylaminopurine and modified atmosphere packaging storage on the respiration and quality of green asparagus spears[J]. Journal of Food Engineering, 2006, 77(4): 951-957.
[13] 麦馨允,胡长鹰. 气调包装对杨桃贮藏品质的影响[J]. 食品与发酵工业,2012,38(6):213-218.
[14] CHIN L H, ALI Z M, LAZAN H. Cell wall modifications, degrading enzymes and soften of carambola fruit during ripening[J]. Journal of Experimental Botany, 1999, 50: 767-775.
[15] GB/T 10468—1989. 水果和蔬菜产品pH值的测定方法[S]. 北京: 中国标准出版社, 1989.
[16] 曹建康, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007.
[17] KEUTGEN A, PAWELZIK E. Modifications of taste-relevant compounds in strawberry fruit under NaCl salinity[J]. Food Chemistry, 2007, 105(4): 1 487-1 494.
[18] ROECK A D, SILA D N, DUVETTER T, et al. Effect of high pressure/high temperature processing on cell wall pectin substances in relation to firmness of carrot tissue[J]. Food Chemistry, 2008, 107: 1 225-1 235.
[19] ROSLI H G, CIVELLO P M, MARTI′NEZ G A. Changes in cell wall composition of three Fragaria x ananassa cultivars with different softening rate during ripening[J]. Plant Physiology and Biochemistry, 2004, 42(10): 823-831.
[20] CYBULSKA J, PIECZYWEK P M, ZDUNEK A. The effect of Ca2+and cellular structure on apple firmness and acoustic emission[J]. European Food Research and Technology, 2012, 235(1): 119-128.
[21] LEONG S Y, BURRITT D J, HOCQUEL A, et al. The relationship between the anthocyanin and vitamin C contents of red-fleshed sweet cherries and the ability of fruit digests to reduce hydrogen peroxide-induced oxidative stress in Caco-2 cells[J]. Food Chemistry, 2017, 227: 404-412.
[22] CHEBROLU K K, JAYAPRAKASHA G K, YOO K S, et al. An improved sample preparation method for quantification of ascorbic acid and dehydroascorbic acid by HPLC[J]. LWT-Food Science and Technology, 2012, 47(2): 443-449.
[23] VALENTE A, SANCHES-SILVA A, ALBUQUERQUE T G, et al. Development of an orange juice in-house reference material and its application to guarantee the quality of vitamin C determination in fruits, juices and fruit pulps[J]. Food Chemistry, 2014, 154(3): 71-77.
[24] ROIDOUNG S, DOLAN K D, SIDDIQ M. Estimation of kinetic parameters of anthocyanins and color degradation in vitamin C fortified cranberry juice during storage[J]. Food Research International, 2017, 94: 29-35.
[25] SUPAPVANICH S, PRATHAAN P, TEPSORN R. Browning inhibition in fresh-cut rose apple fruit cv. Taaptimjaan using konjac glucomannan coating incorporated with pineapple fruit extract[J]. Postharvest Biology and Technology, 2012, 73(3): 46-49.
[26] KOBILER I, SHALOM Y, ROTH I, et al. Effect of 2, 4-dichlorophenoxyacetic acid on the incidence of side and stem end rots in mango fruits[J]. Postharvest Biology and Technology, 2001, 23(1): 23-32.
[27] PRUSKY D, ESHEL D, KOBILER I, et al. Postharvest chlorine treatments for the control of the persimmon black spot disease caused by Alternaria alternata[J]. Postharvest Biology and Technology, 2001, 22(3): 271-277.
[28] XIAO Chao-bo, GAO Shan-jun, ZHANG Li-na. Blend films from konjac glucomannan and sodium alginate solutions and their preservative effect[J]. Journal of Applied Polymer Science, 2000, 77(3): 617-626.
[29] LU Jun, WANG Xiao-dan, XIAO Chao-bo. Preparation and characterization of konjac glucomannan/poly (Diallydimethylammoniumchloride) antibacterial blend films[J]. Carbohydrate Polymers, 2008, 73(3): 427-437.
[30] 罗云波. 果蔬采后生理与生物技术[M]. 北京: 中国农业出版社, 2010.
[31] ROSE J K C, CATALC, GONZALEZ-CARRANZA Z H, et al. Plant Cell Wall Disassembly. In: The Plant Cell Wall (ed., Rose J K C) [M]. Oxford: Blackwell Publishing, 2003: 264-324.
[32] WANG Yanp-eng, SHAN You-xia, CHEN Jun-wei, et al. Comparison of practical methods for postharvest preservation of loquat fruit[J]. Postharvest Biology and Technology, 2016, 120: 121-126.
