Cocl2诱发急性化学缺氧对非酒精性脂肪肝小鼠的影响
2018-02-28张学松张谢叶桦宋毓飞
张学松 张谢 叶桦 宋毓飞
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是一种常见的慢性肝脏疾病,其发病机制复杂,通常为遗传、环境、代谢、应激作用的结果[1-2]。早期研究显示,NAFLD与机体内胰岛素耐受性密切相关,同时西方饮食、高饱和脂肪、高果糖在NAFLD发病中也起到了重要的作用,过多的TG在肝细胞中堆积是其重要的发病机制之一[3]。肝脏脂肪化、血管受压等导致肝组织缺血、缺氧,可进一步引起肝细胞变性坏死、肝脏纤维组织增生,从而引起组织的代谢、功能和形态结构发生异常[4]。成纤维细胞生长因子21(FGF21)是近年来新发现的、由肝脏分泌的一类内分泌样生长因子,通过调节机体的葡萄糖、脂质代谢,从而在人体中发挥着重要作用[5]。前期研究显示,FGF21在NAFLD患者体内明显上调,同时与肝脏内脂肪含量高度相关[6],但FGF21在NAFLD小鼠体内的具体作用机制尚未明确。本研究采用高脂饮食建立NAFLD小鼠模型,同时采用化学缺氧剂二氯化钴(Cocl2)进行诱导,观察急性缺氧对NAFLD小鼠的影响,并初步探讨FGF21的作用机制。
1 材料和方法
1.1 材料及仪器
1.1.1 实验动物 雄性C57BL/6小鼠30只,SPF级,体重18~22g,由温州医科大学动物实验中心提供[合格证号:SCXK(浙)2015-0001],在温州医科大学动物实验中心分笼饲养。
1.1.2 主要试剂 小鼠FGF21 ELISA试剂盒(广州百为生物技术有限公司);三色染色试剂盒(上海源叶生物技术有限公司);Cocl2(美国sigma公司);Trizol(美国Invitrogen公司,货号:15596018);M-MLV 逆转录试剂盒(美国Invitrogen公司,货号:18080400);血糖试剂盒(宁波普瑞柏生物技术有限公司,货号:GL8360);TG试剂盒(美国 Beckman Coulter公司,货号:OSR61118);TC试剂盒(美国Beckman Coulter公司,货号:OSR6216E);ALT试剂盒(美国Beckman Coulter公司,货号:OSR6107);Masson三色染色试剂盒(北京索莱宝科技有限公司,货号:G1340);c-Jun 氨基末端激酶(JNK)抗体(美国R&D公司,货号:AF1387);p-JNK抗体(美国R&D 公司,货号:AF1205)、FGF21抗体(美国 santa cruz公司,货号:sc-81946)、X-盒-结合蛋白-1(XBP-1)抗体(美国 santa cruz公司,货号:sc-7160)、GAPDH 抗体(美国 santa cruz公司,货号:sc-47724)、鼠抗兔二抗(美国santa cruz公司,货号:sc-2358)驴抗兔二抗(美国santa cruz公司,货号:sc-2315)。
1.1.3 主要仪器 全自动生化分析仪(AU5400型,美国Beckman Coulter公司);显微镜(ECLPSE 80i型,日本Nikon公司);高速冷冻离心机(micro21R型,美国Thermo Fisher公司);超纯水(Direct-Q3 型,美国 Millipore公司)。
1.2 方法
1.2.1 动物分组及模型制备 将30只实验小鼠分为正常饮食组(control组,给予基础饲料喂养8周)、高脂饮食组(HFD组,给予高脂饲料喂养8周,热量比为碳水化合物35%+脂肪51%+蛋白质14%)、高脂饮食+Cocl2缺氧处理组(HFD+Cocl2组,给予高脂饲料喂养8周后,在小鼠腹腔注射60mg/kg的Cocl2作用24h),每组10只。经上述处理后,小鼠饥饿过夜,通过心脏穿刺的方法收集血样后处死,收集其肝脏组织。
1.2.2 血清生化指标检测 采用全自动生化分析仪检测小鼠血清中空腹血糖、TG、TC、ALT水平,采用ELISA试剂盒检测小鼠血清中FGF21含量,具体操作按照试剂盒说明书进行。
1.2.3 肝脏组织学染色 处死小鼠后,取各组小鼠相同部位的肝脏组织,10%甲醛溶液固定,石蜡包埋,5μm切片,作HE染色及三色染色。
1.2.4 Q-PCR法检测肝脏相关基因的表达 Trizol法提取肝脏组织中的RNA,取1μg的RNA进行逆转成cDNA后进行扩增,同时设定RN18s作为内参对照,mFGF21 上游引物为 5′-CTGGGGGTCTACCAAGCATA-3′,下游引物为 5′-CACCCAGGATTTGAATGACC-3′。
1.2.5 Western bolt法检测相关蛋白的表达 按蛋白裂解液说明书抽提蛋白,BCA法测定总蛋白浓度,蛋白变性后行SDS-PAGE电泳,湿转法到PVDF膜上,加3%BSA封闭液,室温下孵育 2h,加FGF21、p-JNK、JNK、XBP-1、GAPDH 一抗(1∶1 000),4℃封闭过夜,弃一抗,Tris-HCl缓冲盐溶液+吐温(TBST)洗 3 遍。加 1∶10 000的二抗,室温孵育2h后,弃二抗,TBST洗3遍。增强化学荧光发光法显影,曝光。
1.3 统计学处理 应用GraphPad 5.0统计软件。计量资料用表示,组间比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 高脂饮食及Cocl2处理后对小鼠体征指数及代谢的影响 HFD组小鼠喂养8周后,体重、肝脏重量、肝脏体重比及血清中空腹血糖、TC均较control组明显增加,差异均有统计学意义(均P<0.05),见图1a-c。Cocl2处理后小鼠体重、肝脏重量、肝脏体重比及血清中空腹血糖、TG、TC均高于control组,差异均有统计学意义(均P<0.05);其中血清中TG高于HFD组(P<0.05),见图1d-f。
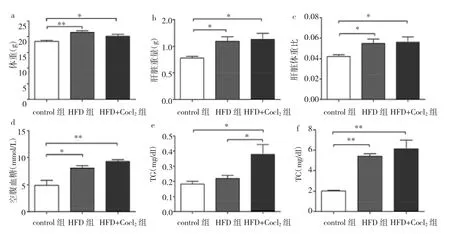
图1 3组小鼠体征指数及代谢指标的比较(*P<0.05,**P<0.01)
2.2 高脂饮食及Cocl2处理后对小鼠肝脏组织形态学的影响 HE染色结果:与control组比较,HFD组、HFD+Cocl2组小鼠肝脏内脂质大量堆积,可见大量脂肪空泡,见图2a-c。三色染色结果:与control组比较,HFD组、HFD+Cocl2组小鼠肝脏血管腔内纤维化均明显增多,见图 2d-f。
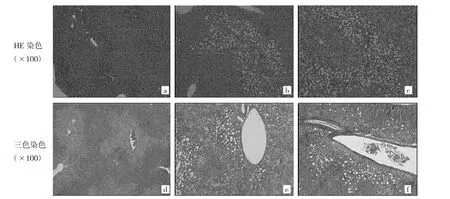
图 2 3 组小鼠肝脏组织形态学比较(a、d:control组;b、e:HFD 组;c、f:HFD+Cocl2组)
2.3 高脂饮食及Cocl2处理后对小鼠肝脏损伤及炎症因子表达的影响 与control组比较,HFD组、HFD+Cocl2组小鼠血清中肝脏损伤因子ALT水平、炎症因子基质金属蛋白酶抑制剂-1(TIMP-1)mRNA表达水平均明显升高(均P<0.05),且HFD+Cocl2组均高于HFD组(均 P<0.05),见图 3a-b。control组、HFD 组、HFD+Cocl2组小鼠缺氧诱导因子1α(HIF-1α)mRNA表达水平两两比较,差异均无统计学意义(均P>0.05),见图3c。
2.4 高脂饮食及Cocl2处理后小鼠FGF21表达的影响 ELISA结果显示,与control组比较,HFD组小鼠血清FGF21水平升高,经Cocl2处理后血清FGF21水平进一步升高,差异均有统计学意义(均P<0.01),见图4a;肝脏组织FGF21 mRNA及蛋白表达变化与血清水平趋势相同,见4b-c。
2.5 高脂饮食及Cocl2处理小鼠后对内质网应激信号通路的影响 Western blot结果显示,与control组比较,HFD组p-JNK及XBP-1蛋白表达明显增多,HFD+Co- cl2组表达进一步增强,见图5。

图3 3组小鼠血清ALT及肝脏组织TIMP-1、HIF-1α mRNA表达水平的比较(*P<0.05,**P<0.01)
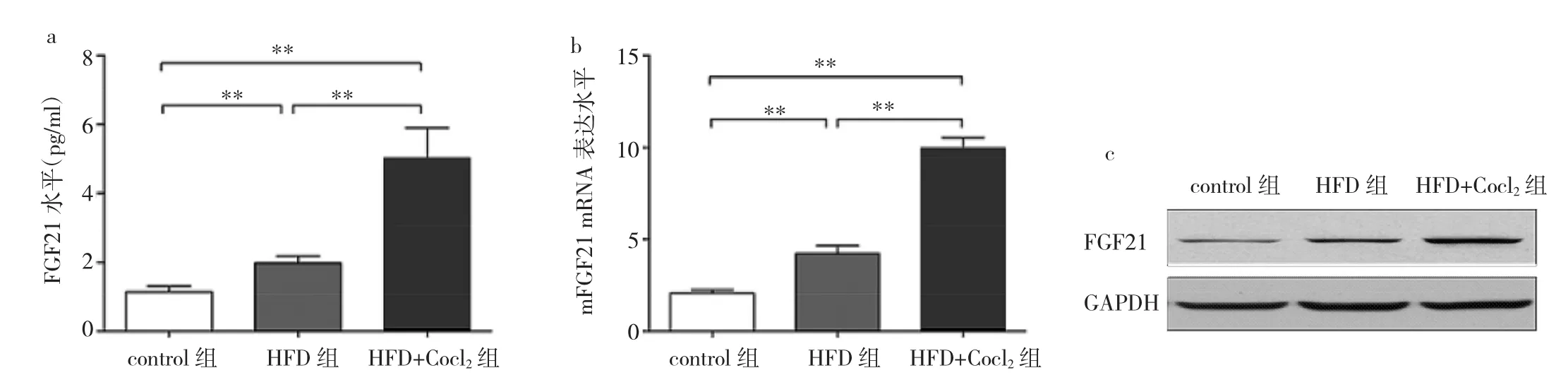
图4 3组小鼠血清FGF21及肝脏组织FGF21 mRNA表达水平及蛋白电泳图的比较(*P<0.05,**P<0.01)
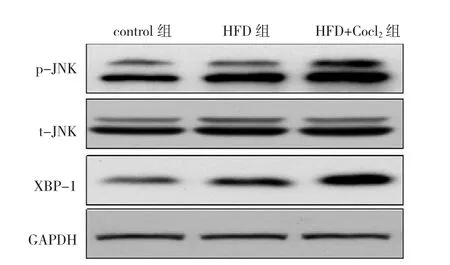
图5 3组小鼠肝脏JNK、XBP-1信号通路的电泳图比较
3 讨论
NAFLD的发病机制存在较多争议,目前普遍被接受的是“多次打击”学说,涉及到脂肪毒性、氧化应激、内质网压力、慢性炎症状态和线粒体功能障碍等[7-8]。肝脏细胞内质网应激诱导的脂类代谢障碍被认为是NAFLD发病机制的重要基础。低氧环境被认为是内质网应激的一个重要诱导因素,但关于诱导的机制目前仍未明确[9-10]。本研究结果显示,与control组比较,HFD组、HFD+Cocl2组小鼠炎症因子TIMP-1 mRNA表达均明显上调,内质网应激相关蛋白p-JNK、XBP-1表达均明显增加,但HIF-1α mRNA表达不明显,可能与缺氧时间较短有关。因此,笔者推测体内的炎症诱导其内质网应激,而内质网应激反应可能是缺氧诱导脂类代谢障碍的另一条调控途径,但具体作用机制有待进一步探索。
FGF21是FGFs家族中目前发现的唯一没有促有丝分裂的基因,具有内分泌因子的功能,同时参与机体物质代谢,并维持机体脂肪和糖代谢的平衡[11-12]。Kharitomenkov等[13]证实FGF21在灵长类动物中具有代谢调控功能,同时还发现FGF21具有调控脂蛋白的功能,在治疗动脉粥样硬化中具有重要作用。目前有文献报道FGF21与肝脏疾病存在一定关系:Gaemers等[14]的动物实验结果表明高脂流体饮食诱导的NAFLD小鼠肝脏中FGF21 mRNA明显增高;Li等[15]临床研究报道肝损伤患者外周血中FGF21水平明显升高,与AST、谷氨酰转肽酶均相关。本研究结果表明HFD组小鼠呈现出明显的脂肪肝病变状况,血清FGF21水平、肝脏组织FGF21 mRNA及蛋白表达均明显升高;提示急性缺氧加重了NAFLD小鼠的肝脏损伤,进一步上调了FGF21的表达。因此,笔者推测小鼠体内FGF21水平升高对机体可能是一种反馈性的保护作用,它与小鼠肝脏损伤严重程度密切相关。
[1]Stickel F,Hampe J.Genetic determinants of alcoholic liver dis-ease[J].Gut,2012,61(1):150-159.
[2]Neuschwander-Tetri BA.Non-alcoholic fatty liver disease[J].BMC Med,2017,15(1):45.
[3]Reccia I,Kumar J,Akladios C,et al.Non-alcoholic fatty liver disease:Asign ofsystemic disease[J].Metabolism,2017,72:94-108.
[4]Tan TC,Crawford DH,Jaskowski LA,et al.Altered lipid metabolism in Hfe-knockout mice promotes severe NAFLD and early fibrosis[J].Am J Physiol Gastrointest Liver Physiol,2011,301(5):G865-876.
[5]Xie T,Leung PS.Fibroblast growth factor 21:a regulator of metabolic disease and health span[J].Am J Physiol Endocrinol Metab,2017,313(3):E292-E302.
[6]Yan H,Xia M,Chang X,et al.Circulating fibroblast growth factor 21 levels are closely associated with hepatic fat content:A cross-sectionalstudy[J].PLoS One,2011,6(9):e24895.
[7]Liu J,Xu Y,Hu Y,et al.The role of fibroblast growth factor 21 in the pathogenesis of non-alcoholic fatty liver disease and implications for therapy[J].Metabolism,2015,64(3):380-390.
[8]Takahashi Y,Fukusato T,Inui A,et al.Pediatric nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J].Nihon Rinsho,2012,70(10):1827-1834.
[9]Kong B,Cheng T,Wu W,et al.Hypoxia-induced endoplasmic reticulum stress characterizes a necrotic phenotype of pancreatic cancer[J].Oncotarget,2015,6(31):32154-32160.
[10]Liu S,Xin D,Wang L,et al.Therapeutic effects of L-Cysteine in newborn mice subjected to hypoxia-ischemia brain injury via the CBS/HS system:Role of oxidative stress and endoplasmic reticulum stress[J].Redox Biol,2017,13:528-540.
[11]Lin X,Liu YB,Hu H.Metabolic role of fibroblast growth factor 21 in liver,adipose and nervous system tissues[J].Biomed Rep,2017,6(5):495-502.
[12]Habegger KM,Stemmer K,Cheng C,et al.Fibroblast growth factor 21 mediates specific glucagon actions[J].Diabetes,2013,62(5):1453-1463.
[13]Kharitonenkov A,Wroblewski VJ,Koester A,et al.The metabolic state of diabetic monkeys is regulated by fibroblast growth factor-21[J].Endocrinology,2007,148(2):774-781.
[14]Gaemers IC,Stallen JM,Kunne C,et al.Lipotoxicity and steatohepatitis in an overfed mouse model for non-alcoholic fatty liver disease[J].Biochim Biophys Acta,2011,1812(4):447-458.
[15]Li H,Bao Y,Xu A,et al.Serum fibroblast growth factor 21 is associated with adverse lipid profiles and gamma-glutamyltransferase but not insulin sensitivity in Chinese subjects[J].J Clin EndocrinolMetab,2009,94(6):2151-2156.
