人结直肠癌组织中CDCA7表达水平与临床意义分析*
2018-02-23李思漫黄杰安覃蒙斌张金秀
李思漫 黄杰安 覃蒙斌 张金秀 廖 存
(1广西医科大学第一附属医院消化内科 广西南宁 530021;2广西医科大学第二附属医院消化内科 广西南宁530007;3广西医科大学第一附属医院结直肠肛门外科 广西南宁 530021)
结直肠癌是发病率和死亡率均较高的恶性肿瘤之一,它在癌症死亡疾病谱中占据重要位置,为人类癌症相关死亡的主要原因之一[1-2]。 2015年统计数据显示,我国男性结直肠癌发病率居所有恶性肿瘤第2位,女性居第4位;男性结直肠癌死亡率高居所有恶性肿瘤第3位,女性居第2位[3]。由于目前人们行癌症早期筛查意识不足及结直肠癌早期缺乏明显的临床症状,许多患者首次就诊即被诊断为进展期结直肠癌[4]。此外,尽管肿瘤一经发现即行手术切除治疗及予以术后放化疗治疗,许多患者术后仍会出现肿瘤复发和转移,结直肠癌患者的生存预后往往不佳[5]。因此,探索结直肠癌的发生发展机制并寻找潜在的治疗靶点对结直肠癌的诊疗和改善生存预后有重要意义。
细胞周期失调通常会导致肿瘤的发生[6-7]。细胞分裂周期相关蛋白7(CDCA7,也称为JPO1)最初在转染了Myc基因的成纤维细胞中被发现,其是一种参与肿瘤转化的Myc反应基因[8],位于人类染色体2q31,其所编码的由371个氨基酸组成的核蛋白CDCA7在细胞周期中呈周期性表达,并在G1至S期表达最高[9]。据报道,CDCA7在人类多种恶性肿瘤中呈高表达,如淋巴瘤、卵巢癌、视网膜母细胞瘤、乳腺癌、急性髓性白血病和食管癌[10-16],因此,可以推测CDCA7与肿瘤之间可能存在密切关系。本研究旨在分析CDCA7在结直肠癌组织中的表达水平和初步探讨其临床意义,以期为寻找结直肠癌治疗潜在靶点提供实验室依据,现报告如下。
1 材料与方法
1.1 一般资料 以2012年10月至2013年11月于广西医科大学第一附属医院接受结直肠癌根治术的105例结直肠癌患者为研究对象,纳入标准:(1)经术后病理学诊断为结直肠腺癌,且为首次确诊;(2)患者临床资料完整。排除标准:(1)术前已行放化疗的患者;(2)同时合并有其他恶性肿瘤或有恶性肿瘤病史。研究对象中男性62例,女性43例;年龄26~82岁,平均年龄(56.53 ±12.86)岁;肿瘤大小<5 cm者64例,肿瘤大小≥5 cm者41例;肿瘤浸润黏膜层(T1)17例,肌层及肌层以下 (≥T2)88例;TNM分期Ⅰ~Ⅱ期55例,Ⅲ~Ⅳ期50例;淋巴结转移39例;远处转移15例。每位患者另取距离癌肿10 cm处的正常黏膜组织标本各一份。本研究经过医院伦理委员会审核并通过。
1.2 主要试剂 CDCA7多克隆抗体 (Thermo公司,美国),免疫组化SP试剂盒(北京中杉金桥公司,中国),DAB显色试剂盒购自武汉博士德生物工程有限公司,柠檬酸抗原修复液和苏木素购自索莱宝生物公司。
1.3 CDCA7表达的检测及阳性判定标准 采用SP免疫组织化学染色法检测结直肠癌组织及正常结直肠黏膜组织中CDCA7的表达。组织标本均经10%福尔马林浸泡固定,经浸蜡包埋后制成4μm厚连续切片。结肠组织切片常规脱蜡、脱水,以 0.01 mol/L枸橼酸高压修复6 min,然后用3%H2O2室温孵育15 min,以磷酸盐缓冲液(PBS)洗3次,每次5 min,正常山羊血清室温封闭15 min后,滴加一抗(CDCA7浓度为1:100),置于湿盒中4℃孵育过夜,24 h后在室温中复温1 h,PBS洗3次,每次5 min,DAB显色5 min,然后行苏木素染色,最后使用中性树胶封片。阳性对照由北京博奥森生物技术有限公司和北京中杉金桥生物技术有限公司提供,用磷酸盐缓冲液(PBS)代替一抗作为阴性对照 (其余步骤同上)。用Olympus显微镜及显微摄像仪对染色组织切片进行观察,以细胞膜/细胞质/细胞核中出现明显的黄色或黄褐色颗粒为SP免疫组化染色阳性,综合染色强度及阳性细胞数比例进行半定量分析。根据免疫阳性细胞染色程度进行评分(A):无染色为0分;胞膜、胞质或胞核内见淡黄色颗粒计1分;较多棕黄色颗粒计2分;大量棕黄色颗粒计3分。每片随机观察5个视野,计算染色阳性细胞所占比例 (B):阳性细胞数<5%计0分,5%~25%计1分,26%~50%计2分,>50%计3分。 A与B相加为其最后得分,0分判为“-”,1~2分判为“+”,3~4分判为“++”,5~6分判为“+++”,以“-”和“+”定义为阴性表达、“++”和“+++”定义为阳性表达。
1.4 统计学方法 应用 SPSS 20.0统计软件对数据进行统计学分析。计量资料采用()表示;计数资料以(n)表示,采用χ2检验或 Fisher确切概率法进行比较。以P<0.05为差异有统计学意义。
2 结 果
2.1 结直肠癌组织与正常结直肠黏膜组织的SP免疫组化染色结果及CDCA7蛋白阳性表达率的比较CDCA7蛋白在两种组织中的细胞核和细胞质中均有表达,细胞质和细胞核中均出现了明显的黄褐色颗粒(即SP免疫组化染色阳性),见图1。结直肠癌组织与正常结直肠黏膜组织的CDCA7阳性表达率分别为80.00%(84/105)、56.19%(59/105),组间差异有统计学意义(χ2=13.699,P=0.000)。
2.2 CDCA7的表达与结直肠癌患者临床病理特征的关系 CDCA7表达水平与结直肠癌患者肿瘤浸润深度、分化程度、TNM临床分期、淋巴结转移和远处转移有关,差异均有统计学意义(均P<0.05)。见表1。
3 讨 论
结直肠癌是人类常见的消化道恶性肿瘤,是人类肿瘤相关致死的主要原因之一。分子生物学研究表明[17],许多癌基因、抑癌基因通过直接或者间接的作用最终导致细胞周期的异常,致使肿瘤细胞无限制地自主分裂和增殖,与此同时,肿瘤细胞分裂周期相关蛋白出现代谢紊乱甚至直接参与了肿瘤细胞的分裂活动。在肿瘤细胞的恶性增殖过程中,常伴随有原癌基因的激活以及肿瘤细胞内大量周期蛋白的调控失衡[18],而细胞周期控制失调往往易导致恶性肿瘤的发生。
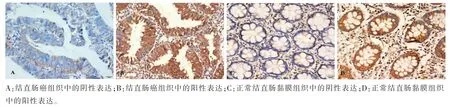
图1 CDCA7在结直肠癌组织及正常结直肠黏膜组织中的表达(×400,SP)
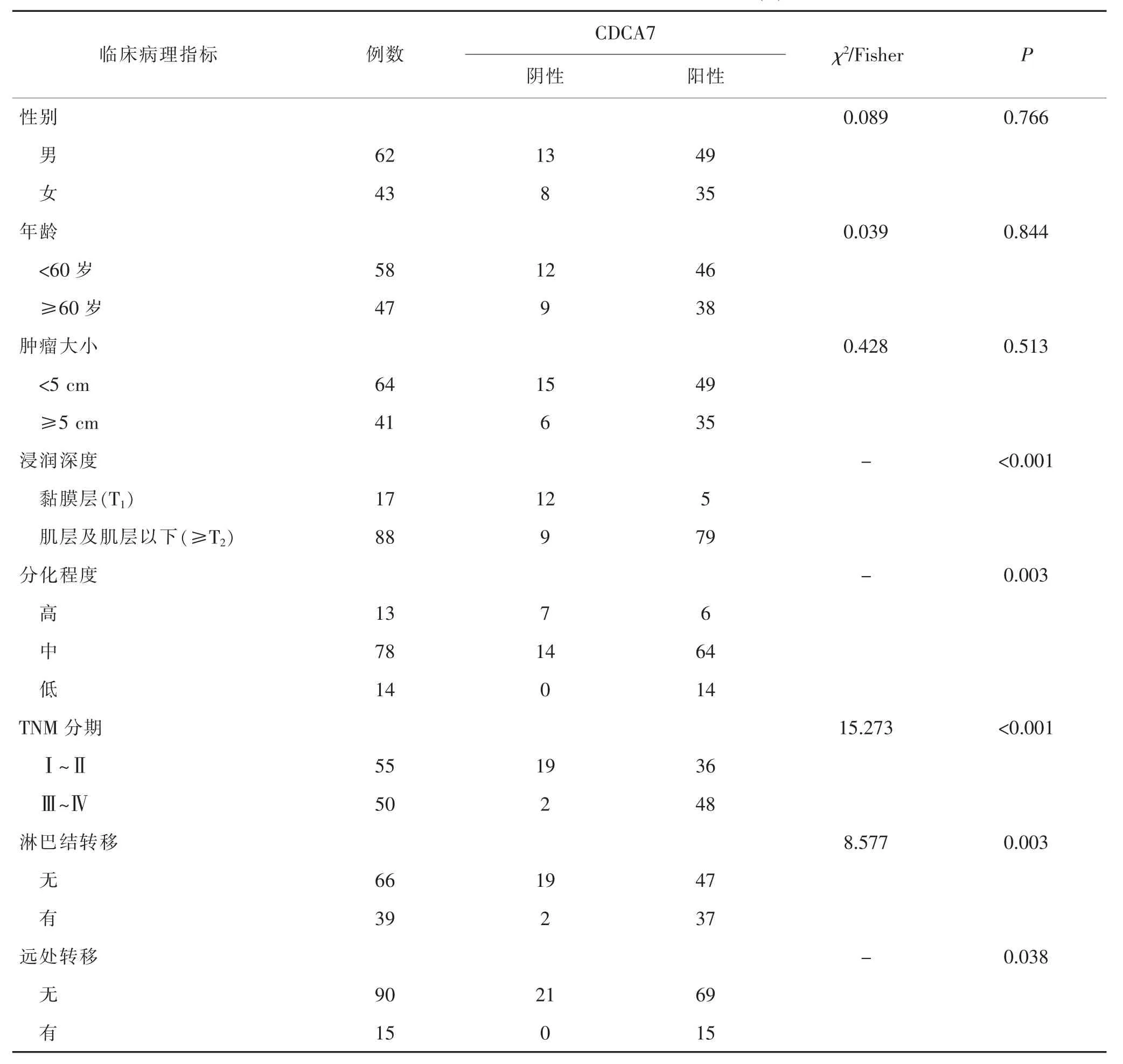
表1 CDCA7的表达水平与临床病理特征的关系(n)
Myc基因家族属于核蛋白类调控基因,其基因产物Myc蛋白在多种人类肿瘤中高表达,Myc蛋白通过诱导有丝分裂影响细胞周期进程从而影响了肿瘤细胞的增殖过程[19]。 CDCA7被证实为Myc依赖性的转录调控靶基因,二者相互关联,CDCA7转录调控的失调与Myc所介导的肿瘤发生有关[20],提示作为与Myc相关联的CDCA7可能也参与了肿瘤的发生与发展。有研究显示CDCA7是一种分子大小为47-kD的核蛋白[8],但本研究免疫组化SP染色法结果显示CDCA7在结直肠癌组织和正常结直肠黏膜组织的细胞核和细胞质中均可见表达,可能是因为不同的组织中CDCA7的激活状态不同,使得CDCA7在细胞内发生了核转移和胞质转移。本研究结果显示结直肠癌组织中CDCA7阳性表达率高于癌旁正常黏膜组织,与已有研究结果相符[10,13-16],且其阳性表达与结直肠癌的肿瘤浸润深度、分化程度、TNM分期、是否发生淋巴转移及远处转移有关,提示CDCA7可能参与了结直肠癌的发生发展,抑制CDCA7的表达或有望成为防治结直肠癌的新靶点,CDCA7的表达水平或可为疾病的诊治与预后评估提供一定参考依据。但本研究仅局限于临床标本的表达检测,CDCA7与结直肠癌的发生发展关系以及具体作用机制尚未明了,需要今后对CDCA7进行更全面更深入的研究。
综上所述,CDCA7在人结直肠癌组织中阳性表达率高于正常结直肠黏膜组织,其表达水平与结直肠癌患者肿瘤浸润深度、分化程度、TNM临床分期、淋巴结转移和远处转移有关,CDCA7可能参与了结直肠癌的发生发展及侵袭转移过程。
