VM与E-cad在人卵巢上皮癌组织中的表达及意义
2018-02-22张永生
张永生
(河南省漯河市郾城区人民医院病理科 漯河462000)
卵巢恶性肿瘤为常见的女性生殖器官肿瘤,卵巢上皮癌为其中的常见类型,因其内分泌机制较为复杂,早期患者症状多不明显,发现时多已发生转移,恶性程度相对较高,且目前发病机制尚不明确,同时缺乏诊断该疾病敏感性和特异性的方法[1]。相关研究认为[2],明确卵巢上皮癌发生发展过程中的生物标志物及分子机制,在提高卵巢上皮诊断率及病情进展监测上,具有重要的临床意义。血管生成拟态(Vasculogenic Mimicry,VM)为内皮细胞未参与下细胞表型出现自身变形和基质重塑,继而形成特有的微循环管道,可促进癌细胞侵袭和转移。E-钙黏蛋白为重要的黏附因子,是血管生成拟态结构中,癌细胞与癌细胞之间、癌细胞与基质间黏附的关键要素,与癌细胞的生物学行为关系密切[3]。故选取我院收治卵巢病变患者的卵巢上皮组织切片为研究对象,旨在分析VM与E-cad在人卵巢上皮癌组织中的表达及意义,为卵巢上皮癌的病情监测及预后判断提供一定的临床依据。现报道如下:
1 资料与方法
1.1 临床资料 选取我院2016年8月~2018年2月收治的110例卵巢病变患者卵巢上皮组织切片为研究对象,其中卵巢上皮癌86例,卵巢上皮良性肿瘤24例。卵巢上皮癌患者年龄37~78岁,平均(52.10±7.83)岁;卵巢上皮良性肿瘤患者年龄36~73岁,平均(51.93±7.52)岁。比较两组临床资料,无显著性差异(P>0.05),具有可比性。本研究经我院医学伦理委员会审核批准。
1.2 入组标准 纳入标准:均经病理组织确诊卵巢病变,且接受手术治疗者;患者及其家属均知晓参与本研究,并自愿签署知情同意书。排除标准:非上皮卵巢肿瘤者;入院前已行手术治疗或入院后手术接受其它治疗者。
1.3 检测方法 (1)分别选取5张切片,1张进行HE染色,1张进行E-钙黏蛋白(E-cad)免疫组化染色,1张进行CD34-PAS染色,1张使用PBS液进行阴性对照组,1张备用。(2)HE染色:将切片放于载玻片上于60℃烤箱中过夜烘干,随后放入二甲苯溶液1、2中浸泡10 min,再放入酒精溶液中进行梯度水化,于流动水下冲洗干净,进行苏木素染色2 min、1%盐水酒精中进行分化数秒、1%氨水返蓝数秒、伊红染色,酒精脱水,二甲苯溶液透明,随后封片,晾干,于显微镜下进行观察。(3)免疫组化染色:同HE染色水化后,使用pH值7.4~7.6的PBS液浸泡3次,每次持续5 min,过蒸馏水,放入沸腾的柠檬酸抗原修复液中继续加热(210℃加热至冒气后调至130℃中加热2.5 min),加热锅外冷水降温20 min,过蒸馏水,室温下进行去离子阻断,PBS冲洗,滴加养血清进行封闭,随后进行一抗、二抗、DAB显色、苏木素染色、盐酸分化、氨水返蓝、酒精脱水、二甲苯溶液透明,封片,晾干,于显微镜下进行观察。(4)CD34-PAS染色:在DAB显色后于镜下观察内皮细胞CD34着色后,立即给予流动水冲洗,蒸馏水水洗,滴加PAS,再次冲洗、过蒸馏水后滴加Schiff试剂恒温反应15 min,随后冲洗、苏木素染色、盐酸分化、氨水返蓝、酒精脱水、二甲苯溶液透明,封片,晾干,于显微镜下进行观察并进行结果判定。
1.4 观察指标及判定标准 观察两组VM、E-cad表达情况,分析VM、E-cad表达与卵巢上皮癌患者临床病理资料的关系。判定标准:CD34阳性颗粒分布于血管内皮细胞膜中,PAS阳性呈紫红色,表达于血管壁基膜,镜下观察CD34阴性癌细胞围成PAS阳性基膜样不规则血管样结构,且周围无炎性细胞、无出血坏死,即可判定为VM;E-cad阳性颗粒表达与细胞膜/浆中,采用半定量积分法进行判定,其中棕褐色3分、棕黄色2分、淡黄色1分、不显色0分,高倍镜下10个视野阳性细胞比例为0计0分,为 1%~10%计1分,11%~50%计 2分,51%~80%计3分,80%以上计4分,前后积分相加,总分0~3分为阴性表达,3分以上为阳性表达[4]。
1.5 统计学方法 采用SPSS20.0软件进行数据分析,计数资料以%表示,行χ2检验,计量资料行t检验,用(±s)表示,相关性分析采用Spearman相关系数,同时采用Logistic回归进行多因素分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 VM、E-cad表达情况 卵巢上皮癌组织中,VM阳性表达率为58.14%(50/86),阴性表达率为41.86%(36/86),E-cad 阳 性 表 达 率 为 47.67%(41/86),阴性表达率为 52.33%(45/86);卵巢上皮良性肿瘤组织中,VM阳性表达率为0.00(0/24),阴性表达率为 100.00%(24/24),E-cad阳性表达率为79.17%(19/24),阴性表达率为 20.83%(5/24)。两组VM、E-cad阳性表达率比较,有显著性差异,P<0.05。
2.2 卵巢上皮癌组织中VM、E-cad阳性表达与病理参数的关系 VM、E-cad阳性表达与肿瘤直径、病理类型等参数无明显关系,差异不显著,P>0.05;在肿瘤分期、分化程度、淋巴及腹腔转移等参数方面,在肿瘤分期越高,分化程度越低,有淋巴及腹腔转移的情况下,VM阳性表达越高,E-cad阳性表达越低,差异显著,P<0.05。且经Spearman相关分析,VM阳性表达与E-cad阳性表达呈明显负相关,r=-0.674,P<0.05。见表 1。
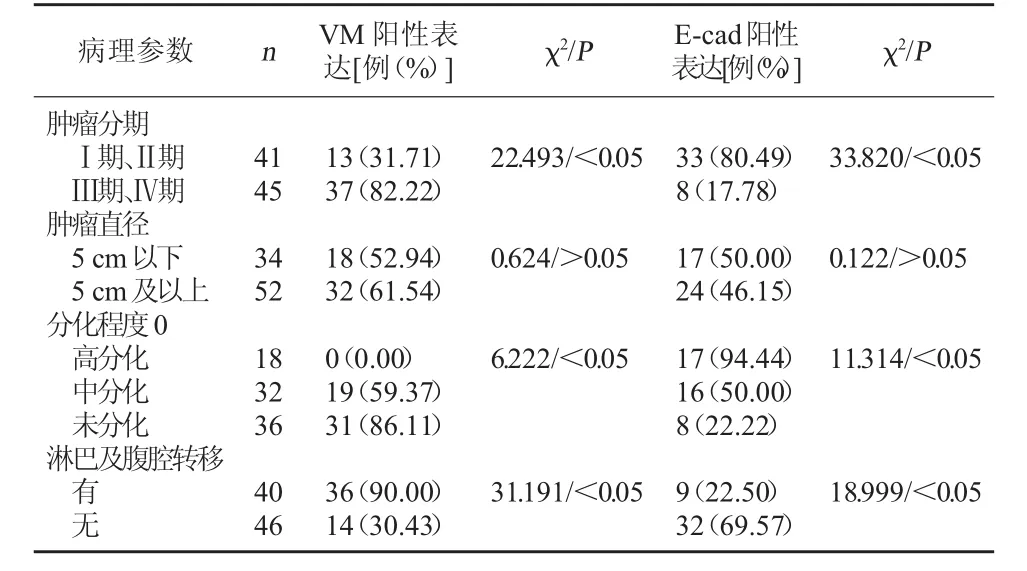
表1 卵巢上皮癌组织中VM、E-cad表达与病理参数的关系
2.3 Logistic多因素分析 将单因素分析存在显著差异的因子导入Logistic回归模型中进行多因素分析,发现 VM 阳性表达(or=3.976,95%CI1.326~9.820,P<0.05)、E-cad阳性表达(or=0.571,95%CI0.237~0.918,P<0.05)、肿瘤分期(or=7.604,95%CI2.286~19.335,P<0.05)、淋巴及腹腔转移(or=4.625,95%CI1.389~12.517,P<0.05)为卵巢上皮癌疾病进展的独立危险因素。
3 讨论
卵巢癌的肿瘤血管生成包括血管生成、血管形成、血管生成拟态三种方式,肿瘤新生血管与其恶性生物学行为密切相关。VM由侵袭性癌细胞围成,癌细胞与血流之间仅隔有一层PAS阳性基底膜样物,由于缺少血管内皮细胞屏障,癌细胞很容易在自身释放的蛋白水解酶和血流冲击下,穿透PAS阳性基底膜样物进入血液中,成为癌组织的功能性微循环,在肿瘤侵袭和转移中发挥关键作用。相关研究显示[5],VM阳性表达卵巢上皮癌患者更容易发生血行转移,且生存周期较VM阴性表达患者低。E-cad为钙离子依赖性跨膜蛋白,基因定位于16q221,为上皮细胞标志物及重要的黏附因子,在胚胎发育、细胞分化、形态学及维持上皮极性与完整性方面具有重要作用,其异常表达为分子离散的基础,E-cad表达降低,细胞间黏附松散,细胞内骨架的固定作用降低,有自身变形能力,促进VM形成,是VM发生的重要机制之一[6]。本研究结果显示,卵巢上皮癌组织中,VM具有较高的阳性表达率,E-cad具有较低的阳性表达率;在肿瘤分期越高,分化程度越低,有淋巴及腹腔转移的情况下,VM阳性表达越高,E-cad阳性表达越低,且二者呈显著负相关,有显著性差异,P<0.05;VM、E-cad阳性表达、肿瘤分期、淋巴及腹腔转移为卵巢上皮癌疾病进展的独立危险因素。综上所述,VM与E-cad在人卵巢上皮癌组织中存在明显的异常表达,且与肿瘤分期、淋巴及腹腔转移共为卵巢上皮癌疾病进展的独立危险因素,可作为预后判断的客观指标。
