基于GSS高通量测序技术的怀山药根、茎中内生真菌群落多样性分析
2018-02-10李守婷申进文文春南麻兵继
刘 元,李守婷,申进文,文春南,文 晴,阮 元,麻兵继*
(河南农业大学 a中药材系,b生物系,河南 郑州 450002)
怀山药(DioscoreaoppositaThunb)为“四大怀药”之一,是河南著名的道地药材,具有健脾益胃、生津益肺、补肾涩精等功效[1]。目前,对怀山药的研究多集中在栽培技术、化学成分和药理研究等方面[2-3],而关于怀山药与其内生真菌的关系方面的研究则较少。本课题组前期对怀山药道地产区——河南焦作温县一带的怀山药根中内生真菌进行了初步分离纯化研究,并对其中一株内生真菌厚孢镰刀菌进行了化学成分的研究,结果表明怀山药内生真菌能产生丰富的次生代谢产物[4]。虽然中药材内生菌和药材质量之间存在密切联系,相关研究文献也较多[5-6],但有关怀山药内生真菌与药材品质之间的关联性目前尚未见文献报道。因此,在整体水平上对怀山药植株内生真菌群落结构进行分析,有利于进一步阐明内生真菌与怀山药道地性的关联,从而为更好地开发利用怀山药优良品质奠定基础。另外,传统的真菌分类鉴定主要依照真菌的形态、生长以及生理生化等特征进行研究。然而真菌的种类繁多,个体差异性不明显,且其生长、生理生化特征也会随着环境的变化而发生改变。因此,采用传统方法对中药材内生真菌进行正确的分离纯化、分类鉴定均存在较大的困难。近年来随着分子生物学技术的发展,核酸序列分析已被广泛的应用于真菌分类鉴定中,目前常用的分子标记为内转录间区(internal transcribed spacer,ITS),可根据ITS序列将真菌归类到种或亚种水平[7]。
高通量测序技术(high throughput sequencing,HTS)具有高通量、高灵敏度、高准确性和低运行成本的特点,该测序技术已被应用于多种生态系统的微生物多样性研究[8]。高通量测序可以深入、细致地研究微生物群落结构,从而克服由于传统菌株分离培养的限制而导致很难获得宿主植物完整内生真菌谱的技术障碍,近年来已应用于多个中药材道地性的研究[9-10]。GSS高通量测序(green shield sequencing,GSS)是基于目前最常用的Illumina高通量测序技术上最新改进的一种测序技术,采用了液滴PCR技术。与普通的Illumina高通量测序技术相比,GSS高通量测序可以从源头上消除宿主植物样本中叶绿体和线粒体序列带来的干扰,还原样本中微生物群体的真实比例。本次测序合作单位北京艾普希隆生物科技有限公司的实验数据表明,运用该方法所测定的真菌测序量占样本总测序量的比例最高可升至 99.7%(水稻叶片),这为建立完整、可靠、稳定和准确的怀山药道地药材内生真菌标准的谱图库提供了技术保障。
1 材料与方法
1.1 样品采集
2016年10月于河南焦作温县怀山药道地产区采集10株无明显病害的怀山药,分别随机取根部和茎部,均匀混合后放入无菌样品袋中,低温保鲜,于24 h内进行表面消毒处理。
1.2 表面灭菌
将怀山药根、茎用无菌水冲洗干净,再用75%乙醇浸泡1~2 min,3%次氯酸钠浸泡2~3 min,75%乙醇清洗30 s,最后用无菌水冲洗5次,用无菌滤纸吸干表面水分。表面消毒效果检验参照文献[11]中的方法。
1.3 样本DNA提取与纯化
使用环境样本DNA提取试剂盒进行基因组DNA提取后,使用0.8%琼脂糖凝胶电泳检测DNA的纯度和浓度。
1.4 ITS区的PCR扩增
以稀释后的基因组DNA为模板,使用带有Barcode的特异引物ITS3(5′-GATGAAGAACGYAGYRAA-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对样本的ITS区域进行扩增,每个样本进行3次重复,每个PCR反应终止于线性扩增期,PCR结束后将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用OMEGA胶回收试剂盒切胶回收PCR产物,TE缓冲液洗脱回收目标DNA片段。送北京艾普希隆生物科技有限公司对真菌的ITS区进行Paired-end测序,测序使用Illumina(MiSeq)平台。
1.5 生物信息学分析
双端测序得到的PE reads使用FLASH进行拼接,同时对序列质量进行质控,在去除低质量碱基及接头污染序列等操作过程结束后完成数据过滤,得到可供后续分析的高质量目标序列。在97%的相似性水平上使用UPARS算法进行OTU的聚类,统计样品每个OTU中的丰度信息,OTU的丰度初步说明了样品的物种丰富程度。
1.6 多样性分析
在群落生态学的研究中,物种多样性包括Alpha多样性(群落内)和Beta多样性(群落间)。其中Alpha多样性是指群落内或栖息地内的物种多样性,通过样本的Alpha多样性分析可以反映微生物群落的丰度、均匀性及多样性等信息。Alpha多样性分析包括一系列生态统计学分析指数,如计算香农指数(Shannon index)、Chao1指数、Simpson指数、系统发育多样性指数(phylogenetic diversity,PD)等进行生物多样性分析[11]。丰富度指数(Chao1)和Shannon、Simpson、PD的计算用Mothur1.30.1软件完成。
2 结果与分析
2.1 怀山药根茎和茎中内生真菌物种组成
物种组成分析反映样品在不同分类学水平上的内生真菌群落结构。图1中A和B分别展示了怀山药内生真菌在门(phylum)水平和纲(class)水平的群落结构和分类比较结果。从门水平来看,怀山药根和茎中内生真菌主要分布在子囊菌门(Ascomycota),仅有少量分布于担子菌门(Basidiomycota)。从纲分类水平来看,其内生真菌主要分布在座囊菌纲(Dothideomycetes)、锤舌菌纲(Leotiomycetes)、粪壳菌纲(Sordariomycetes)中,少量分布在伞菌纲(Agaricomycetes)、散囊菌纲(Eurotiomycetes)中。怀山药根和茎中真菌菌群分布有差异,其中茎中子囊菌门占真菌菌群的92.0%,而根中子囊菌门约占真菌菌群的97.4%。另外,盘菌纲(Pezizomycetes)真菌在茎中存在而根中没有,而酵母菌(Saccharomycetes)为根中特有菌。
选取丰度最高的50个操作单元(OTUs)与NCBI数据库中基因序列进行Blast比对,相似物种(相似度在97%以上)及GenBank登录号如图2所示。进化树将丰度最高的50个OTUs进行展示,其中Hannaellasp.(KY305135)为怀山药根中特有,丰度值为102;Hannaellasp.(KT962991)、Acremoniumsp.(KY988552)、Aspergillussp.(KY407901)为怀山药茎中特有,其丰度值分别为65、89和56;Rhodosporidiumsp.(KF690377)、Ceratobasidiumsp.(KX953590)、Ochroconisconstricta(KX610329)、Fusariumsp.(KY950388)、Botryotiniafuckeliana(KX096661)、Passalorasp.(JX507956)为根和茎共有,但根中丰度值明显高于茎;Hannaellasp.(KX758406)、Hannaellasp.(KX758405)、Derxomycessp.(KY588901)、Bulleraunica(KY101799)、Rhodotorulasp.(KY033113)和Glomerellacingulata(AB696727)为根和茎共有,但茎中丰度值明显高于根。
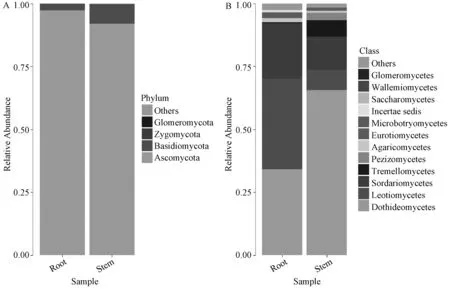
图1 怀山药根、茎样品中内生真菌群落分布
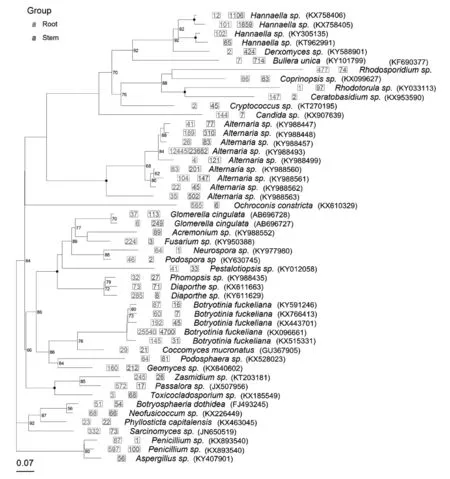
图2 种水平内生真菌的系统发育树
2.2 怀山药根和茎中内生真菌生物多样性
2.2.1 单个样品复杂性
根和茎的Alpha多样性分析的Shannon指数、Chao 1指数、PD和物种数4个指数见图3所示。丰富度以Chao 1表示,多样性以Shannon 指数表示,检测到的物种的数量以Observed表示,系统发育谱系多样性以PD表示,结果均为茎大于根。综合各项指标显示,怀山药根中的物种丰富度和多样性等均略低于茎。

图3 样品的Alpha 多样性
2.2.2 稀释曲线
稀释曲线表明每个样品物种的丰富度,用来反映测序情况。分别使用观测到的物种数(Observed)、Chao 1及Shannon指数进行稀释曲线的制作。如图4所示,对不同的样本分别进行分析,颜色代表不同样本,横坐标代表重抽样抽出的序列数,纵坐标代表不同的多样性值。从稀释曲线来看,随着测序数量的增加,稀释曲线斜率逐渐降低,趋向平缓但未进入平台期,说明测序数据合理,基本覆盖样品中所有种群,即使再增加测序数量也只会产生少量新的OTUs。
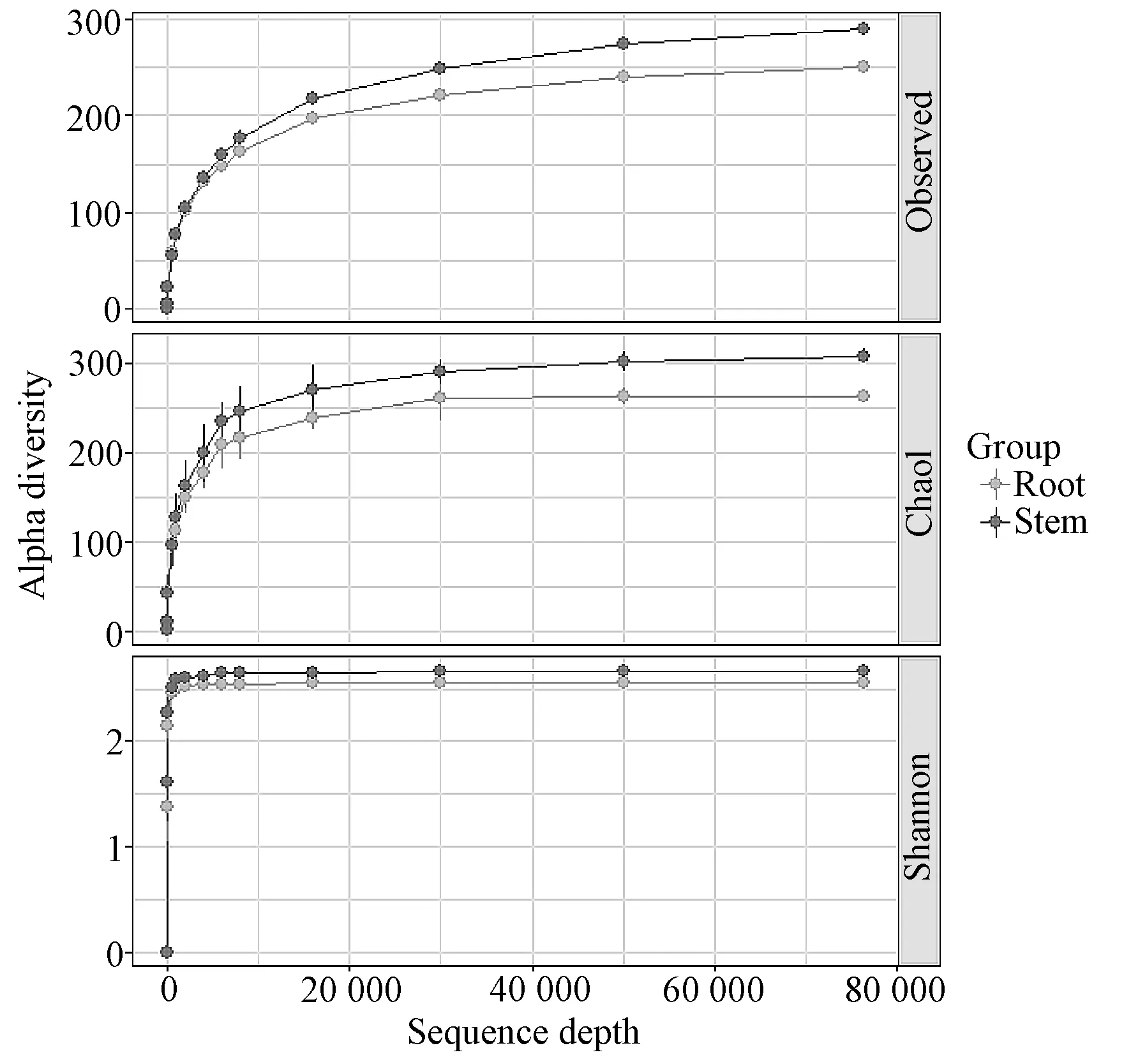
图4 怀山药根、茎样品的稀释曲线
2.2.3 Rank abundance 曲线
Rank abundance曲线可以解释多样性的两个方面,即物种丰度和物种均匀度。在水平方向,物种的丰度由曲线的宽度来反映,物种的丰度越高,曲线在横轴上的范围越大;曲线的形状(平滑程度)反映了样本中的物种的均度,曲线越平缓,物种分布越均匀。由图5可知,样品曲线斜率较大,表明怀山药根和茎中均有优势菌,这也与图1中的分析结果一致。从水平方向,两个样品在横轴上跨度即分类丰富度基本相当。
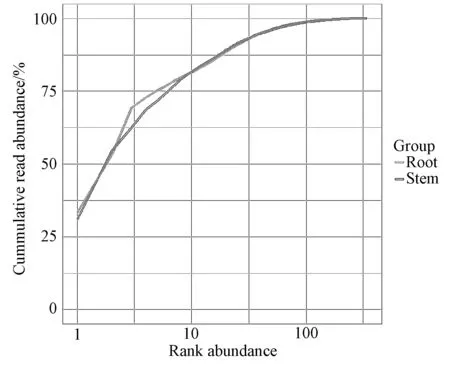
图5 怀山药根、茎样品的Rank abundance曲线
热度图(Heatmap)用于表示一个或多个组的样品在某一分类水平上的群落组成和丰度。丰度用颜色深浅来表征,方块颜色越偏红,说明该种的丰度越高,越偏蓝色说明丰度越低。可根据丰度和组成进行聚类,也可按照特定的顺序进行横纵坐标的排列。由图6可知,在种水平上,怀山药根中丰度最高的为担子菌门葡萄孢盘菌属灰色霉菌(Botryotiniafuckeliana),茎中丰度最高的为链格孢属一个未知种的(Alternariasp.)。
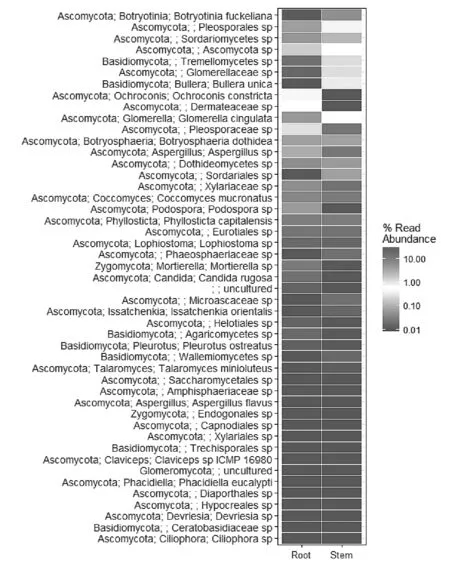
图6 种水平高丰度类群热度
2.2.4 Venn图
在OTU分析中,Venn用于表示多个组样品的OTU共有和独有物种情况。由图7可知,根中特有的OTU为35个,茎中特有的OTU为75个,根和茎共有的OTU为233个。Venn图在一定程度上反映出两个样品中内生真菌群落组成的相似程度,表明根和茎中相同的种类占多数,且怀山药茎中内生真菌物种多样性程度略高于根。
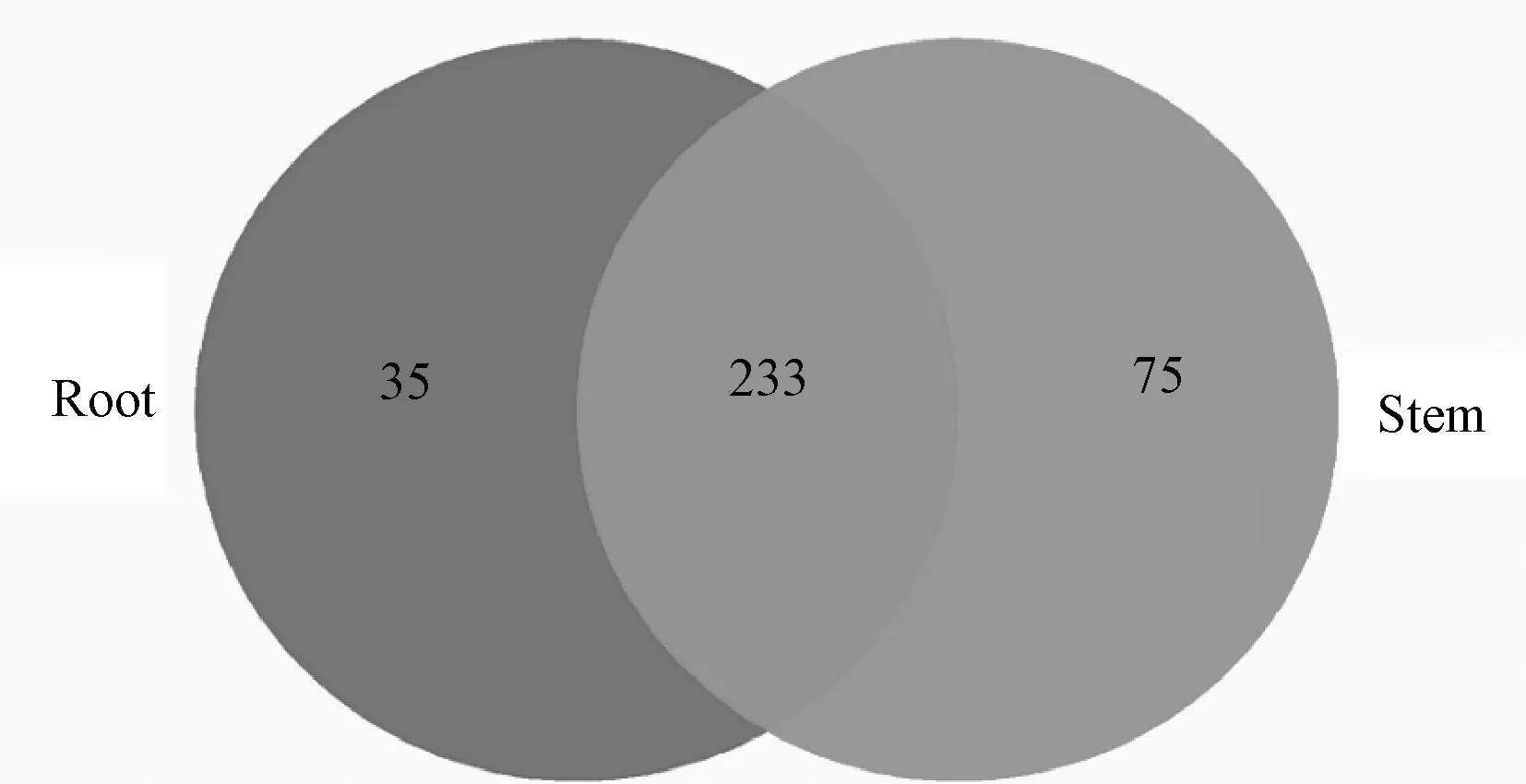
图7 怀山药根、茎样品OTUs分布
3 讨论
本研究首次将基于当前Illumina MiSeq测序平台的最新改进技术GSS高通量测序技术应用于怀山药内生真菌种群结构多样性研究,从基因组的水平上来解析微生物群落结构,突破了很多厌氧内生真菌不能被分离培养的技术瓶颈[12],既克服了传统分子生物学方法存在的通量低的缺陷,又从源头上消除植物样本中叶绿体和线粒体序列带来的干扰,还原了怀山药根和茎中内生真菌群体的真实比例。
本研究结果表明,怀山药根和茎样品中内生真菌物种组成丰富,但二者在种群结构上有一定的差异。怀山药根和茎中内生真菌在门水平上均主要为子囊菌门Ascomycota(根97.3%,茎92%),少量分布在担子菌门Basidiomycota(根2.6%,茎7.7%);这与王晓龙[13]采用传统分离培养方法研究的结果一致。在纲的水平上,主要分布有座囊菌纲Dothideomycetes(根34.1%,茎65.5%),锤舌菌纲Leotiomycetes(根35.9%,茎8.1%),粪壳菌纲Sordariomycetes(根22.2%,茎13.3%);在目的水平上,主要分布于格孢腔菌目Pleosporales(根24.2%,茎60.2%),蜡钉菌目Helotiales(根34.9%,茎7.6%),粪壳菌目Sordariales(根20.1%,茎3.4%);在属的水平上,主要分布于链格孢属Alternaria(根17.1%,茎33.2%),葡萄孢盘菌属Botryotinia(根34.1%,茎6.3%),毛球壳属Lasiosphaeriaceae(根20.0%,茎0.3%);另外,GSS高通量测序结果还获得了一部分的弱势菌群,但由于弱势菌群在整个物种组成中所占比例甚小,本论文未对其进行一一列举。
[1] 江苏新医学院. 中药大辞典[M]. 上海: 上海科学技术出版社, 2004.
[2] 韩锁义, 张新友, 王素霞, 等. 河南省怀山药生产现状[J]. 河南农业科学, 2011, 40(9): 109-111.
[3] 白冰, 李明静, 王勇, 等. 怀山药化学成分研究[J]. 中国中药杂志, 2008, 33(11): 1272-1274.
[4] 王晓龙, 李守婷, 文春南, 等. 怀山药内生真菌厚孢镰刀菌的次生代谢产物研究[J]. 中草药, 2015, 46(7): 966-969.
[5] 江曙, 钱大玮, 段金廒, 等. 植物内生菌与道地药材的相关性研究[J]. 中草药, 2008, 39(8): 1268-1272.
[6] 范丽霞, 郑继平, 白新鹏. 药用植物内生菌及其对道地药材影响的研究进展[J]. 安徽农业科学, 2012, 40(22): 11221-11223.
[7] LUO C, TSEMENTZI D, KYRPIDES N, et al. Direct comparisons of Illumina vs.Roche 454 sequencing technologies on the same microbial community DNA Sample[J]. Plos One, 2012, 7(2): e30087.
[8] MARGULIES M, EGHOLM M, AITMAN W E, et al. Genome sequencing in microfabricated high-density picolitre reactors[J]. Nature, 2005, 437(7057): 376-380.
[9] 陈泽斌, 李冰, 王定康, 等. 铁皮石斛叶片内生真菌多样性的研究[J]. 福建农业学报, 2015, 30(10): 978-983.
[10] 侯晓强, 付亚娟, 袁建平, 等. 大花杓兰内生真菌多样性研究[J]. 湖北农业科学, 2015, 54(6): 1357-1360.
[11] 陈泽斌, 代方平, 寸林江, 等. 烟草内生细菌分离方法的优化研究[J]. 中国烟草学报, 2014, 20(1): 90-95, 102.
[12] AMMANN R R, LUDWIG W, SCHLEIFFER K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews, 1995, 59(1): 143-169.
[13] 王晓龙. 怀山药内生菌的分离及其次生代谢产物的初步研究[D]. 郑州: 河南农业大学, 2015.
