壬基酚聚氧乙烯醚对大型溞的急性和慢性毒性效应
2018-02-06蔡小宇姜锦林单正军卜元卿续卫利
蔡小宇, 姜锦林, 单正军, 卜元卿, 续卫利
(1.南京信息工程大学江苏省大气环境与装备技术协同创新中心, 江苏 南京 210044; 2.环境保护部南京环境科学研究所国家环境保护农药环境评价与污染控制重点实验室, 江苏 南京 210042)
壬基酚聚氧乙烯醚(NPnEO)是以壬基酚和环氧乙烷在催化剂作用下经缩合反应形成的非离子表面活性剂。多样的亲水亲油平衡值(HLB value)使其在化工产业,尤其是洗涤剂和印染行业得到大量使用。它不仅具有良好的渗透性、乳化性和分散性,同时还能抗酸、抗碱、抗硬水、抗还原和抗氧化[1]。NPnEO进入环境后其聚合链被打断,形成保留1~2个环氧乙烷(EO)的壬基酚聚氧乙烯醚(NP1EO和NP2EO),这些代谢物可氧化成相应的羧酸(NP1EC和NP2EC),最终转化为壬基酚。壬基酚(NP)是一种被广泛认可的环境激素,通过模拟雌激素,对生物的性发育产生影响,干扰生物的内分泌系统,对生殖系统产生毒害作用。同时,NP能通过食物链在生物体内不断蓄积,因此,即使其排放浓度很低,也极具危害性。
NPnEO作为全球商用第2大类非离子表面活性剂,在使用过程中约60%会经废水排放进入污水处理厂,最终进入周围的水体环境。马兴杰等[2]研究发现在污水处理厂进、出水口都检测到NPnEO和NP,其浓度水平存在潜在的环境风险。侯绍刚等[3]研究表明,NPnEO在黄河水体发生了有效降解,不同断面层上都检测到NPnEO的小分子降解产物,特别是持久性较强的NP在各个断面都存在污染;同时,在悬浮颗粒物和沉积物中也检测到相应的NP、NPlEO和NP2EO,与水体中含量相比其值都偏大,而悬浮颗粒物对NP、NP1EO和NP2EO的富集大于沉积物对它们的富集。吴伟等[4]的研究表明,NPnEO对水生生态系统中食物链各环节上的生物均有一定的急性毒性,其毒性由大到小依次为枝角类、鱼类、藻类和微生物。国内外有研究[5-6]表明,NP不仅具有内分泌干扰作用,还具有很强的致畸、致癌、致突变效应。
大型溞(Daphniamagna)是世界范围内分布最广的甲壳纲枝角类无脊椎动物,作为代表性的水生浮游动物,在水生食物链中充当着重要角色,是水生生态系统能量转化和物质循环的关键环节。大型溞也是目前国内外水生生物毒理学研究的标准测试生物,被广泛应用于水生生物毒性试验和评价[7]。笔者以大型溞为受试对象,研究了NPnEO原药对大型溞的急性毒性和21 d慢性毒性效应,以期为保护水生生态系统安全提供科学依据。
1 材料与方法
1.1 试验生物
受试大型溞为笔者所在实验室培养的同一健康亲溞孤雌生殖3代以上的幼溞,选取在24 h以内出生,健康、活跃、体型匀称的幼溞进行实验。根据OECD 211准则[8-9]的规定,大型溞需在指定配制的M4培养液中长期育养[10],培养液中溶解氧饱和度保持在80%左右,pH值为7.8±0.2,培养液中溞密度为20只·L-1。育养环境条件:温度为(20±2) ℃,光强为18 μE·m-2·s-1,t(光)∶t(暗)为16 h∶8 h[11]。育养过程中以绿藻和酵母作为饵料定期喂食,藻细胞投放密度应控制在2.0×105~3.0×105mL-1。每2~3 d更换1次培养液,同时将培养器皿清洗干净[12]。
试验前,挑选体型大、怀卵多、活动强的母溞置于1 L烧杯中,挑选数量为20~30只,用新鲜藻类喂食3周。试验采用这些母溞生产的2~5代幼溞,选取在6~24 h内出生、健康活泼的幼溞用于毒性试验,其重铬酸钾敏感度测定结果符合ISO标准[13]。
1.2 供试药剂
壬基酚聚氧乙烯醚(NP40EO)来自阿拉丁公司,优级纯,纯度w≥99.0%。外观为无色或淡黄色液体,稍有苯酚气味。分子式为(C2H4O)nC15H24O,CAS号为9016-45-9。
1.3 试验方法
1.3.1急性毒性试验
参照OECD 202标准方法[14]进行48 h急性毒性暴露试验。根据预试验结果,得出NP40EO对溞类100%活动受抑制的最低浓度和全不抑制的最高浓度,确定正式试验的浓度范围。以丙酮为助溶剂配制2.50、4.00、6.40、10.24、16.38和26.21 mg·L-16个处理组,并设置不加药剂的空白对照组和助溶剂丙酮对照组〔w(丙酮)为0.1‰)〕。用w=0.1‰的丙酮溶液配制NP40EO母液,然后将其溶于M4培养液,配制不同的浓度处理组。每个浓度设置4个平行,在100 mL烧杯中装入50 mL配制好的不同浓度药液,每个烧杯中放入5只6~24 h溞龄的幼溞,分别于24和48 h后观察并记录活动受抑制的幼溞数量。在急性毒性暴露过程中不饲喂饵料,不更换试液。
1.3.2慢性毒性试验
参照OECD 211标准方法[9]进行21 d慢性毒性试验。根据急性毒性预试验和正式试验获得的NP40EO对大型溞的48 h半抑制浓度(EC50)值,设置6个浓度梯度,每个浓度设置10个平行,同时设置空白对照组和丙酮溶剂对照组〔w(丙酮)为0.1‰)〕。试验设置0.11、0.22、0.445、0.89、1.78和3.56 mg·L-16个处理组。试验前需打开光照,调节室温至20 ℃,将用w=0.1‰的丙酮溶液配制成的母液溶于M4培养液中,设置成不同浓度梯度处理组。试验时,用量筒量取不同浓度药液各50 mL,放入100 mL烧杯中,每个浓度设置10个平行,在每只烧杯中放入1只健康活泼的6~24 h溞龄幼溞,于t(光)∶t(暗)为16 h∶8 h、(20±2) ℃条件下连续培养21 d,在容器的水面上使不超过15~20 μE·m-2·s-1强度的光照保持16 h。试验期间采用半静态试验系统[15],每隔1 d更换1次试验溶液,以保证试验期间药剂浓度为起始浓度的80%以上。在慢性毒性试验过程中,应及时移除蜕下的壳和繁殖的幼溞,并每天记录大型溞的生存、蜕壳、怀卵和繁殖情况。试验期间,每天喂食1种或多种新鲜藻细胞。在为期21 d的试验结束时,使用体视镜对存活大型溞拍照,并测量体长(从头盔至壳刺部)和记录溞体形态变化,计算大型溞的平均首次蜕壳时间、平均蜕壳次数、平均首次产幼溞时间、平均产幼溞数量和产幼溞胎数及大型溞生长21 d时的平均体长。
1.4 数据分析
48 h EC50值是根据48 h急性毒性试验数据采用SPSS 16.0软件中的 Probit Analyze功能分析得到。根据慢性毒性试验数据,用SPSS 16.0软件中的单因素方差分析方法分析各种指标与对照组的差异,采用Origin 8.0软件分析各慢性毒性终点值的变化,得到最敏感指标出现显著性变化的暴露浓度,并计算各个繁殖毒性终点指标的无观测效应浓度(NOEC)值。
2 结果与分析
2.1 NP40EO对大型溞的急性毒性
试验过程中试液溶解氧饱和度保持在80%左右,pH值约为7.5。空白对照组大型溞生长正常,无死亡现象。大型溞接触NP40EO溶液后,受试溞在各浓度范围条件下的活动受到不同程度抑制,受抑制的溞个体肿胀肥大,呈白色,沉于水底。
NP40EO对大型溞的24和48 h EC50分别为>26.21 和14.23 mg·L-1,NP40EO对大型溞48 h EC50的95%置信限为10.632~19.04 mg·L-1。根据原国家环境保护局《化学农药环境安全评价试验准则》[16]中关于农药对大型溞的毒性分级标准,NP40EO对溞类的毒性为低毒。
2.2 NP40EO对大型溞的慢性毒性
2.2.1NP40EO暴露对大型溞首次蜕壳时间的影响
由图1可知,在实验浓度范围内,大型溞的首次蜕壳基本上都发生在第2天,个别大型溞在第2天以后初次蜕壳,当ρ(NP40EO)为1.78 mg·L-1时,大型溞初次蜕壳时间显著延长(P<0.05)。
2.2.2NP40EO暴露对大型溞蜕壳次数的影响
图2显示,不同NP40EO浓度条件下大型溞平均蜕壳次数均不相同,空白对照组大型溞平均蜕壳次数最多,当ρ(NP40EO)为0.445 mg·L-1时,其平均蜕壳次数显著下降(P<0.05),当ρ(NP40EO)为0.89和1.78 mg·L-1时,大型溞平均蜕壳次数极显著下降(P<0.01),说明NP40EO暴露能够减少大型溞蜕壳次数。
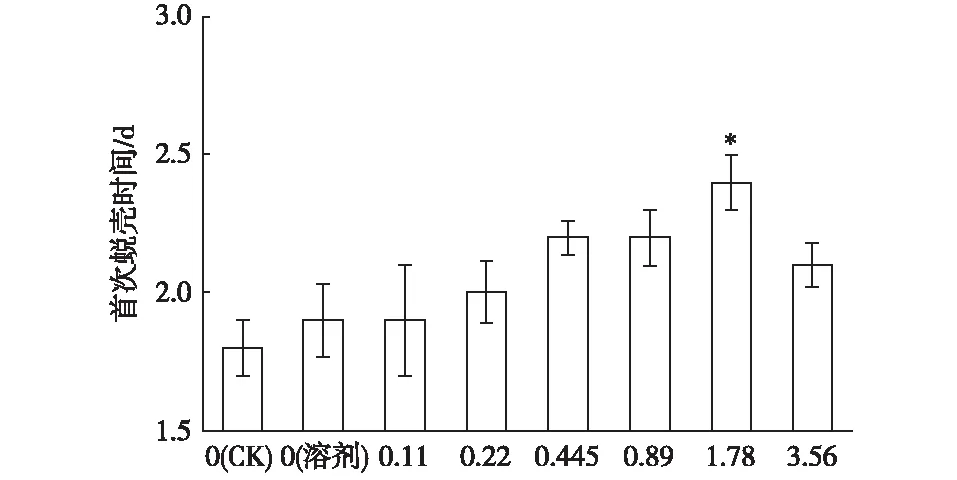
ρ(NP40EO)/(mg·L-1) *表示不同处理间首次蜕壳时间差异显著(P<0.05)。
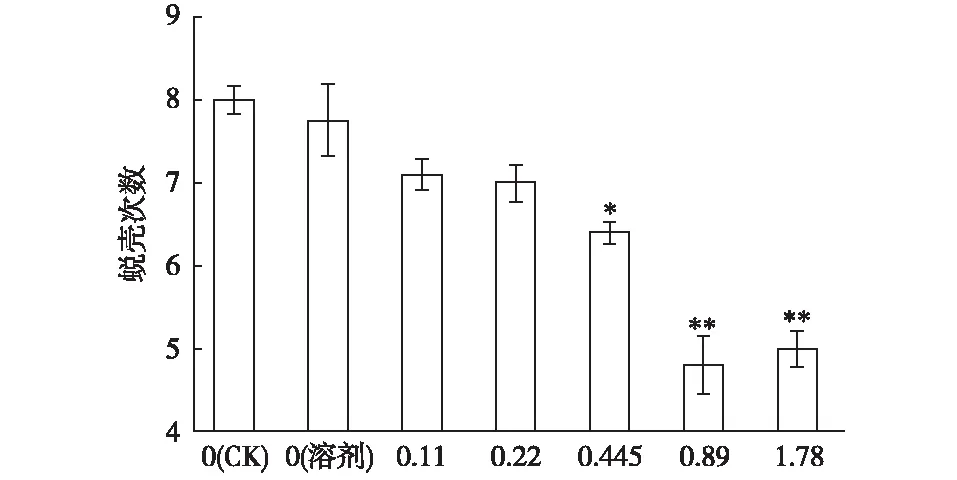
ρ(NP40EO)/(mg·L-1) *和**分别表示不同处理间首次蜕壳次数差异 显著(P<0.05)和差异极显著(P<0.01)。
2.2.3NP40EO暴露对大型溞首次产幼溞时间的影响
由图3可知,大型溞首次产幼溞时间约为10 d,而当ρ(NP40EO)为0.445和1.78 mg·L-1时,首次产幼溞时间出现显著差异(P<0.05),可知NP40EO暴露对大型溞首次产幼溞时间存在一定影响。
2.2.4NP40EO暴露对大型溞存活个体产幼溞数的影响
由图4可知,NP40EO暴露能降低每只大型溞平均产幼溞数。当ρ(NP40EO)为0.445~1.78 mg·L-1时,大型溞产幼溞数显著减少(P<0.05)。
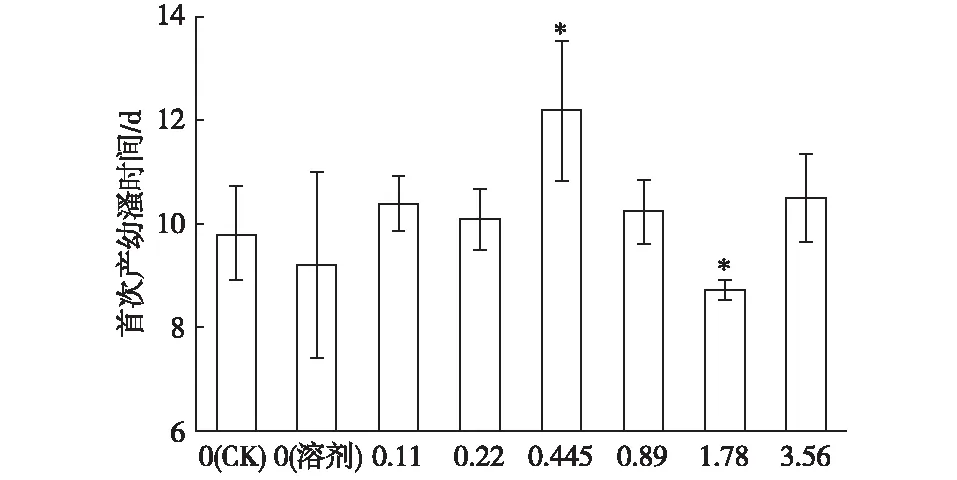
ρ(NP40EO)/(mg·L-1) *表示不同处理间首次产幼溞时间差异显著(P<0.05)。

ρ(NP40EO)/(mg·L-1) 只统计存活至试验结束时大型溞所产幼溞数。
2.2.5NP40EO暴露对大型溞存活个体产幼溞胎数的影响
由图5可知,NP40EO暴露能降低每只大型溞平均产幼溞胎数。当ρ(NP40EO)为0.22和1.78 mg·L-1时,大型溞产幼溞胎数显著减少(P<0.05),当ρ(NP40EO)为0.445和0.89 mg·L-1时,大型溞产幼溞胎数极显著减少(P<0.01)。
2.2.6NP40EO暴露对大型溞存活个体平均体长的影响
由图6可知,NP40EO暴露能缩短每只大型溞平均体长。当ρ(NP40EO)为0.445~3.56 mg·L-1时,NP40EO暴露21 d时大型溞体长极显著缩短(P<0.01)。
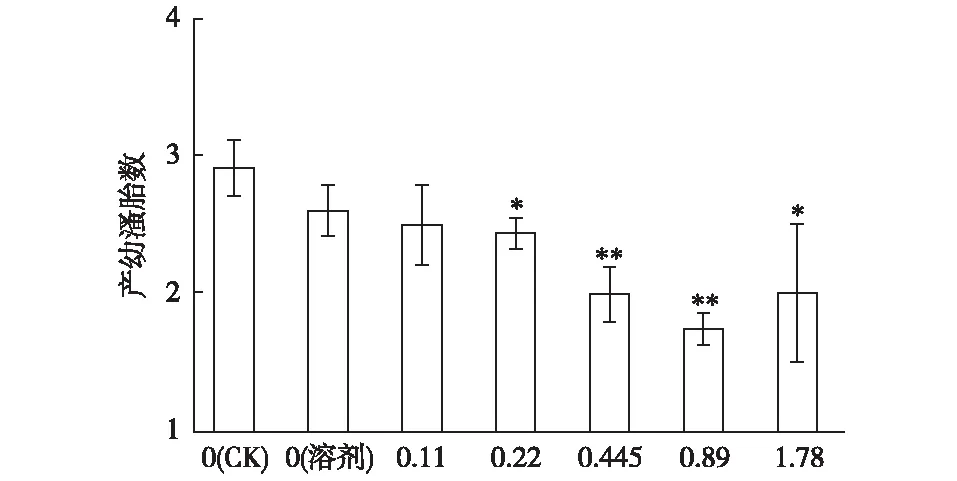
ρ(NP40EO)/(mg·L-1) *和**分别表示不同处理间产幼溞胎数差异 显著(P<0.05)和差异极显著(P<0.01)。
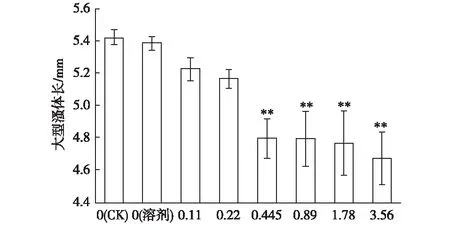
ρ(NP40EO)/(mg·L-1) **表示不同处理间大型溞体长差异极显著(P<0.01)。
3 讨论
通过NP40EO对大型溞的急性毒性试验,笔者研究得到NP40EO对大型溞的急性毒性为低毒,其48 h EC50为14.23 mg·L-1,而吴伟等[4]的研究表明NP10EO对大型溞的急性毒性为中毒,其48 h EC50为8.2 mg·L-1,笔者研究结果与李秀环等[17]的相一致,后者的研究表明不同种类农药表面活性剂对大型溞急性毒性的结果表明烷基酚聚氧乙烯醚系列表面活性剂对大型溞的急性毒性属中毒或低毒,当碳链长度相同时,EO缩合数越大,毒性越低。HU等[18]研究了NP和NP10EO对多刺裸腹溞的复合毒性,结果表明NP10EO对多刺裸腹溞的48 h EC50为2.11 mg·L-1,所测得的毒性值比大型溞小,由于体型小,甲壳薄的溞体对污染物的敏感度更高,所以对于同一污染物裸腹溞比大型溞更为敏感。
NPnEO在环境中极易降解为NP,而NP具有很强的雌激素活性,笔者试验结果也表明NP40EO对大型溞具有毒害效应,对其存活、生长和繁殖都具有影响,且随着NP40EO浓度的增加,一些毒性效应更为突出。国内外已有许多研究表明NPnEO和NP可损伤动物的生殖器官,TOLLEFSEN等[19]的研究表明NP会抑制大西洋鲑鱼(Salmosalar)睾丸的发育,并诱导卵黄蛋白原的产生,促进雌激素分泌。DOMENE等[20]的研究表明,NPnEO对土壤无脊椎动物的繁殖具有显著影响。ZHA等[21]研究表明,NP能够引起生殖异常,并破坏许多动物的生殖发育。笔者研究结果与之一致,NP40EO对大型溞的首次产幼溞时间、平均产幼溞数和平均产幼溞胎数都具有显著影响,说明NP40EO对大型溞的慢性毒性试验中,随试验时间的增加,NP40EO不断降解产生NP,从而对大型溞的生殖功能产生不利影响。LEBLANC[22]认为,NP与蜕皮激素受体的结合使蜕皮激素信号的传递受到抑制,阻碍了甲壳动物的蜕皮进程,从而影响甲壳动物的生长,同时还推迟了繁殖生育时间,笔者研究结果与之完全一致,NP40EO的暴露减少了大型溞的平均蜕壳次数。
笔者研究表明,NP40EO对大型溞的急性毒性为低毒,同时,慢性毒性的影响也尤为显著。试验过程中,慢性毒性处理组母溞存在死亡现象,说明NP40EO存在慢性致死性,在母溞产卵过程中,几个处理组均有幼溞死亡或畸形现象发生,表明NP40EO对子代发育存在一定影响。因此,在自然环境中,如果大型溞暴露在笔者试验浓度条件下,其种群数量将会减少。由于NPnEO的降解产物是NP,而NP是造成溞类死亡和生长抑制的主要因素,在环境中两者又处于长期共存状态,所以需要进一步评估两者联合作用对水生态系统的危害[23]。同样,正在广泛使用的其他助剂类产品所引起的环境风险也应受到人们足够的重视。
4 结论
NP40EO对大型溞的48 h EC50为14.23 mg·L-1,属于低毒。NP40EO暴露对大型溞的首次蜕壳时间存在影响,同时对平均蜕壳次数产生显著影响,并延迟大型溞首次产幼溞时间,减少每只大型溞平均产幼溞胎数和产幼溞数,减缓大型溞的个体生长。大型溞的平均产幼溞数、平均产幼溞胎数和个体体长这3项指标对NP40EO暴露很敏感,而首次产幼溞时间、平均蜕壳次数对NP40EO暴露比较敏感,首次蜕壳时间敏感度相对较差。因此,综合考虑各项繁殖毒性终点指标,NP40EO对大型溞的LOEC值为0.445 mg·L-1,NOEC值为0.11 mg·L-1。由于NPnEO在市场上的广泛使用,虽然其对大型溞的急性毒性较低,但笔者研究表明NP40EO在较低浓度下便能显著影响大型溞的各项慢性毒性终点,因此,建议在使用前对其进行环境生物影响风险评估。由于该物质主要存在于各类废水中,更应广泛关注其对水生生物的毒性,尤其要注意其对浮游甲壳类生物的影响。
[1] 卜元卿,王簪畅,智勇,等.农药制剂中助剂使用状况调研及风险分析[J].农药,2014,53(12):932-936.[BU Yuan-qing,WANG Zan-chang,ZHI Yong,etal.Investigation and Risk Analysis of Pesticide Inert Ingredients in Pesticide Products[J].Agrochemicals,2014,53(12):932-936.]
[2] 马兴杰,邵兵,胡建英,等.壬基酚聚氧乙烯醚在污水处理过程中的迁移转化行为[J].环境科学,2002,23(5):80-83.[MA Xing-jie,SHAO Bing,HU Jian-ying,etal.The Transformation of Nonylphenol Ethoxylates in Sewage Treatment[J].Environmental Science,2002,23(5):80-83.]
[3] 侯绍刚,徐建,汪磊,等.黄河(兰州段)水环境中壬基酚及壬基酚聚氧乙烯醚污染的初步研究[J].环境化学,2005,24(3):250-254.[HOU Shao-gang,XU Jian,WANG Lei,etal.Primary Study on Nolphenol and Nonylphenol Polyethoxylates in Aquatic Environmental at Lanzhou Reach of Yellow River[J].Environmental Chemistry,2005,24(3):250-254.]
[4] 吴伟,瞿建宏,陈家长,等.壬基酚聚氧乙烯醚及其降解产物对水生生物的毒理效应[J].湛江海洋大学学报,2003,23(4):39-44.[WU Wei,QU Jian-hong,CHEN Jia-zhang,etal.Toxic Effects of Nonylphenol Ethoxylates and Its Degradation Product on Aquatic Organisms[J].Journal of Zhanjiang Ocean University,2003,23(4):39-44.]
[5] SOARES A,GUIEYSSE B,JEFFERSON B,etal.Nonylphenol in the Environment:A Critical Review on Occurrence,Fate,Toxicity and Treatment in Wastewaters[J].Environment International,2008,34(7):1033-1049.
[6] FRASSINETTI S,BARBERIO C,CALTAVUTURO L,etal.Genotoxicity of 4-Nonylphenol and Nonylphenol Ethoxylate Mixtures by the Use ofSaccharomycescerevisiaeD7 Mutation Assay and Use of This Text to Evaluate the Efficiency of Biodegradation Treatments[J].Ecotoxicology and Environmental Safety,2011,74(3):253-258.
[7] 朱昱璇,姜锦林,单正军,等.抑食肼对大型溞的急慢性毒性效应研究[J].农业环境科学学报,2014,33(12):2309-2314.[ZHU Yu-xuan,JIANG Jin-lin,SHAN Zheng-jun,etal.Acute and Chronic Toxic of RH-5849 toDaphniamagna[J].Journal of Agro-Environment Science,2014,33(12):2309-2314.]
[8] OECD.Test Guideline No.211.Effects on Biotic Systems Test:DaphniamagnaReproduction Test[S].
[9] OECD.Test Guideline No. 211.Test Guidelines for Testing of Chemicals:DaphniamagnaReproduction Test[S].
[10] ELENDT B P,BIAS W R.Trace Nutrient Deficiency inDaphniamagnaCultured in Standard Medium for Toxicity Testing:Effects of the Optimization of Culture Conditions on Life History Parameters ofD.magna[J].Water Research,1990,24(9):1157-1167.
[11] BOGDAN K G,GILBERT J J.Body Size and Food Size in Freshwater Zooplankton[J].PNAS,1984,81(20):6427-6431.
[12] STAUBER J L,FLORENCE T M.The Effect of Culture Medium on Metal Toxicity to the Marine DiatomNitzschiaclosteriumand Freshwater Green AlgaChlorellapyrenidosa[J].Water Research,1989,23(7):907-911.
[13] 周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989:45-56.[ZHOU Yong-xin,ZHANG Zong-she.Biological Aquatic Toxicity Test Method[M].Beijing:Agriculture Press,1989:45-56.]
[14] Test No. 202.Daphniasp. Acute Immobilization Test[S].
[15] FRANCIS P C,GROTHE D W,SCHEURING J C.Chronic Toxicity of 4-Nitrophenol toDaphniamagnaStraus Under Static-Renewal and Flow-Through Conditions[J].Bulletin of Environmental Contamination and Toxicology,1986,36(5):730-737.
[16] 国家环境保护局.化学农药环境安全性评价试验准则[J].农药科学与管理,1990(2):1-5.[NEPA.Experimental Guideline for Environmental Safety Evaluation of Chemical Pesticide[J].Pesticide Science and Management,1990(2):1-5.]
[17] 李秀环,李华,陈澄宇,等.不同种类农药表面活性剂对大型溞的急性毒性[J].应用生态学报,2013,24(8):2319-2324.[LI Xiu-huan,LI Hua,CHEN Cheng-yu,etal.Acute Toxicity of Different Type Pesticide Surfactants toDaphniamagna[J].
Chinese Journal of Applied Ecology,2013,24(8):2319-2324.
[18] HU X L,SUN Z W,WANG J J,etal.Sublethal Toxic Effects of Nonylphenol Ethoxylate and Nonylphenol toMoinamacrocopa[J].Bulletin Environmental Contamination Toxicology,2014,93(2):204-208.
[19] TOLLEFSEN K E,MATHISEN R,STENERSEN J.Induction of Vitellogenin Synthesis in an Atlantic Salmon (Salmo salar) Hepatocyte Culture:A SensitiveinVitroBioassay for the Oestrogenic and Anti-Oestrogenic Activity of Chemicals[J].Biomakers,2003,8(5):394-407.
[20] DOMENE X,RAMREZ W,SOLL,etal.Soil Pollution by Nonylphenol and Nonylphenol Ethoxylates and Their Effects to Plants and Invertebrates[J].Journal of Soils and Sediments,2009,9:555.
[21] ZHA J M,WANG Z J,WANG N,etal.Histological Alternation and Vitellogenin Induction in Adult Rare Minnow (Gobiocyprisrarus) After Exposure to Ethynylestradiol and Nonylphenol[J].Chemosphere,2007,66(3):488-495.
[22] LEBLANC G A.Crustacean Endocrine Toxicology:A Review[J].Ecotoxicology,2007,16(1):61-81.
[23] 郭匿春,谢平.双酚A和壬基酚对隆线溞和微型裸腹溞的毒性[J].水生生物学报,2009,33(3):492-497.[GUO Ni-chun,XIE Ping.The Toxic Effects of BPA and NP onD.carinataandM.micrura[J].Acta Hydrobologica Sinica,2009,33(3):492-497.]
