氧化石墨烯及其复合物对水中重金属离子吸附研究进展
2018-02-01肖立权张权张英裴丽欣侯军亮董建芳刘玲霞
肖立权 张权 张英 裴丽欣 侯军亮 董建芳 刘玲霞


摘要:氧化石墨烯作为一种新型纳米材料在水处理领域受到了人们的广泛关注,由于其具有较大的比表面积,丰富的含氧官能团,良好的亲水性,独特的物理结构,使其可吸附水中的重金属离子,且吸附能力超过诸多目前常用的吸附剂。但同时由于氧化石墨烯结构和性质的原因,限制了其在水处理领域中的发展,为了解决这个问题,可通过氧化石墨烯与其他物质结合形成氧化石墨烯复合物。介绍了氧化石墨烯的结构和性质,以及其对水中重金属离子的吸附机制及受控的影响因素;同时,也综述了氧化石墨烯复合物对水中重金属离子的吸附机制,以及其解吸与重复利用能力;此外,对氧化石墨烯及其复合物作为吸附剂去除水中重金属离子的应用潜力进行了总结和展望。
关键词:氧化石墨烯;重金属;吸附;氧化石墨烯复合物;影响因素
中图分类号:X52文献标志码:A开放科学(资源服务)标识码(OSID):张权
A review on adsorption of graphene oxide and its composites for heavy metal ions in water
XIAO Liquan.1,ZHANG Quan.2,ZHANG Ying.2,PEI Lixin.2,HOU Junliang.3,DONG Jianfang.3,LIU Lingxia.2
(1.No.416 Geological Party,Hunan Bureau of Geology and Mineral Exploration and Development,Zhuzhou 412000,China;2.Institute of Hydrogeology and Environmental Geology,Chinese Academy of Geological Sciences,Shijiazhuang 050061,China;3.Geological Environmental Monitoring Institute of Hebei Province,Shijiazhuang 050000,China)
Abstract:Graphene oxide has attracted widespread attention in water treatment field as a new nanomaterial.Because of its large specific surface area,abundant oxygen-containing functional groups,excellent hydrophilia,and unique physical structure,it can adsorb heavy metal ions from water and its adsorption capacity is better than many kinds of common adsorbents.However,its structure and property have limited its development in water treatment field.This problem can be solved by combining graphene oxide and other materials to form graphene oxide composites.This review introduces the structure and property of graphene oxide,its adsorption mechanism for heavy metal ions in water and the influence factors.At the same time,this review summarizes the adsorption mechanism of graphene oxide composites for heavy metal ions in water and its desorption and regeneration abilities.In addition,it summarizes and predicts the application potential of graphene oxide and its composites as adsorbents to remove heavy metal ions from water.
Key words:graphene oxide;heavy metal;adsorption;graphene oxide composite;influence factor
人類使用重金属已有上千年的历史,在使用过程中,[JP+2]重金属离子不可避免的通过多种途径进入水体,由于其在水体中的持久性和难以去除性,导致重金属离子容易在动植物和人体中富集,从而引起了研究人员的广泛注意[1-2]。经过多年的研究,目前已有多种方法可去除水中的重金属离子,如化学沉沉、电化学、薄膜过滤、离子交换和吸附法等,在这些方法中,吸附法由于其具有成本低、易操作等优点而受到研究人员的青睐[3],而吸附法的关键在于寻找合适的吸附剂材料。除传统的活性炭、沸石等吸附剂外,近年来研究人员相继采用了壳聚糖、木质素、零价纳米铁等新型吸附剂,在吸附领域取得了一系列研究进展[4-5]。自从2006年Machida等[6]发现氧化石墨烯(GO)可吸附Pb(Ⅱ)以来,GO由于其独特的物理化学性质受到了研究人员的广泛关注[7]。
相比较其他吸附剂,氧化石墨烯(GO)具有更高的比表面积,且其还具有大量的含氧官能团以及良好的水分散性等特点,这使得GO作为吸附剂去除水中重金属离子的潜力相比其他吸附剂更高。同时,由于其独特的物理化学性质使GO可与其他材料相结合,使其在吸附选择性、可重复性等方面的能力得到显著增加。由于以上多个特点使GO及其复合物作为吸附剂去除水中重金属离子得到了广泛研究。本文将主要论述关于GO及其复合物去除水中重金属离子方面的研究进展,同时就GO在水环境处理方面的应用做出总结与展望。
1GO结构
在研究初期,GO被认为是亲水物质[8]。随着进一步研究,Kim等[9]发现,GO具有两亲性,边缘具有亲水性,而越靠近中心,疏水性质越明显。由于GO无定形、合成方式多种、当温度在60~80 ℃时会缓慢降解且缺乏足够精准的测量手段等原因,导致时至今日仍然没有一个GO的模型受到科学界的一致认可[10-11]。目前较为成熟的理论模型有Hofmann模型[12]、Ruess模型[13]、Scholz-Boehm模型[14]、Nakajima-Matsuo模型[15]以及Lerf-Klinowski模型[16-18]等(图1)。作为第一个提出的模型——Hofmann模型认为,GO是环氧基团(1,2-乙醚)随机分布石墨基面上,由C2O分子组合成网状[CM(22]结构;Ruess模型在Hofmann模型的基础上增加了
图1GO模型(Hofmann模型;Ruess模型;Scholz-Boehm模型;Nakajima-Matsuo模型;
Lerf-Klinowski模型;Szabo-Dekany模型[10])
Fig.1
The model of GO(Hofmann model;Ruess model;Scholz-Boehm model;
Nakajima-Matsuo model;Lerf-Klinowski model;Szabo-Dekany model)
羟基,可解释GO中含有的H元素,同时提出GO基底面不是平整而是有褶皱的,且与Hofmann认为GO平面结构为sp2杂化不同,Ruess认为GO的平面结构是sp3杂化;Scholz-Boehm模型认为GO中不含环氧基团和乙醚基团,GO基底面不是规律分布的;Nakajima-Matsuo模型则认为 GO 晶格框架类似(C2F)n 的结构;基于核磁共振数据(NMR)的Lerf-Klinowski模型认为GO的结构是由两个随机分布的区域组成,一部分是由未氧化的芳香烃构成的sp2杂化平坦区域,另一部分是由脂环族官能团及乙醚官能团构成的sp3杂化褶皱区域,GO的边缘通常含有羟基和较少量的羧基。
除以上几种模型之外,还有两种近些年发展的模型:Szabo-Dekany模型和由Ayrat等[19]提出的动态结构模型(dynamic structure model,DS模型)。Szabo-Dekany模型是对Clause模型和Scholz-Boehm模型的进一步发展,Szabo-Dekany模型认为GO中氧化的区域和未氧化的区域是规律分布的,当C-C键破裂时会形成醌类和酮类基团。而DS模型则与传统的GO结构模型不同,首次将GO看作一个整体,DS模型认为GO与水接触会使GO的结构发生动态变化,同时认为GO呈酸性的原因不是由于原有酸性官能团的分解,而是持续与水接触使H离子发生聚集,长期与水接触还会导致GO的结构转变为类腐植酸型[20]。
尽管以上结构模型并不完全相同,但这些结构模型都認为GO具有独特的二维平面结构,使得GO具有足够大的比表面积与水溶液接触[21]。GO表面分布诸多含氧官能团,可为重金属离子提供充足的吸附位点,也使得GO表面携带负电荷,有利于重金属离子的吸附[22],同时也使得GO在水溶液中具有良好的分散性质,有利于GO复合物的制备[23]。GO的结构决定了其具有成为一种优良吸附剂的潜力。
2GO对水中重金属离子的吸附作用
GO一直被认为是一种颇具潜力的吸附材料,通过大量实验(见表1,表2)证明在相似条件下,GO对水中重金属的吸附能力总体上优于目前常见的活性炭、碳纳米管等吸附材料[24]。且由于羟基、羧基等亲水官能团的存在,使得GO易溶解,在水中具有良好的均匀分散的性质。
由于GO制备方法等外界条件的影响,导致在相同条件下不同方法制备的GO对重金属离子的吸附能力出现差异,但不可否认的是GO对水中的多种重金属离子均可吸附。由表1可以看出,在相似pH、温度和携带电荷条件下,重金属离子的吸附能力顺序为Pb(Ⅱ)>Cu(Ⅱ)>Cr(Ⅱ)>Cd(Ⅱ),而离子半径顺序为Pb(Ⅱ)>Cr(Ⅱ)>Cu(Ⅱ)=Cd(Ⅱ),这表明GO对重金属的吸附能力并未由离子半径等单个因素所决定,而是受离子半径、水解平衡常数等内在因素以及温度、pH值等外部因素共同影响,具体影响机制仍待进一步探究。
2.1GO对不同重金属离子的吸附强度
吸附强度是指当不同重金属离子存在于同一溶液中时,吸附剂对重金属离子的优先吸附顺序。通常认为,影响吸附强度的因素包括电负性、一阶水解常数、荷质比和离子半径等。Dastgheib等[44]通过活性炭对Cu(Ⅱ)、Cd(Ⅱ)、Na(Ⅰ)等多种离子的吸附实验发现,金属离子的吸附强度主要取决于金属离子的电负性和一阶水解常数,电负性和水解常数越高,则其吸附强度越大。Sitko等[30]将Cu(Ⅱ)、Cd(Ⅱ)、Zn(Ⅱ)、Pb(Ⅱ)四种元素分成六组,两种元素一组进行GO吸附实验,结果发现优先吸附顺序为Pb(Ⅱ)>Cu(Ⅱ)>Cd(Ⅱ)>Zn(Ⅱ),进一步印证了Dastgheib的观点。Gu等[45]通过实验发现,GO对金属离子的吸附顺序为Pb(Ⅱ)> Cu(Ⅱ) > > Cd(Ⅱ)≈Ni(Ⅱ)≈ Zn(Ⅱ)> Sr(Ⅱ)≈Ca(Ⅱ),基本与金属离子的电负性和一阶水解常数相符合,而这些离子的半径排列为Pb(Ⅱ)> Sr(Ⅱ)> Ca(Ⅱ) >Cd(Ⅱ) > Zn(Ⅱ) > Cu(Ⅱ) > Ni(Ⅱ)。Yang等[46]发现,无论在两种还是三种重金属离子竞争吸附条件下,与离子半径顺序不同(Pb(Ⅱ)> Sr(Ⅱ)> Ni(Ⅱ)),离子优先吸附顺序均为Pb(Ⅱ)>Ni(Ⅱ)>Sr(Ⅱ)。通过上述实验数据,可推断GO对金属离子的吸附顺序与离子半径无关[45]。
2.2吸附机理
一般而言,重金属离子的吸附行为主要有三种吸附机理:电荷吸引、络合作用和离子交换[47]。由于GO在大多数情况下(pH值4~11)都带有负电荷[48],因此,随着pH值的上升,GO携带的负电荷数量随之增多,导致电荷吸引在吸附反应中所起的作用越强[49];GO表面含有大量含氧官能团,含氧官能团可作为电子供体,重金属离子携带正电荷作为电子受体导致了络合反应的发生[24];Wu等[得6]发现,在GO吸附Cu(Ⅱ)后的pH值低于初始值,因此可进一步推断正是由于离子交换的发生,导致溶液中H.+离子增多,pH值下降,Zhao等[26]也发现了类似的现象。
2.3影响因素
2.3.1pH对吸附的影响
pH是影响吸附过程的一个重要因素,主要分为以下两方面。
一方面,pH值影响GO表面携带电荷的性质,当pH值较大时,GO表面官能团的H.+将会脱离,提供更多的配体。且当pH大于GO的等电点时,GO表面将携带负电荷,增强GO与重金属离子之间的吸引力,而当pH较低时,GO配体减少,溶液中的H.+离子还会与重金属离子形成竞争关系,影响吸附效果[26]。此外,当pH值在2左右时,还容易引起GO的聚集,使GO表面有效吸附面积减少[50]。
另一方面,pH影响重金属离子在溶液中的存在形式,如当pH<6时,溶液中Cu元素主要以Cu(Ⅱ)离子形式存在,便于吸附,当pH>6时,则会形成Cu(OH).+,Cu(OH)2等,容易发生沉淀,影响吸附效果[51]。由于不同重金属离子的电负性和离子半径不同,导致pH对不同重金属离子吸附能力影响存在差异[52]。
2.3.2溶液离子类型及强度对吸附的影响
溶液离子类型及强度主要会对吸附产生如下几个方面的影响:(1)溶液阳离子将会与重金属离子形成竞争吸附关系,而阴离子也可能与GO表面羟基、羧基等官能团结合,改变GO表面电荷形态,减少GO表面吸附位点,此外,溶液中阴离子还会与重金属离子结合,从而抑制GO吸附重金属离子,离子强度越大,重金属吸附量越低[31];(2)离子强度会削弱重金属离子的活度系数,影响重金属离子在液相溶液和固相吸附质之间的迁移[26];(3)GO的稳定性受离子强度的影响,离子强度增大将会挤压GO的双电子层结构,屏蔽其所携带的电荷,促使GO发生团聚[53]。
离子强度对GO吸附不同重金属离子影响不同,如Na.+对GO吸附Zn(Ⅱ)离子起负面影响,而对Cd(Ⅱ)等离子吸附的影响则较小[32,50],原因在于溶液离子只能影响外层电荷形态。可根据离子强度对重金属离子吸附的影响推断重金属离子被吸附后形成的络合物类型,例如,当离子强度不影响吸附容量或者吸附容量随离子强度增加而增加时,则可说明形成了内层表面络合物,当吸附容量随着离子强度增大而减小时,可说明形成了外层表面络合物(图2)。因此可说明Zn(Ⅱ)主要吸附到GO外表面形成外层表面络合物,而Cd(Ⅱ)主要吸附到GO内表面形成内层表面络合物[53-54]。
2.3.3温度对吸附的影响及热力学研究
温度对吸附的影响分为两个方面,一方面,随着温度上升,溶液黏度降低,重金属离子活动能力增加,促进吸附;另一方面,温度的变化还会影响吸附体系能量的变化,进而影响吸附反应的进行。
热力学参数主要包括Gibbs自由能ΔG.0、标准焓变化ΔH.0和标准熵变化ΔS.0,可通过以下公式获得[57]:
ΔG.0=-RT ln b(1)
ΔH.0=-R([SX(]T2 T1[]T2-T1[SX)])ln([SX(]b2[]b1[SX)])(2)
ΔS.0=[SX(]ΔH.0-ΔG.0[]T[SX)](3)[HJ2.3mm]
式中:R为理想气体常数;T为溶液温度(K);b为特定温度下的Langmuir常数。
根据实验结果[26,34,36]可知,一般而言,GO吸附重金属过程中ΔG.0为负值,[HJ1.75mm]且随着温度升高而降低,表明GO吸附重金属的反应是可自发进行,随着温度升高吸附量增大;ΔH.0为正值表明吸附为吸热反应;ΔS.0为正值表明溶液混乱程度增大,在吸附过程中重金属离子替换了一些吸附在GO上的水分子[58]。
2.4吸附动力学机制及等温吸附模式
2.4.1GO对重金属离子的吸附动力学机制
在GO吸附重金属离子的过程中,时间是一个十分重要的因素。在吸附过程中,随着时间不断持续,吸附位点逐渐减少,且水中H.+不断增多,削弱GO与重金属离子之间的吸引力,导致吸附速率不断降低[59]。研究吸附动力学不仅能够估算出吸附速率和平衡吸附量,而且还能够通过对反应机理的推测建立合适的吸附动力学模型,进而对实验的反应过程进行拟合,这对于设计高效吸附机制是十分重要的。主要采用的吸附动力学模型有三种,分别是准一级动力学模型、准二级动力学模型和颗粒内部扩散模型。
准一級动力学模型假设吸附受扩散速率控制,吸附速率与平衡吸附量和t时刻吸附量之间的差值成正比,适用于低浓度的吸附实验,线性方程式如下[59-60]:
log(qe-qt)=log(qe)-k1[WTBX]t(4)
式中:qe表示在平衡状态下的吸附量(mg/g);qt表示在t时刻的吸附量(mg/g);k1表示一级动力学速率常数(1/min)。
准二级动力学模型假设吸附速率受化学吸附速率的控制,这种化学吸附涉及到吸附剂与吸附质之间电子共用或电子转移,线性方程式如下[61-62]:
[SX(]t[]qt[SX)]=[SX(]1[]k[WTBX]2qe..2[SX)]+[SX(]t[]qe[SX)](5)
式中:k2为二级动力学速率常数(1/min)。
一般认为,溶质离子在固相上的吸附分为以下三个过程:(1)溶质离子从溶液中迁移到吸附质的外表面;(2)溶质离子从吸附质外表面扩散到吸附质内部;(3)被吸附质上的活性位点吸附[64]。颗粒内扩散模型认为若qt与t1/2的回归线为直线,且通过原点,那么便可认为颗粒内扩散是整个吸附过程的速率控制步骤,可表示为[65]
qt=k[WTBX][KG-*8]pt[SX(]1[]2[SX)]+c(6)
式中:k[WTBX][KG-*8]p为颗粒内扩散速率常数。
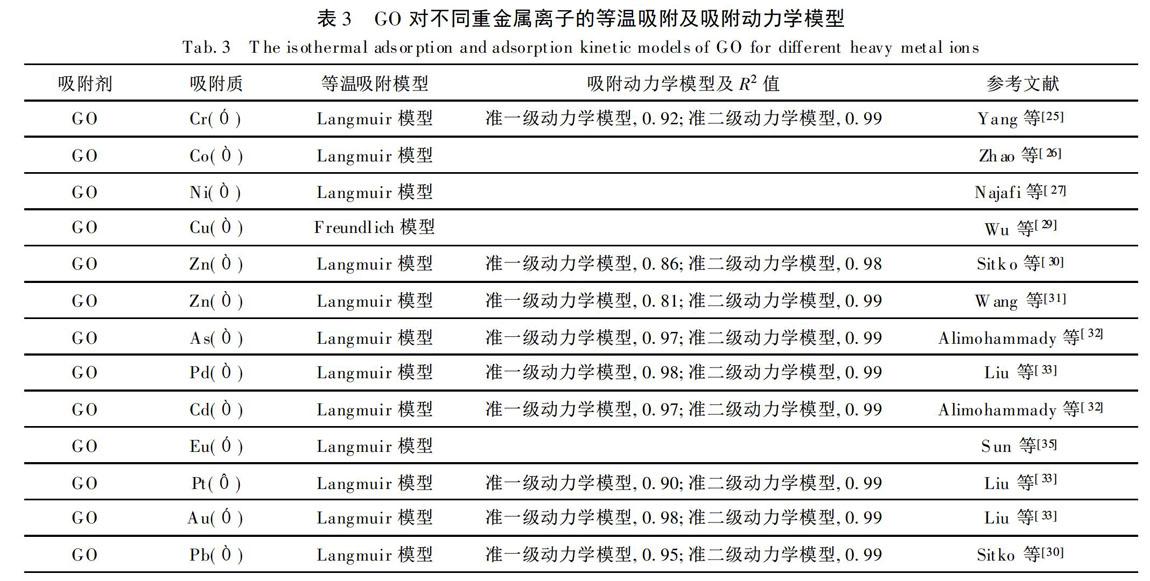
根据实验可得知(表3),采用准二级动力学模型描述的GO吸附重金属离子的R.2值更大,最大理论吸附量也更接近实验所测得的最大实际吸附量,因此GO吸附重金属基本符合准二级动力学模型。吸附速率受化学吸附速率控制,膜扩散和颗粒内扩散在吸附过程中同时进行,颗粒内扩散并不是吸附过程中的唯一速率控制步骤[32,34,51]。
2.4.2GO对重金属离子的等温吸附模式
与吸附动力学描述时间与吸附量的关系不同,吸附等温线是描述在恒定温度和pH值下,溶质分子从液相介质到固相吸附质过程的关系曲线[66-67]。目前最为常用的为Langmuir模型和Freundlich模型。其中,Langmuir模型是一种理论模型,假设条件为吸附剂与吸附质之间为单分子层化学吸附,适用于均相表面,线性表达式为
Q=[SX(]Qmk[WTBX]p[]1+k[WTBX]p[SX)](7)
式中:Q为平衡吸附量(mg/g);Qm为单分子层饱和吸附量(mg/g);p为吸附平衡时吸附质液相浓度(mg/L);b为吸附速率常数(dm.3/mg);K为吸附常数(L/mg)[68]。
吸附速率常数b表明吸附剂与吸附质结合的稳定性,b越大,则稳定性越强。
Frendlunch模型是一种经验模型,也是目前应用最为普遍的吸附模型。假设条件为吸附剂与吸附质之间为多层吸附,适用于非均相表面,线性表达式为
Q=KC .1/ne(8)
式中:Q为平衡吸附量(mg/g);Ce为吸附平衡时吸附质液相浓度(mg/L);K为吸附能力常数;n为吸附强度。
一般认为,当n在2~10之间时,易吸附;当n<0.5时,不易吸附[69-70]。
由表3可知,GO吸附重金属离子一般符合Langmuir吸附模型,主要为单分子层化学吸附。
3GO复合物对水中重金属的吸附作用
尽管GO具有优良的吸附性能,但特殊的物理化学条件也限制了其作为一种吸附材料在水处理领域的使用,如GO具有良好的亲水性,在水中分散程度较高,所以在吸附结束后很难将其从溶液中分离出来[60-71];对水中重金属离子的吸附缺乏选择性[72];由于π-π键和范德华力的影响容易相互聚集[73];还对水中生物具有潜在毒性等。
为了使GO在水处理领域得到进一步的发展,可使GO与其他物质相复合,这样不仅解决了以上问题,吸附能力也得到了显著增加(见表4)。目前使用的复合物包括无机物复合材料、高分子复合材料、泡沫和聚合物膜等。由于采用复合材料和合成工艺方面的差异,导致GO复合物也呈现出不同的物理化学性质,这也使得GO复合物吸附重金属的影响因素无法统一探讨。
Duru等[52]利用Fe3O4、Fe2O3等磁性材料制作的磁性GO,既保留了GO高吸附性能的特点,在吸附完成后还可以通过外加磁场使吸附剂和水体快速分离,避免二次污染。Li等[74]利用介孔材料SBA-15与GO共价连接制备了GO-SBA-15,对Pb(Ⅱ)有很好的吸附选择性,在Cd(Ⅱ)、Zn(Ⅱ)、Cr(Ⅲ)等多种重金属离子存在的情况下,对Pb(Ⅱ)的去除率达到99 %,且pH在4~7之间均具有很好的吸附效果。
Zhang等[75]利用聚酰胺一胺树枝状高分子和GO结合形成的复合物在吸附Pb(Ⅱ)、Cu(Ⅱ)、Mn(Ⅱ)等重金属离子时,吸附反应在60分钟内便可达到平衡,且Pb(Ⅱ)的最大吸附量为568 mg/g,而Cu(Ⅱ)为68.68 mg/g,Mn(Ⅱ)为18.29 mg/g,展现出了对Pb(Ⅱ)的高度选择吸附性。Ge等[76]采用微波辐射法通过简单的酰胺化反应制备了三亚乙基四胺修饰的GO/壳聚糖复合材料,该材料对Cr(Ⅵ)的最大吸附量达219.5 mg/g,且在20 min内就可达到最大吸附量的85 %,吸附过程极快。
Lei等[77]利用化学气相沉积法制得一种GO泡沫(GOF),该材料具有较高的比表面积(578 m.2/g),
丰富的含氧官能团,对Zn(Ⅱ)、Cd(Ⅱ)、Pb(Ⅱ)、Fe(Ⅲ)均具有很高的吸附量,同时,由于GOF为泡沫材料,吸附完成后很容易从溶液中分离出来,不需要外加磁场或者离心,有效的解决了GO分离难的问题。
通过GO与其他聚合物膜相结合,可提高膜的机械强度、水通量、污染物截留率及选择性等,同时也减少了GO需求量,降低了经济成本[78]。Zhang等[79]采用乙二胺(EDA)和HPEI制备了GO&EDA_HPEI的NF膜,在1bar下进行死端过滤,设定初始重金属离子浓度为1 000 mg/L,经过2 h后取样测定水中重金属离子浓度,Pb(Ⅱ)、Ni(Ⅱ)、Zn(Ⅱ)和Cd(Ⅱ)的去除率分别为95.7 %、96.0 %、97.4 %和90.5 %,展現出了极高的重金属离子去除性能,主要去除机理除吸附作用外,还包括尺寸筛选和电荷效应。
4GO复合物的解吸与重复利用
理想的吸附剂,通常除对污染物具有很高的吸附能力外,还需要具有强力的解吸能力而使其可被重复利用,以此可在实际应用中降低成本并提高吸附效率。GO复合物的解吸作用往往在酸性条件下有较高效率,用于解吸的酸包括HCl、HNO3等。例如,当使用去离子水作为解吸剂时,Fe3O4@GO/MnOx对Cu(Ⅱ)的解吸率仅为5 %,而当使用0.2 mol/L的HCl时解吸率可超过95 %,吸附-解吸过程循环三次后对Cu(Ⅱ)的吸附能力仍可达到初始吸附能力的85 %,表明Fe3O4@GO/MnOx是一种良好的Cu(Ⅱ)吸附剂[82],且其在酸性条件下的解吸作用也效果良好。
一般而言,GO復合物在吸附-解吸过程循环三次后的吸附能力可达到初始吸附能力的80 %左右,展现出了作为一种理想吸附剂的潜力。而造成吸附-解吸过程循环后的吸附能力降低的原因主要有以下三方面:(1)吸附-解吸过程中造成了吸附剂的损失;(2)解吸过程中吸附剂表面含氧官能团的数量减少;(3)部分重金属离子固着在吸附剂表面,难以去除。
5结论及展望
由于GO及其复合物对重金属离子的超强吸附能力,使其作为一类新兴材料在水处理领域展现出了极大的利用价值。然而,由于研究时间较短,目前将该类材料用于水处理的多个方面仍不太成熟,使其进入实际应用领域还需要进一步的探索。为了使GO从一种有潜力的吸附剂转变为可实际应用的吸附剂还需要从以下几个方面进行研究。
(1)目前GO对水中重金属离子的吸附尚停留在实验阶段,实验条件较为单一,而实际上水中除可能含有的重金属离子以外,还有微生物、有机质、矿物胶体等,且GO由于具有良好的分散性导致其极易与水中的微生物、有机质、矿物胶体等相接触,需要对水中其他成分与GO的相互影响关系及GO在自然界中的迁移转化进行深入研究,防止产生二次污染;
(2)与地表水体污染不同,地下水存在于不同介质中,而目前的GO吸附重金属离子实验研究很少考虑地下含水介质的影响,会限制GO在地下水污染修复治理工作中的应用,应考虑将GO与PRB等技术相结合,更好的发挥GO在水处理领域的作用;
(3)GO由于自身物理化学性质可很好的与多种材料相结合,在后续研究工作中,应进一步发挥GO的这一特性,针对不同条件的含重金属废水开发适合的GO复合物,增加GO的可利用性。
参考文献(References):
[1]SUD D,MAHAJAN G,KAUR M P.Agricultural waste material as potential adsorbent for sequestering heavy metal ions from aqueous solutions—A review[J].Bioresource Technology,2008,99(14):6017-6027.DOI:10.1016/j.biortech.2007.11.064.
[2]JRUP L.Hazards of heavy metal contamination.[J].Br Med Bull,2003,68(1):167-182.DOI:10.1093/bmb/ldg032.
[3]FU F,WANG Q.Removal of heavy metal ions from wastewaters:a review.[J].Journal of Environmental Management,2011,92(3):407-418.DOI:10.1016/j.jenvman.2010.11.011.
[4]BABEL S,KURNIAWAN T A.Low-cost adsorbents for heavy metals uptake from contaminated water:a review.[J].Journal of Hazardous Materials,2003,97(1):219-243.DOI:10.1016/S0304-3894(02)00263-7.
[5]ZOU Y,WANG X,KHAN A,et al.Environmental Remediation and Application of Nanoscale Zero-Valent Iron and Its Composites for the Removal of Heavy Metal Ions:A Review[J].Environmental Science & Technology,2016,50(14):7290-7304.DOI:10.1021/acs.est.6b01897.
[6]MACHIDA M,MOCHIMARU T,TATSUMOTO H.Lead(II) adsorption onto the graphene layer of carbonaceous materials in aqueous solution[J].Carbon,2006,44(13):2681-2688.DOI:10.1016/j.carbon.2006.04.003.
[7]LOH K P,BAO Q,ANG P K,et al.The chemistry of graphene[J].Journal of Materials Chemistry,2010,20(12):2277-2289.DOI:10.1039/b920539j.
[8]DIKIN D A,STANKOVICH S,ZIMNEY E J,et al.Preparation and characterization of graphene oxide paper[J].Nature,2016,448(7152):457-460.DOI:10.1038/nature06016.
[9]KIM J,COTE L J,KIM F,et al.Graphene Oxide Sheets at Interfaces[J].Journal of the American Chemical Society,2010,132(23):8180-6.DOI:10.1021/ja102777p.
[10]SZABT,BERKESI O,FORGP,et al.Evolution of surface functional groups in a series of progressively oxidized graphite oxides[J].Chemistry of materials,2006,18(11):2740-2749.DOI:10.1021/cm060258.
[11]WEI GAO.The Chemistry of Graphene Oxide[J].Chemical Society Reviews,2009,39(1):228-240.DOI:10.1039/b917103g.
[12]HOFMANN U,HOLST R.ber die Surenatur und die Methylierung von Graphitoxyd[J].European Journal of Inorganic Chemistry,1939,72(4):754-771.DOI:10.1002/cber.19390720417.
[13]RUESS G.ber das graphitoxyhydroxyd (graphitoxyd)[J].Monatshefte für Chemie und verwandte Teile anderer Wissenschaften,1947,76(3-5):381-417.DOI:10.1007/BF00898987.
[14]SCHOLZ W,BOEHM H P.Untersuchungen am graphitoxid.VI.Betrachtungen zur struktur des graphitoxids[J].Zeitschrift für anorganische und allgemeine Chemie,1969,369(3‐6):327-340.DOI:10.1002/zaac.19693690322.
[15]NAKAJIMA T,MABUCHI A,HAGIWARA R.A new structure model of graphite oxide[J].Carbon,1988,26(3):357-361.DOI:10.1016/0008-6223(88)90227-8.
[16]HE H,RIEDL T,LERF A,et al.Solid-state NMR studies of the structure of graphite oxide[J].The Journal of physical chemistry,1996,100(51):19954-19958.DOI:10.1021/jp961563t.
[17]LERF A,HE H,FORSTER M,et al.Structure of graphiteoxide revisited[J].The Journal of Physical Chemistry B,1998,102(23):4477-4482.DOI:10.1021/jp9731821.
[18]LERF A,HE H,RIEDL T,et al.13C and 1H MAS NMR studies of graphite oxide and its chemically modified derivatives[J].Solid State Ionics,1997,101:857-862.DOI:10.1016/S0167-2738(97)00319-6.
[19]CLAUSE A,PLASS R,BOEHM H P,et al.Untersuchungen zur struktur des graphitoxyds[J].Zeitschrift für anorganische und allgemeine Chemie,1957,291(5‐6):205-220.DOI:10.1002/zaac.19572910502.
[20]DIMIEV A M,ALEMANY L B,TOUR J M.Graphene Oxide.Origin of Acidity,Its Instability in Water,and a New Dynamic Structural Model[J].Acs Nano,2013,7(1):576-588.DOI:10.1021/nn3047378.
[21]GUO F,LIU Y,WANG H,et al.Adsorption behavior of Cr(VI) from aqueous solution onto magnetic graphene oxide functionalized with 1,2-diaminocyclohexanetetraacetic acid[J].Rsc Advances,2015,5(56):45384-45392.DOI:10.1039/c5ra02015h.
[22]DENG X J,LLILI,LI H W,et al.The adsorption properties of Pb(II) and Cd(II) on functionalized graphene prepared by electrolysis method.[J].Journal of Hazardous Materials,2010,183(1):923-930.DOI:10.1016/j.jhazmat.2010.07.117.
[23]STANKOVICH S,DIKIN D A,DOMMETT G H B,et al.Graphene-based composite materials[J].nature,2006,442(7100):282.DOI:10.1038/nature04969.
[24]PENG W,LI H,LIU Y,et al.A review on heavy metal ions adsorption from water by graphene oxide and its composites[J].Journal of Molecular Liquids,2017,230:496-504.DOI:10.1016/j.moliq.2017.01.064.
[25]YANG S,LI L,PEI Z,et al.Adsorption kinetics,isotherms and thermodynamics of Cr(III) on graphene oxide[J].Colloids & Surfaces A Physicochemical & Engineering Aspects,2014,457(1):100-106.DOI:10.1016/j.colsurfa.2014.05.062.
[26]ZHAO G,LI J,REN X,et al.Few-layered graphene oxide nanosheets as superior sorbents for heavy metal ion pollution management[J].Environmental Science & Technology,2011,45(24):10454.DOI:10.1021/es203439v.
[27]NAJAFI F,MORADI O,RAJABI M,et al.Thermodynamics of the adsorption of nickel ions from aqueous phase using graphene oxide and glycine functionalized graphene oxide[J].Journal of Molecular Liquids,2015,208:106-113.DOI:10.1016/j.molliq.2015.04.033.
[28]CARPIO I E M,MANGADLAO J D,HANG N N,et al.Graphene oxide functionalized with ethylenediamine triacetic acid for heavy metal adsorption and anti-microbial applications[J].Carbon,2014,77(10):289-301.DOI:10.1016/j.carbon.2014.05.032.
[29]WU W,YANG Y,ZHOU H,et al.Highly Efficient Removal of Cu(II) from Aqueous Solution by Using Graphene Oxide[J].Water Air & Soil Pollution,2013,224(1):1-8.DOI:10.1007/s11270-012-1372-5.
[30]SITKO R,TUREK E,ZAWISZA B,et al Adsorption of divalent metal ions from aqueous solutions using graphene oxide.[J].Dalton Transactions,2013,42(16):5682-5689.DOI:10.1039/c3dt33097d.
[31]WANG H,YUAN X,WU Y,et al.Adsorption characteristics and behaviors of graphene oxide for Zn(II) removal from aqueous solution[J].Applied Surface Science,2013,279(8):432-440.DOI:10.1016/j.apsusc.2014.02.049.
[32]ALIMOHAMMADY M,JAHANGIRI M,KIANI F,et al.Highly efficient simultaneous adsorption of Cd(II),Hg(II) and As(III) ions from aqueous solutions by modification of graphene oxide with 3-aminopyrazole:central composite design optimization[J].New Journal of Chemistry,2017,41(17).DOI:10.1039/c7nj01450c.
[33]LIU L,LIU S,ZHANG Q,et al.Adsorption of Au(III),Pd(II),and Pt(IV) from Aqueous Solution onto Graphene Oxide[J].Journal of Chemical & Engineering Data,2013,58(2):209-216.DOI:10.1021/je300551c.
[34]WANG J,CHEN B.Adsorption and coadsorption of organic pollutants and a heavy metal by graphene oxide and reduced graphene materials[J].Chemical Engineering Journal,2015,281:379-388.DOI:10.1016/j.cej.2015.06.102.
[35]SUN Y,WANG Q,CHEN C,et al.Interaction between Eu(III) and graphene oxide nanosheets investigated by batch and extended X-ray absorption fine structure spectroscopy and by modeling techniques.[J].Environmental Science & Technology,2012,46(11):6020.DOI:10.1021/es300720f.
[36]WU Y,ZHANG S,GUO X,et al.Adsorption of chromium(III) on lignin.[J].Bioresource Technology,2008,99(16):7709-7715.DOI:10.1016/j.biortech.2008.01.069.
[37]RAO M M,RAMANA D K,SESHAIAH K,et al.Removal of some metal ions by activated carbon prepared from Phaseolus aureus hulls.[J].Journal of Hazardous Materials,2009,166(2):1006-1013.DOI:10.1016/j.jhazmat.2008.12.002.
[38]H M H GAD,N S AWWAD.Factors Affecting on the Sorption/Desorption of Eu (III) using Activated Carbon[J].Separation Science & Technology,2007,42(16):3657-3680.DOI:10.1080/01496390701626495.
[39]LI Y H,WANG S,LUAN Z,et al.Adsorption of cadmium(II) from aqueous solution by surface oxidized carbon nanotubes[J].Carbon,2003,41(5):1057-1062.DOI:10.1016/S0008-6223(02)00440-2.
[40]ZHANG H,TONG Z,WEI T,et al.Removal characteristics of Zn(II) from aqueous solution by alkaline Ca-bentonite[J].Desalination,2011,276(1):103-108.DOI:10.1016/j.desal.2011.03.026.
[41]LI Y H,DING J,LUAN Z,et al.Competitive adsorption of Pb 2+,Cu 2+,and Cd 2+,ions from aqueous solutions by multiwalled carbon nanotubes[J].Carbon,2003,41(14):2787-2792.DOI:10.1016/S0008-6223(03)00392-0.
[42]KATAL R,HASANI E,FARNAM M,et al.Charcoal Ash as an Adsorbent for Ni(II) Adsorption and Its Application for Wastewater Treatment[J].Journal of Chemical & Engineering Data,2012,57(2):374-383.DOI:10.1021/je200953h.
[43]BHATNAGAR A,MINOCHA A K,SILLANPM.Adsorptive removal of cobalt from aqueous solution by utilizing lemon peel as biosorbent[J].Biochemical Engineering Journal,2010,48(2):181-186.DOI:10.1016/j.bej.2009.10.005.
[44]DASTGHEIB S A,ROCKSTRAW D A.A model for the adsorption of single metal ion solutes in aqueous solution onto activated carbon produced from pecan shells[J].Carbon,2002,40(11):1843-1851.DOI:10.1016/S0008-6223(02)00037-4.
[45]GU D,FEIN J B.Adsorption of metals onto graphene oxide:Surface complexation modeling and linear free energy relationships[J].Colloids & Surfaces A Physicochemical & Engineering Aspects,2015,481:319-327.DOI:10.1016/j.colsurfa.2015.05.026.
[46]YANG S,CHEN C,CHEN Y,et al.Competitive Adsorption of PbII,NiII,and SrII Ions on Graphene Oxides:A Combined Experimental and Theoretical Study[J].Chempluschem,2015,80(3):480-484.
[47]MORENO-CASTILLA C,LVAREZ-MERINO MA,PASTRANA-MARTNEZ L M,et al.Adsorption mechanisms of metal cations from water on an oxidized carbon surface[J].Journal of Colloid & Interface Science,2010,345(2):461.DOI:10.1016/j.jcis.2010.01.062.
[48]RAMESHA G K,KUMARA A V,MURALIDHARA H B,et al.Graphene and graphene oxide as effective adsorbents toward anionic and cationic dyes.[J].J Colloid Interface Sci,2011,361(1):270-277.DOI:10.1016/j.jcis.2011.05.050.
[49]LIU L,LI C,BAO C,et al.Preparation and characterization of chitosan/graphene oxide composites for the adsorption of Au(III) and Pd(II)[J].Talanta,2012,93(2):350-357.DOI:10.1016/j.talanta.2012.02.051.
[50]WU L,LIU L,GAO B,et al.Aggregation kinetics of graphene oxides in aqueous solutions:experiments,mechanisms,and modeling[J].Langmuir the Acs Journal of Surfaces & Colloids,2013,29(49):15174-15181.DOI:10.1021/la404134x.
[51]TAN P,SUN J,HU Y,et al.Adsorption of Cu(2+),Cd(2+) and Ni(2+) from aqueous single metal solutions on graphene oxide membranes[J].Journal of Hazardous Materials,2015,297:251.DOI:10.1016/j.jhazmat.2015.04.068.
[52]DURU L,EGE D,KAMALI A R.Graphene oxides for removal of heavy and precious metals from wastewater[J].Journal of Materials Science,2016,51(13):6097-6116.DOI:10.1007/s10853-016-9913-8.
[53]CHOWDHURY I,DUCH M C,MANSUKHANI N D,et al.Colloidal properties and stability of graphene oxide nanomaterials in the aquatic environment[J].Environmental science & technology,2013,47(12):6288-6296.DOI:10.1021/es400483k.
[54]GOLDBERG S.Inconsistency in the triple layer model description of ionic strength dependent boron adsorption[J].Journal of Colloid & Interface Science,2005,285(2):509-517.DOI:10.1016/j.jcis.2004.12.002.
[55]LUTZENKIRCHEN J.Ionic strength effects on cation sorption to oxides:Macroscopic observations and their significance in microscopic interpretation[J].Journal of Colloid & Interface Science,1997,195(1):149.DOI:10.1006/jcis.1997.5160.
[56]吳志坚,刘海宁,张慧芳.离子强度对吸附影响机理的研究进展[J].环境化学,2010,29(6):997-1003.(WU Z J,LIU H N,ZHANG H F.The review of adsorption mechanism influenced by ion strength[J].Environmental Chemical,2010,29(6):997-1003.(in Chinese))
[57]GUPTA V K,MITTAL A,VIBHA GAJBE A,et al.Removal and recovery of the hazardous azo dye acid orange 7 through adsorption over waste materials:Bottom ash and De-Oiled Soya[J].Industrial & Engineering Chemistry Research,2006,45(4):págs.1446-1453.DOI:10.1021/ie051111f.
[58]NASUHA N,HAMEED B H.Adsorption of methylene blue from aqueous solution onto NaOH-modified rejected tea[J].Chemical Engineering Journal,2011,166(2):783-786.DOI:10.1016/j.cej.2010.11.012.
[59]LI Y,DU Q,LIU T,et al.Equilibrium,kinetic and thermodynamic studies on the adsorption of phenol onto graphene[J].Materials Research Bulletin,2012,47(8):1898-1904.DOI:10.1016/j.materresbull.2012.04.021.
[60]ZHANG X,CHENG C,ZHAO J,et al.Polyethersulfone enwrapped graphene oxide porous particles for water treatment[J].Chemical Engineering Journal,2013,s 215-216(2):72-81.DOI:10.1016/j.cej.2012.11.009.
[61]SAEID AZIZIAN.Kinetic models of sorption:a theoretical analysis[J].Journal of Colloid And Interface Science,2004,276(1):47-52.DOI:10.1016/j.jcis.2004.03.048.
[62]HO Y S,MCKAY G.Pseudo-second order model for sorption processes[J].Process Biochemistry,1999,34(5):451-465.DOI:10.1016/S0032-9592(98)00112-5.
[63]YUH-SHAN HO.Review of second‐order models for adsorption systems[J].Journal of Hazardous Materials,2006,136(3):681-689.DOI:10.1016/j.jhazmat.2005.12.043.
[64]SARKAR M,ACHARYA P K,BHATTACHARYA B.Modeling the adsorption kinetics of some priority organic pollutants in water from diffusion and activation energy parameters[J].Journal of Colloid & Interface Science,2003,266(1):28-32.DOI:10.1016/S0021-9797(03)00551-4.
[65]VENKATA M S,CHANDRASEKHAR R N,KARTHIKEYAN J.Adsorptive removal of direct azo dye from aqueous phase onto coal based sorbents:a kinetic and mechanistic study.[J].Journal of Hazardous Materials,2002,90(2):189-204.DOI:10.1016/S0304-3894(01)00348-X.
[66]LIMOUSIN G,GAUDET J P,CHARLET L,et al.Sorption isotherms:A review on physical bases,modeling and measurement[J].Applied Geochemistry,2007,22(2):249-275.DOI:10.1016/j.apgeochem.2006.09.010.
[67]ALLEN S J,MCKAY G,PORTER J F.Adsorption isotherm models for basic dye adsorption by peat in single and binary component systems[J].J Colloid Interface Sci,2004,280(2):322-333.DOI:10.1016/j.jcis.2004.08.078.
[68]LANGMUIR I.The constitution and fundamental properties of solids and liquids.part i.solids.[J].Journal of the Franklin Institute,1917,184(5):102-105.DOI:10.1016/S0016-0032(17)90938-X.
[69]FOO K Y,HAMEED B H.Insights into the modeling of adsorption isotherm systems.[J].Chemical Engineering Journal,2010,156(1):2-10.DOI:10.1016/j.cej.2009.09.013.
[70]HUI L I,XIAO D L,HUA H E,et al.Adsorption behavior and adsorption mechanism of Cu(II) ions on amino-functionalized magnetic nanoparticles[J].Transactions of Nonferrous Metals Society of China,2013,23(9):2657-2665.DOI:10.1016/S1003-6326(13)62782-X.
[71]STANKOVICH S,PINER R D,CHEN X,et al.Stable aqueous dispersions of graphitic nanoplatelets via the reduction of exfoliated graphite oxide in the presence of poly(sodium 4-styrenesulfonate)[J].Journal of Materials Chemistry,2005,16(2):155-158.DOI:10.1039/b512799h.
[72]DING J,TANG S,CHEN X,et al.Introduction of benzotriazole into graphene oxide for highly selective coadsorption of An and Ln:facile synthesis and theoretical study[J].Chemical Engineering Journal,2018.DOI:10.1016/j.cej.2018.03.114.
[73]KANG B K,LIM B S,YOON Y,et al.Efficient removal of arsenic by strategically designed and layer-by-layer assembled PS@+rGO@GO@Fe3O4 composites[J].Journal of Environmental Management,2017,201:286-293.DOI:10.1016/j.jenvman.2017.05.066.
[74]LI X,WANG Z,LI Q,et al.Preparation,characterization,and application of mesoporous silica-grafted graphene oxide for highly selective lead adsorption[J].Chemical Engineering Journal,2015,273:630-637.DOI:10.1016/j.cej.2015.03.104.
[75]ZHANG F,WANG B,HE S,et al.Preparation of graphene-Oxide/Polyamidoamine dendrimers and their adsorption properties toward some heavy metal ions[J].Journal of Chemical & Engineering Data,2014,59(5):1719-1726.DOI:10.1021/je500219e.
[76]GE H,MA Z.Microwave preparation of triethylenetetramine modified graphene oxide/chitosan composite for adsorption of Cr(VI)[J].Carbohydrate Polymers,2015,131:280-287.DOI:10.1016/j.carbpol.2015.06.025.
[77]LEI Y,CHEN F,LUO Y,et al.Synthesis of three-dimensional graphene oxide foam for the removal of heavy metal ions[J].Chemical Physics Letters,2014,593(6):122-127.DOI:10.1016/j.cplett.2013.12.066.
[78]劉阳,顾平,张光辉.氧化石墨烯分离膜的制备及其水处理领域的应用进展[J].化工进展,2017,36(11):4151-4159.(LIU Y,PING G U,ZHANG G.Fabrication of graphene oxide-assisted membranes and its applications in water treatment and purification[J].Chemical Industry & Engineering Progress,2017.(in Chinese))
[79]ZHANG Y,ZHANG S,CHUNG T S.Nanometric graphene oxide framework membranes with enhanced heavy metal removal via nanofiltration[J].Environmental Science & Technology,2015,49(16):10235-10242.DOI:10.1021/acs.est.5b02086.
[80]MUKHERJEE R,BHUNIA P,DE S.Impact of graphene oxide on removal of heavy metals using mixed matrix membrane[J].Chemical Engineering Journal,2016,292:284-297.DOI:10.1016/j.cej.2016.02.015.
[81]CHAUKE V P,MAITY A,CHETTY A.High-performance towards removal of toxic hexavalent chromium from aqueous solution using graphene oxide-alpha cyclodextrin-polypyrrole nanocomposites[J].Journal of Molecular Liquids,2015,211(2939):71-77.DOI:10.1016/j.molliq.2015.06.044.
[82]CHEN J,XING H,GUO H,et al.adsorbent[J].Journal of Materials Chemistry A,2014,2(31):12561-12570.DOI:10.1039/c4ta02004a.
[83]ZHANG H,CHANG Q,JIANG Y,et al.Synthesis of KMnO4-treated magnetic graphene oxide nanocomposite (Fe3O4@ GO/MnO x) and its application for removing of Cu2+ ions from aqueous solution[J].Nanotechnology,2018,29(13):135706.DOI:10.1088/1361-6528/aaaa2f.
[84]LI X,ZHOU H,WU W,et al.Studies of heavy metal ion adsorption on chitosan/sulfydryl-functionalized graphene oxide composites.[J].J Colloid Interface Sci,2015,448:389-397.DOI:10.1016/j.jcis.2015.02.039.
[85]DONG Z,ZHANG F,WANG D,et al.Polydopamine-mediated surface-functionalization of graphene oxide for heavy metal ions removal[J].Journal of Solid State Chemistry,2014,224:88-93.DOI:10.1016/j.jssc.2014.06.030.
[86]LIU L,DING L,WU X,et al.Enhancing the Hg(II) removal efficiency from real wastewater by novel thymine-grafted reduced graphene oxide complexes[J].2016,55(24).DOI:10.1021/acs.iecr.6b01359.
