发酵饲料替代抗生素对断奶仔猪生产性能和血液指标的影响
2018-01-31北京市畜牧总站100029
北京市畜牧总站 100029
李富伟 刘东霞 北京科为博生物技术研究院 100086
在现代养猪生产模式中,仔猪早期断奶是提高母猪生产性能的重要手段之一,国内大多采用3~5周龄断奶。如果强制早期断奶,极易引发仔猪腹泻和生长停滞等断奶应激综合症,影响经济效益。目前,大多数养殖场都会用抗生素来治疗和预防仔猪疾病,达到减缓应激和促进生长的目的[1]。但是抗生素的副作用越来越受到全社会的广泛关注。目前,用绿色环保型饲料替代抗生素已成为未来饲料行业研究的重点和发展方向。
我国发酵饲料技术起步要晚于欧美国家,但是在近几年发展迅速。陆文清[2]指出,微生物发酵饲料是指在人为可控制的条件下,以植物性农副产品为主要原料,通过微生物的代谢作用,将植物性、动物性和矿物性物质中的抗营养因子分解、合成,产生更能被畜禽采食、消化、吸收的养分和无毒害作用的生物饲料或饲料原料。目前,我国发酵饲料的应用遍及家禽、水产、反刍动物以及猪等养殖业各个领域。有研究表明,用液体发酵饲料饲喂仔猪,可增加仔猪肠道内的乳酸菌数目,减少有害菌的滋生[3]。本试验旨在研究用以玉米豆粕为主的发酵饲料替代金霉素对断奶仔猪生产性能、腹泻和血液指标的影响。
1 材料与方法
(1)发酵饲料。试验用复合益生菌剂由北京科为博研究院研制并提供,活菌数≥2.66×109CFU/g。复合益生菌制剂主要成分为屎肠球菌、枯草芽孢杆菌、地衣芽孢杆菌和酵母菌等。发酵饲料底物为玉米∶豆粕(6∶4)混合原料,料水比为 1∶0.55,接种比例为 5%,发酵3天。发酵后粗蛋白含量为26.46%、芽孢杆菌数为5.2×106CFU/g、乳酸菌数为 3.4×109CFU/g、酵母菌数为4.1×106CFU/g。
(2)试验设计。试验采用单因子设计,选取120头(29±2)日龄、平均体重为(7.98±0.05)kg 的杜长大三元杂交断奶仔猪,按体重、性别和胎次基本一致原则分为3个处理组,每组4个重复,每个重复10头猪(公、母各半),每个重复为1栏。对照组添加60mg/kg的金霉素,试验I组添加30mg/kg的金霉素+5%的发酵饲料,试验II组添加10%的发酵饲料。预试期3天,试验期28天。3组试验仔猪日粮组成和营养水平均基本相同,参照《猪饲养标准》(NY/T65-2004)设计基础饲粮(表 1)。

表1 日粮组成及营养水平(%,饲料基础)
(3)饲养管理。试验前充分冲洗和严格消毒猪圈。试验期间每天喂料5次,以食槽内略剩料为原则。试验仔猪在漏缝地面上饲养,自由采食、自由饮水。圈舍自然通风,定期打扫,常规接种免疫,试验期为28天。
(4)指标测定及方法。①生产性能。试验全程以重复(栏)为单位记录采食量,分别于试验第1天和第29天龙早上8:00对空腹仔猪称重,计算每头仔猪的平均日增重(ADG)、平均日采食量(ADFI)和料重比(F/G),具体计算方法如下:
平均日增重 (ADG,kg/天)=栏总增重/(栏仔猪数×试验天数);平均日采食量(ADFI,kg/d)=栏饲粮总消耗量/(栏仔猪数×试验天数);料重比(F/G)=ADFI/ADG。
②腹泻率。试验期间每天早上9∶00观察仔猪粪便,并做好记录。腹泻率(DR,%)={(每栏仔猪腹泻头数×腹泻天数)/(每栏仔猪总数×试验天数)}×100%。③血液生化指标。试验第29天早上9∶00,每个组每个重复选1头接近平均体重的仔猪,前腔静脉采血15mL,分装成2管,常温下静置 30min,3500r/min、4℃离心10min,分别制备血清及血浆,取上清液分装于EP管中,-20℃保存。血清总蛋白和血清尿素氮含量的测定采用南京建成生物研究所的试剂盒。
(5)数据处理与分析。采用SPSS 19.0软件进行显著性方差分析,用LSD法进行多重比较。
2 结果
(1)发酵饲料替代抗生素对断奶仔猪生长性能的影响。由表2可知,试验I组和试验II组日增重显著高于对照组(P<0.05),试验I组日增重比对照组高了5.56%,试验II组日增重比对照组高了6.48%,试验I组和试验II组日增重差异不显著;此外,3组日采食量和料重比均无显著差异(P>0.05),但试验I组和试验II组料重比与对照组相比,降低了11.34%。
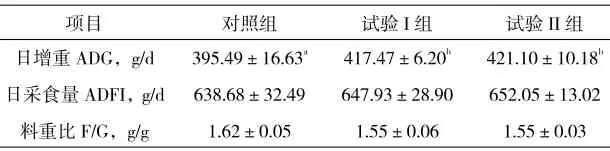
表2 发酵饲料替代抗生素对断奶仔猪生长性能的影响
(2)发酵饲料替代抗生素对断奶仔猪腹泻率的影响。由表3可知,试验I组和试验II组腹泻率显著低于对照组 (P<0.05),试验 I组腹泻率比对照组低14.24%,试验II组腹泻率比对照组低17.42%,试验I组和试验II组腹泻率差异不显著;(P>0.05)。

表3 发酵饲料替代抗生素对断奶仔猪腹泻率的影响
(3)发酵饲料替代抗生素对断奶仔猪血液指标的影响。由表4可知,3组血清总蛋白差异不显著 (P>0.05)。但试验I组和试验II组血清尿素氮显著低于对照组 (P<0.05),试验I组血清尿素氮比对照组低7.88%,试验II组腹泻率比对照组低了8.70%,试验I组与试验II组差异不显著(P>0.05)。
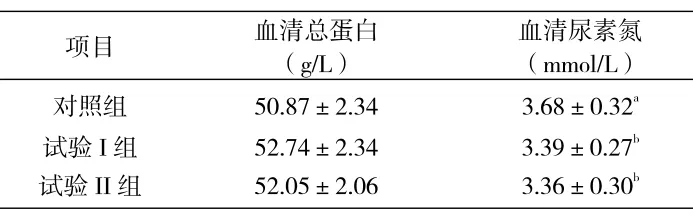
表4 发酵饲料替代抗生素对断奶仔猪血清总蛋白和尿素氮的影响
3 讨论
(1)发酵饲料替代抗生素对断奶仔猪生长性能的影响。本试验中发酵饲料采用枯草芽孢杆菌、地衣芽孢杆菌、屎肠球菌和酵母菌等复合益生菌发酵而成。一方面,发酵饲料中含有大量的芽孢杆菌和乳酸菌等有益菌,可通过竞争性抑制病原菌在肠黏膜附着与繁殖。Tuomola等[4]、Forestier[5]研究表明,发酵饲料中有益菌通过微生物菌群间相互作用抑制病原菌群定植的作用,维持妊娠母猪肠道菌群正常,提高母猪生产性能。张海棠等[9]研究发现,与抗生素组相比,益生素及中草药组日增重均提高,耗料增重比降低。陈振等[10]研究表明,与抗生素组相比,复合益生菌组日增重显著提高,料重比显著降低。另一方面,豆粕经微生物发酵后,可产生一些具有特殊生理活性的小肽,能够直接被动物吸收,参与机体的生理活动,同时还可降低豆粕中的抗营养因子,从而促进动物生产性能的提高。Hong等(2004)[6]研究表明,对豆粕进行发酵处理后,可显著降低大分子抗原蛋白和胰蛋白酶等抑制因子含量。Kiers(2003)[7]研究发现,用发酵豆粕饲喂仔猪,可显著提高仔猪的日增重和采食量。胡文琴等(2004)[8]认为被酶解后的豆粕,不仅具有与豆粕相同的必需氨基酸组成,而且可提高豆粕的消化吸收利用率,还能最大限度地加速氮的同化。本研究结果和前人结论基本一致,在本试验中,用发酵饲料替代抗生素可提高仔猪的生产性能,而且日增重显著高于对照组(抗生素组)。综合生产性能指标来看,用10%发酵饲料全部替代抗生素组效果最好。
(2)发酵饲料替代抗生素对断奶仔猪腹泻率的影响。研究发现,当仔猪腹泻时,其肠道内菌群失衡,专性厌氧菌减少,兼性厌氧菌中大肠杆菌增加,而肠毒性大肠杆菌是导致仔猪腹泻的一个重要原因。一方面,肠毒性大肠杆菌的增殖可引起pH值和氧化还原电势迅速上升;另一方面,肠毒性大肠杆菌可产生毒素,毒素刺激肠细胞,致使肠细胞分泌机能亢进,肠蠕动增强而产生腹泻,病理变化主要在小肠[11,12]。因此,防止断奶仔猪产生腹泻的重要方法是维持肠道菌群的平衡。冯杰等(2007)[13]试验表明,用发酵豆粕饲喂断奶仔猪后,有利于小肠上皮细胞和微绒毛的发育。陈曦等[14]研究发现,屎肠球菌对于肠道微生态的影响除通过自身定殖外,更主要的是通过改变肠道中其他细菌的丰度和多样性,从而间接作用于宿主。尹清强等[15]报道,在仔猪的教槽料和保育料中分别加入 0.1% 和 0.05% 微生态制剂,与添加抗生素的对照组相比,可明显降低仔猪的腹泻率和死亡率。谢全喜等[16]研究表明,在防治断奶仔猪腹泻方面,复合微生态制剂与抗生素可以达到同样的效果。本试验结果表明,用发酵饲料替代抗生素后,断奶仔猪腹泻发生率显著低于对照组,而且用10%发酵饲料全部替代抗生素组效果最好。
(3)发酵饲料替代抗生素对断奶仔猪血液指标的影响。血清生化指标的变化反映了动物在面对应激时体内物质代谢和组织器官机能状态的改变[17]。血清总蛋白包括血清白蛋白和血清球蛋白等,总蛋白可反映机体的营养与免疫状况。宋凡等[18]添加0.2%“蜡样芽孢杆菌+乳酸菌+酵母菌”复合菌剂,以及李瑞等[19]给断奶仔猪灌服德氏乳杆菌菌液,对血清总蛋白均无显著影响。孙梅等[20]研究表明,添加芽孢杆菌复合剂对断奶仔猪血清总蛋白和差异不显著。本研究也得到了相同的结果,这表明用发酵饲料替代抗生素对断奶仔猪血清总蛋白没有影响。
伍淳操等[21]报道添加乳酸菌制剂能够显著降低断奶仔猪的血清尿素氮水平。众所周知,尿素是蛋白质和氨基酸在哺乳动物体内的代谢终产物,在本试验中,对照组仔猪血清尿素含量高于试验组,说明进入对照组仔猪体内的蛋白质和氨基酸有更多被转化为尿素而损失,因此用发酵饲料替代抗生素饲喂断奶仔猪,可提高蛋白质和氨基酸的有效利用率。
4 结论
本试验条件下,用5%的发酵饲料替代30mg/kg金霉素和用10%的发酵饲料替代60mg/kg金霉素日增重均显著高于对照组,腹泻率和血清尿素氮均显著低于对照组 (P<0.05),可提高日采食量和血清总蛋白,降低料重比,但差异均不显著(P>0.05)。
[1]Hofer U.Effects of in-feed antibiotics on pig microbiota[J].Nat Rev Microbiol,2014,12(4):234.
[2]陆文清,胡起源.微生物发酵饲料的生产与应用[J].饲料与畜牧:新饲料,2008(7):5-9.
[3]KOBASHIY,OHMORIH,TAJIMAK,etal.Reductionof chlortetracycline-resistant Escherichia coli in weaned piglets fed fermented liquid feed[J].Anaerobe,2008,14(4):201-204.
[4]TUOMOLA E M,OUWEHAND A C,SALMINEN S J.The effect of probiotic bacteria on the adhesion of pathogens to human intestinal mucus[J].FEMS Immunology&Medical Microbiology,1999,26(2):137-142.
[5]FORESTIER C,DE CHAMPS C,VATOUX C,et al.Probiotic activities of Lactobacillus casei rhamnosus:in vitro adherence to intestinalcells and antimicrobialproperties [J].Research in Microbiology,2001,152(2):167-173.
[6]Hong K J,Lee C H,Kim S W.Aspergillus oryzae GB-107 fermentation improves nutritional quality of food soybeans and feed soybean meals.J.Journal of Medieine Food,2004(4),430-434.
[7]KiersJ L,J C Meijer,M J R Nout,Rombouts F M,Nabuurs M J A,Meulen J.Effect of fermented soybeans on diarrhea and feed efficiency in weaned piglets.J.Jounal of Applied Microbiology,2003,95(3):545一555.
[8]胡文琴,孟庆利,程宗佳.膨化大豆对猪生产性能的影响[J].饲料广角,2004,(19):23一24.
[9]张海棠,王艳荣,王自良,等.中草药,益生素和抗生素对猪生长性能和免疫功能的影响比较试验[J].中国饲料,2011,(15):29-30.
[10]陈振,谢全喜,元秀晔等.复合益生菌替代抗生素对断奶仔猪生长性能、胃肠道pH和免疫器官指数的影响[J].中国畜牧杂志,2017年第53卷第4期.
[11]周振峰.地衣芽孢杆菌对奶牛泌乳性能的影响[J].中国奶牛,2006,(5):13-14.
[12]禹慧明,廖玲,陈平洁,等.断奶仔猪肠道菌群的研究[J].中国微生态学杂志,2000,12(2):81-82.
[13]冯杰,刘欣,卢亚萍,刘媛媛.微生物发酵豆粕对断奶仔猪生长、血清指标及肠道形态的影响[J].动物营养学报,2007,19(l):42-43.
[14]陈曦,李英英,宋铁英.单一益生菌(屎肠球菌)介导的断奶仔猪肠道菌群变化规律[J].福建农业学报,2016.31(10):1091-1097.
[15]尹清强,李小飞,常娟.微生态制剂对哺乳和断奶仔猪生产性能的影响及作用机理研究[J].动物营养学报,2011,23(4):622-630.
[16]谢全喜,元秀晔,陈振,等.复合微生态制剂对断奶仔猪生长性能、腹泻率、免疫性能和肠道菌群的影响[J].动物营养学报.2017.29(3):850-858.
[17]董淑丽,王占彬,雷雪芹,等.热应激对动物血液生化指标的影响[J].家畜生态,2004,25(2):54-56.
[18]宋凡,曹国文,戴荣国,等.复合微生态制剂对断奶仔猪生产性能与血液生理生化指标的影响[J].饲料工业,2006,27(8):36-38.
[19]李瑞,侯改凤,黄其永,等.德氏乳杆菌对哺乳仔猪生长性能、血清生化指标免疫和抗氧化功能的影响 [J].动物营养学报,2013,25(12):2943-2950.
[20]孙梅,张一平,张宪中,等.芽孢杆菌制剂对断奶仔猪血液和免疫指标的影响[J].中国畜牧兽医,2015,42(11):2991-2998.
[21]伍淳操,王建华.乳酸菌和甘露寡糖对断奶仔猪生长及血清生化指标的影响[J]江苏农业学报,2011,27(1):94-99.
