油菜中转基因成分的筛查检测策略
2018-01-31刘冰
刘 冰
(1.陕西省种子管理站,西安 710018;2.农业部农作物种子质量监督检验测试中心(西安) ,西安 710018)
油菜属于十字花科芸薹属,是重要的油料作物和优质的蛋白饲料作物,也是转基因技术应用较多的农作物[1]。从 1996- 2015年的 20 a间,全球转基因作物累计种植面积达20亿hm2,其中转基因油菜累计种植面积达到1亿hm2,仅次于大豆、玉米和棉花[2]。转移到油菜中的外源基因至少有50个,目标性状主要涉及抗除草剂、杂交系统(雄性不育/恢复)、抗虫和种子成分改变(如改变种子脂肪酸构成、改变蛋白质构成等)等[3]。截至2017年3月,全球商业化的转基因油菜转化事件有24个[4-6]。中国尚未批准转基因油菜的商业化种植,但已批准7个转基因油菜的转化事件作为加工用途进口[7],分别为孟山都公司的GT73( RT73) 和拜尔公司的MS1RF1、MS1RF2、MS8RF3、OXY235、T45和Topas19/2。
中国每年需要进口大量油菜籽用于加工食用油。 按照《农业转基因生物安全管理条例》及配套办法的规定,农业转基因生物从试验研究、种子品种审定、生产、销售、田间种植到农产品加工消费和进出口贸易等诸多环节都要采取严格的安全控制措施[8]。实现对这些环节的全覆盖监管,就需要加大转基因抽查检测的力度,从大量的非转基因油菜样品中快速、准确地筛查出个别的转基因样品[9]。
转基因产品分子检测主要包括DNA检测和蛋白质检测,基于DNA 的PCR检测技术在转基因检测中应用最广。其中PCR筛查法是以几个使用频率最高的遗传元件作为检测靶标,如果检测出其中任何一个元件,表明该样品含有转基因成分;如果未检出,则表明样品中不含有已知转基因成分[9-10]。该方法灵敏度高、特异性强,可检出的转基因转化事件多,也是中国种子检测机构普遍使用的转基因成分检测方法。
目前,关于转基因油菜筛查检测的报道多以中国批准进口的7个转基因油菜的转化事件为检测目标[10-13],而全球商业化的转基因油菜转化事件有24个,检测覆盖面明显不足。本研究检索已知24个商业化转基因油菜的常用转化遗传元件信息,根据不同元件的使用频率建立转基因油菜的筛查检测策略,同时确定转基因油菜筛查的靶标元件和检测方法,并利用农业部农作物种子质量监督测试中心(西安)保存的9个转化事件对方法的特异性和灵敏度进行研究。
1 材料与方法
1.1 材 料
转基因油菜粉末Oxy235、Topas19/2、T45、MS1RF1、MS1RF2、MS8RF3、GT73、MON88302、MS8xRF3xRT73,非转基因油菜种子‘秦荣6号’,由农业部农作物种子质量监督检验测试中心(西安)收藏。
新型植物基因组提取试剂盒(DP320) 购自天根生化科技(北京)有限公司。PCR扩增试剂(Premix ExTaq,R003A)、DNA分子质量Marker(DL1000,3591A)购自宝生物工程(大连)有限公司。扩增引物由宝生物工程(大连)有限公司合成。
1.2 试验方法
1.2.1 基因组DNA提取 样品基因组DNA提取采用试剂盒法,提取方法参照试剂盒说明。10 g/L琼脂糖凝胶电泳检测DNA样品的完整性。
1.2.2 定性PCR检测 定性PCR使用ABI 2720 PCR仪进行扩增,PCR产物用20 g/L琼脂糖凝胶电泳进行检测。检测项目包括CaMV35S启动子、NOS终止子、bar基因、pat基因、 CP4-epsps基因、NPTII基因6个靶标原件。定性PCR 的引物及扩增程序等反应条件参照农业部相关行业标准(表1)。
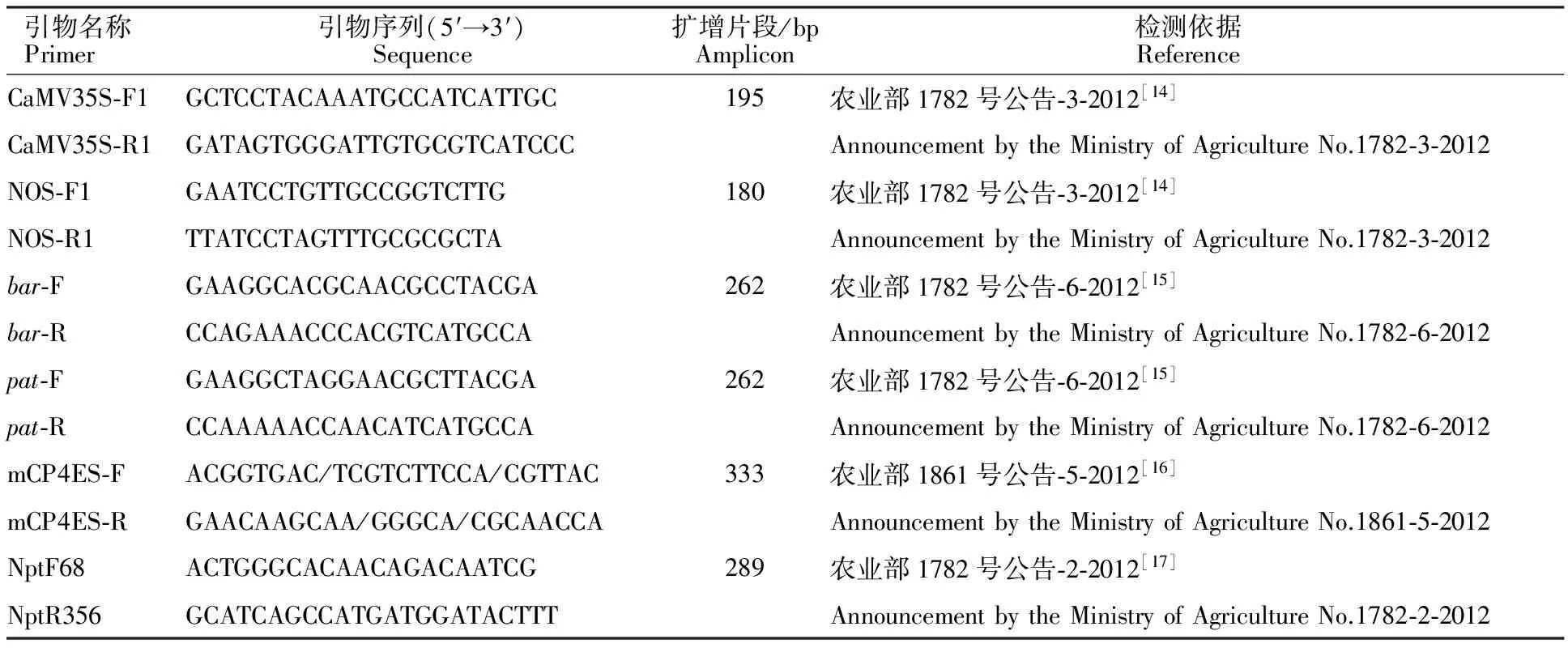
表1 检测中所用的引物序列、扩增片段长度及检测依据Table 1 Primers,amplicon and reference
2 结果与分析
2.1 转基因油菜的遗传信息及筛查策略
检索环境风险评估中心转基因作物数据库(CERA,http: ∥www.cera-gmc.org)[4]、欧洲转基因生物指南(http: ∥www.gmo-compass.org/eng/gmo/db)[5]、上海交通大学转基因检测数据库(GMDD,http: ∥gmdd.shgmo.orgwww.gmo-compass.org/)[6]中转基因油菜的遗传信息(详见表2)。目前商业化转基因油菜转化事件有24个。NOS终止子出现频率最高为13次、NPTII基因9次、CaMV 35S启动子7次、bar基因6次、pat基因和 CP4-epsps基因均为5次。因此,利用CaMV35S启动子、NOS终止子、bar基因、pat基因、 CP4-epsps基因和NPTII基因6个靶标元件的组合,理论上可筛查出22个转基因油菜转化事件,占已知商业化转基因油菜转化事件的92%;另有2个转化事件61061和73496 2012年才被批准商业化,虽然检索出含有PINII终止子和 gat4621基因,但其遗传信息检测的相关研究报道较少,暂时无法检测。
2.2 转基因油菜PCR筛查特异性检测
为验证表1中选择的扩增引物是否适合不同转化事件中转基因成分的筛查,利用农业部农作物种子质量监督检验测试中心(西安)已有的9个转基因油菜的转化事件Oxy235、Topas19/2、T45、MS1RF1、MS1RF2、MS8RF3、GT73、MON88302、MS8xRF3xRT73进行验证。结果如图1所示。CaMV 35S启动子检测中,Oxy235、Topas19/2、T45检测结果为阳性,其他为阴性;NOS终止子检测中,Oxy235、MS1RF1、MS1RF2、MS8RF3、MS8xRF3xRT73为阳性,其他为阴性;bar基因检测中,MS1RF1、MS1RF2、MS8RF3、MS8xRF3xRT73为阳性,其他为阴性;pat基因检测中,Topas19/2、T45为阳性,其他为阴性; CP4-epsps基因检测中,GT73、MON88302、MS8xRF3xRT73为阳性,其他为阴性。NPTII基因检测中,MS1RF1、MS1RF2为阳性,其他为阴性。以上结果与转基因油菜转化事件遗传信息(表2)符合。表明本研究选用的引物序列在不同转化事件的检测中具有较好的特异性。
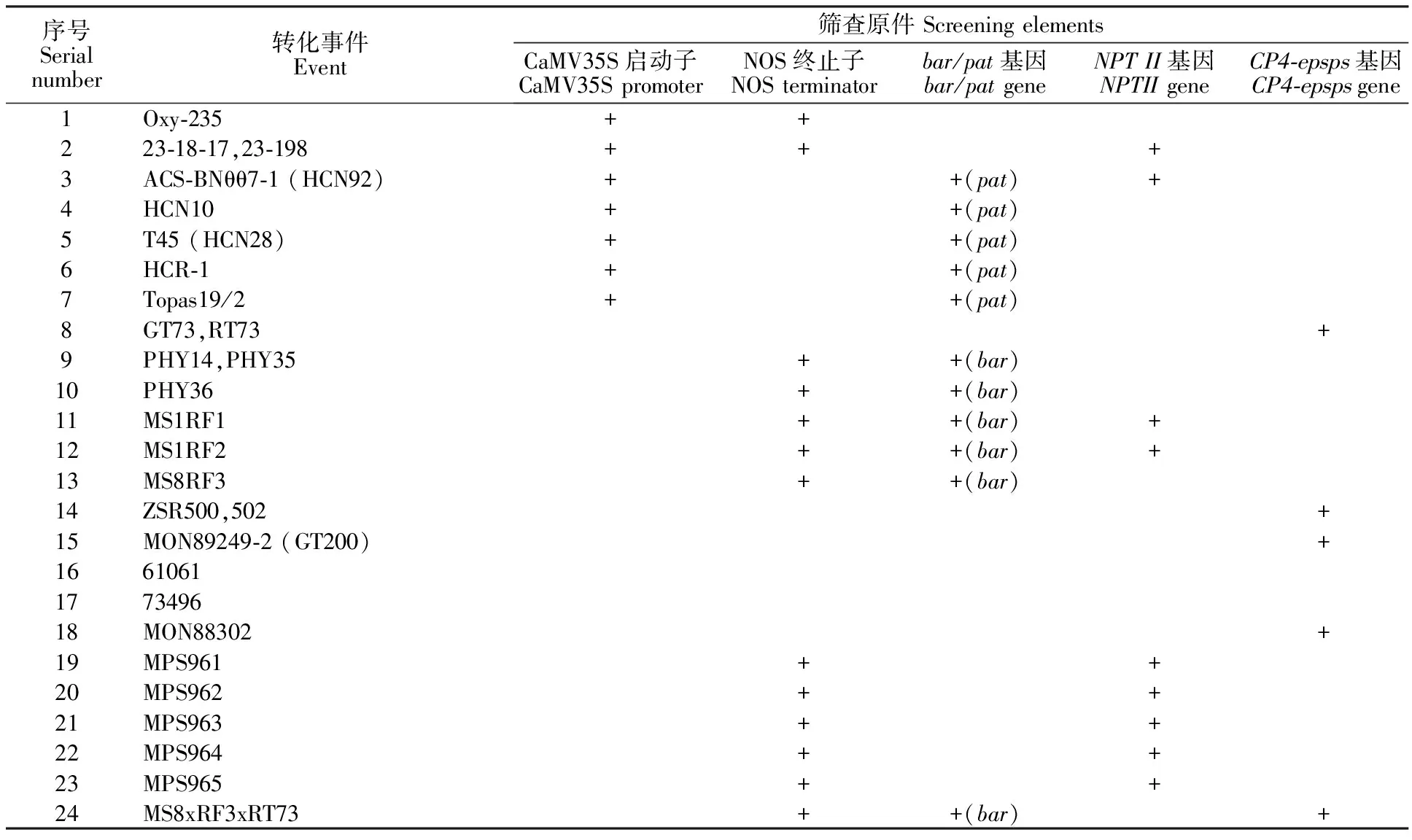
表2 转基因油菜转化事件常用遗传信息Table 2 Common genetic information of GM rapeseed event
注:“+”表示含有此元件。
Note: “+”existence of the element.
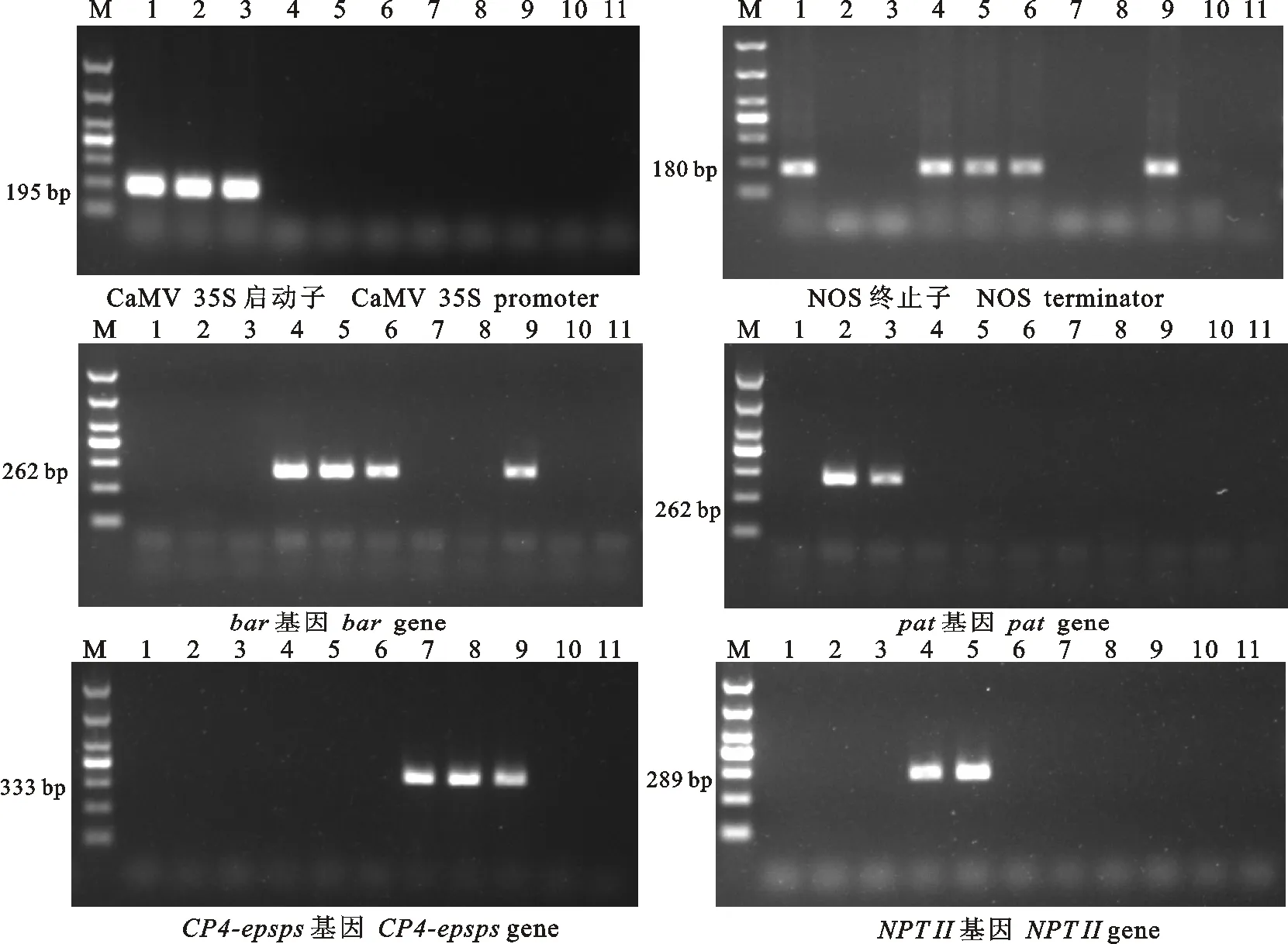
M.DNA marker DL1000; 1~11.分别是转基因油菜Oxy235、Topas19/2、T45、MS1RF1、MS1RF2、MS8RF3、GT73、MON88302、MS8xRF3xRT73、非转基因油菜‘秦荣6号’和空白对照 Genetically modified rapeseed Oxy235,Topas19/2,T45,MS1RF1,MS1RF2,MS8RF3,GT73,MON88302,MS8xRF3xRT73,‘Qinrong 6’ and no DNA control,respectively
图1转基因油菜PCR筛查法的特异性检测
Fig.1SpecifictestofPCRscreeningmethodinGMrapeseed
2.3 转基因油菜PCR筛查灵敏度检测
将不同质量的转基因油菜T45、MS1RF1和MS8xRF3xRT73粉末分别与非转基因油菜‘秦荣6号’粉末混合,使混合后样品中转基因粉末的质量分数分别为1 000、100、10、1、0.1、0 g/kg。检测混合后6个质量分数不同的转基因粉末样品。结果如图2所示,CaMV35S启动子、NOS终止子、bar基因、pat基因、 CP4-epsps基因和NPTII基因的检测中,转基因粉末的质量分数为1 000、100、10、1 g/kg的混合样品中均扩增出条带,而转基因粉末质量分数为0.1 g/kg的混合样品未扩增出条带,说明本研究选用的扩增引物灵敏度可达到1 g/kg。
2.4 转基因油菜转化事件鉴定路线图
在油菜转基因成分检测过程中时,除要检测样品是否含有转基因成分,还必须尽可能确认样品究竟含有哪个转化事件。按照图3所示的筛查路线图,利用CaMV35S启动子、NOS终止子、pat基因、bar基因、 CP4-epsps基因、NPTII基因、PINII终止子7个筛查元件,可以逐步缩小怀疑范围,直至通过个别转化事件的特异性引物确认样品究竟含有哪个转化事件。与利用24个不同转化事件特异性引物逐一确认的方法相比,利用该路线进行样品中的转基因成分筛查可以极大地减少检测工作量,高效地完成转化事件的确认,更好地为转基因安全监管工作服务。
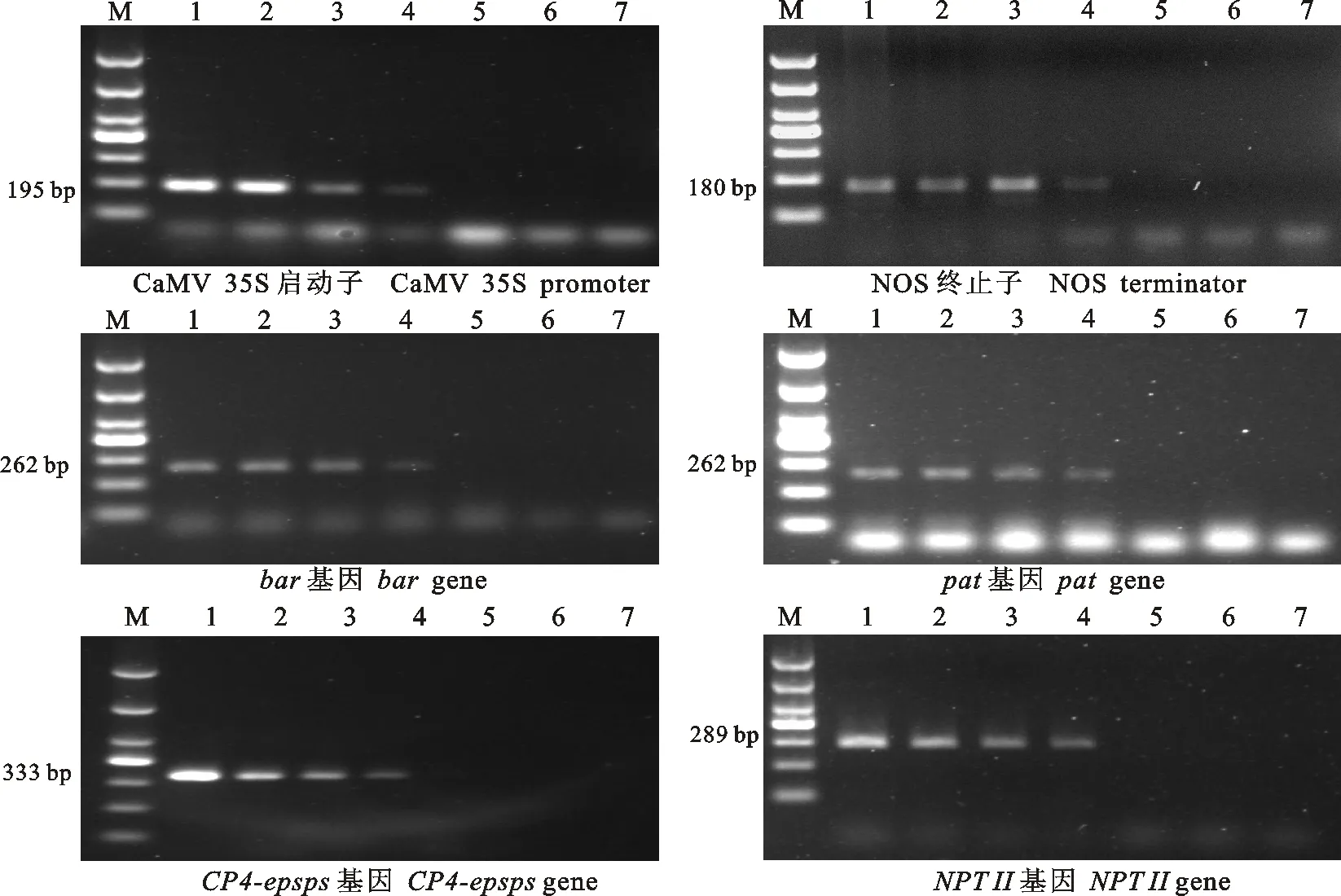
M.DNA marker DL1000;1~7.转基因粉末的质量分数分别为1 000、100、10、1、0.1、0 g/kg和空白对照 GM mass fraction,1 000 g/kg,100 g/kg,10 g/kg,1 g/kg,0.1 g/kg,0 g/kg and no DNA control,respectively
图2转基因油菜PCR筛查法的灵敏度检测
Fig.2SensitivitytestofPCRscreeningmethodinGMrapeseed
3 讨 论
农业转基因生物的安全监管是保障转基因产业健康、有序发展的重要举措。中国政府高度重视转基因生物的安全监管,于2001年颁布《农业转基因生物安全管理条例》,并随后发布一系列配套管理办法,对农业转基因生物的研究、生产、加工、经营和进出口活动进行全过程的严格监管[8]。中国尚未批准转基因油菜的种植,仅有7个转基因油菜转化事件批准进口作为加工原料。因此转基因油菜安全监管的重点应集中在严防进口转基因油菜的非法使用和非法繁育,这就需要对常规油菜的品种审定、种子生产、种子销售及转基因油菜的加工销售等关键环节加强监管,避免转基因油菜以非转基因身份扩散。实现这些环节的重点监管,就需要快速、准确、科学的转基因成分筛查检测方法作为技术支撑[9]。
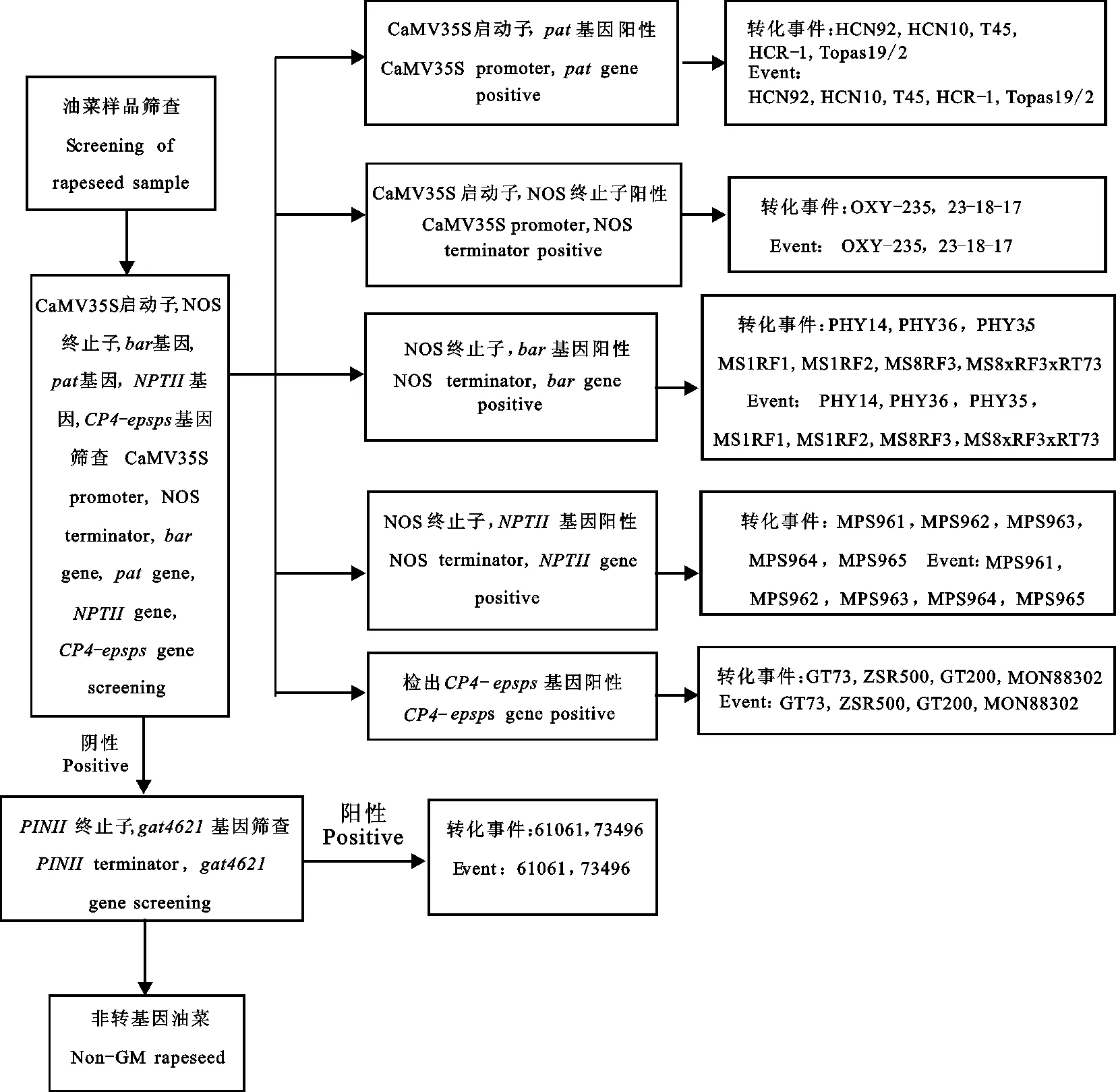
图3 转基因油菜筛查策略Fig.3 Screening strategy of GM rapeseed
本研究制定转基因成分筛查方法主要基于以下几点考虑:(1) 效率与成本兼顾,以经济、高效的方法尽可能筛查出所有已知转化事件;(2)特异性强,灵敏度高;(3)尽可能选择已发布的相关行业标准作为检测方法。因此,最终选择CaMV35S启动子、NOS终止子、bar基因、pat基因、 CP4-epsps基因和NPTII基因 6个筛查元件的组合。该组合理论上可完成对22个转基因油菜转化事件的筛查检测,占已知商业化转基因油菜转化事件的92%。然而,由于商业化转基因油菜的技术专利多属于孟山都、拜尔等国外公司,国内转基因油菜的材料很难获得。受条件所限,农业部农作物种子质量监督检验测试中心(西安)仅保存9个转基因油菜转化事件,因此仅利用这9个转化事件验证检测方法;另外13个转化事件由于缺乏材料无法验证。
本试验结果表明,利用CaMV35S启动子、NOS终止子、bar基因、pat基因、 CP4-epsps基因和NPTII基因6个筛查元件,在特异性筛查出9个转化事件的同时,检测的灵敏度可达到1 g/kg,与所报道筛查方法的检测灵敏度相近[9-10,18-19]。说明该方法具有较高的特异性和灵敏度,适用于高通量地筛查油菜中的转基因成分,为转基因油菜的全面、有效监管提供有力的技术支撑,对于保障中国农业转基因生物安全、推动农业转基因产业的健康、有序发展具有十分重要的意义。
Reference:
[1] 刘 晓,景 寅.转基因油菜研究进展[J].现代农业科技,2010(9):80-81.
LIU X,JING Y.Advance of studies on transgenicBrassicanapus[J].ModernAgriculturalScienceandTechnology,2010(9):80-81.
[2] JAMES C.2014年全球生物技术/转基因作物商业化发展态势[J].中国生物工程杂志,2015,35(1):1-14.
JAMES C.Global status of commercialized biotech/gm crops:2014[J].ChinaBiotechnology,2015,35(1):1-14.
[3] 卢长明,陈桂敏,瞿 勇.世界转基因油菜田间试验频次分析[J].中国油料作物学报,2013,35(增刊):25-30.
LU CH M,CHEN G M,QU Y.Global frequency analysis of field trials of genetic modified crops [J].ChineseJournalofOilCropScience,2013,35(supplement):25-30.
[4] Center for Environmental Risk Assessment.GM Crop Database [DB/OL].Washington D C:The International Life Sciences Institute(ILSI),2009[2017-3-1].http:∥cera-gmc.org.
[5] EU GMO Compass.GMO Database[DB/OL].Gembloux:EU GMO Compass,2008 [2017-3-1].http:∥www.gmo-compass.org.
[6] 上海交通大学转基因实验室.转基因检测方法数据库[DB/OL].上海:上海交通大学,2008 [2016-5-30].http∥gmdd.shgmo.org.
GMO Detection Laboratory in Shanghai Jiao Tong University,GMO Detection Method Database(GMDD))[DB/OL].Shanghai:Shanghai Jiao Tong University,2008 [2016-5-30].http∥gmdd.shgmo.org.
[7] 中华人民共和国农业部.进口用作加工原料的农业转基因生物审批情况[EB/OL].北京:农业部,2016 [2017-3-1].http:∥www.moa.gov.cn /ztzl/zjyqwgz/spxx/.
Ministry of Agriculture of PRC.The approval of imported genetically modified organisms as raw materials for processing [EB/OL].Beijing:Ministry of Agriculture of PRC,2016 [2017-3-1].http:∥www.moa.gov.cn /ztzl/zjyqwgz/spxx/.
[8] 李飞武,徐世艳,宋贵文,等.浅谈我国转基因作物安全监控需求与策略[J].农业科技管理,2010,29(2):27-29.
LI F W,XU SH Y,SONG G W,etal.Preliminary discussions on the requirements and strategies for the safety monitoring of genetically modified crops [J].ManagementofAgriculturalScienceandTechnology,2010,29(2):27-29.
[9] 张海波,张 英,刘 冰,等.玉米中转基因成分筛查策略[J].西北农业学报,2015,24(12):57-63.
ZHANG H B,ZHANG Y,LIU B,etal.Strategy of genetically modified maize screening based on qualitative PCR method[J].ActaAgriculturaeBoreali-occidentalisSinica,2015,24(12):57-63.
[10] 张 丽,武玉花,吴 刚,等.转基因油菜筛查检测策略研究[J].中国油料作物学报,2012,34(1):74-81.
ZHANG L,WU Y H,WU G,etal.Strategy of transgenic rapeseed screening based on exogenous gene elements [J].ChineseJournalofOilCropScience,2012,34(1):74-81.
[11] 李 想,潘良文,李俊毅,等.进口油菜籽中不同转基因品系的检测与分析[J].中国油料作物学报,2011,33(1):77-82.
LI X,PAN L W,LI J Y,etal.Identification of imported genetically modified rapeseeds [J].ChineseJournalofOilCropScience,2011,33(1):77-82.
[12] 李俊毅.转基因油菜品系特异性检测方法研究及其标准分子研制[D].上海:华东理工大学,2010.
LI J Y.Research on event-specific analysis of genetically modified rapeseed detection and development of reference molecules[D].Shanghai:East China University of Science and Technology,2010.
[13] 聂淑晶.转基因油菜转化事件特异性检测技术[D].武汉:中国农业科学院油料作物研究所,2008.
NIE SH J.Event specific detection of transgenic rapeseed[D].Wuhan:Oilcrops Research Institute,Chinese Academy of Agricultural Sciences,2008.
[14] 谢家建,沈 平,彭于发,等.农业部1782号公告-3-2012 转基因植物及其产品成分检测-调控元件CaMV 35S启动子、FMV 35S启动子、NOS启动子、NOS终止子和CaMV 35S终止子定性PCR方法[S].北京:中国农业出版社,2012:1-13.
XIE J J,SHEN P,PENG Y F,etal.Announcement by the Ministry of Agriculture,No.1782-3-2012 detection of genetically modified plants and derived products - qualitative PCR methods for the regulatory elements CaMV 35S promoter,FMV 35S promoter,NOS promoter,NOS terminator and CaMV 35S terminator[S].Beijing:China Agriculture Press,2012:1-13.
[15] 路兴波,宋贵文,李 凡,等.农业部1782号公告-6-2012 转基因植物及其产品成分检测bar或pat基因定性PCR方法[S].北京:中国农业出版社,2012:1-5.
LU X B,SONG G W,LI F,etal.Announcement by the Ministry of Agriculture,No.1782-6-2012 detection of genetically modified plants and derived products - qualitative PCR method ofbarorpatgene[S].Beijing:China Agriculture Press,2012:1-5.
[16] 杨立桃,厉建萌,刘 勇,等.农业部1861号公告-5-2012 转基因植物及其产品成分检测 CP4-epsps基因定性PCR方法[S].北京:中国农业出版社,2012:1-5.
YANG L T,LI J M,LIU Y,etal.Announcement by the Ministry of Agriculture,No.1861-5-2012 Detection of genetically modified plants and derived products - qualitative PCR method for CP4-epsps gene[S].Beijing:China Agriculture Press,2012:1-5.
[17] 卢长明,宋贵文,吴 刚,等.农业部1782号公告-2-2012 转基因植物及其产品成分检测标记基因NPTII、HPT和PMI定性PCR方法[S].北京:中国农业出版社,2012:1-9.
LU CH M,SONG G W,WU G,etal.Announcement by the Ministry of Agriculture,No.1782-2-2012 detection of genetically modified plants and derived products-qualitative PCR method for the maker genesNPTII,HPTandPMI[S].Beijing:China Agriculture Press,2012:1-9.
[18] WU Y H,WANG Y L,LI J,etal.Development of a general method for detection and quantification of the P35S promoter based on assessment of existing methods[J].ScientificReports,2014(4):7358.
[19] 李风翠.转基因饲料中bar基因检测方法的研究 [D].南京:南京农业大学,2011.
LI F C.Determination ofbargene in animal forage[D].Nanjing:Nanjing Agricultural University,2011.
