牛樟芝倍半萜合酶基因克隆及在不同培养基中的表达
2018-01-30陈中华原晓龙杨宇明
赵 能, 陈中华, 原晓龙, 王 娟, 杨宇明, 王 毅*
(1.云南省林业科学院 云南省森林植物培育与开发利用重点实验室,云南 昆明 650204;2.云南省林业科学院 国家林业局云南珍稀濒特森林植物保护和繁育重点实验室,云南 昆明 650204;3.西南林业大学,云南 昆明 650224)
牛樟芝(Antrodiacamphorata)又名樟芝、牛樟菇、樟生薄孔菌,是原产于台湾的担子菌亚门、层菌纲、非褶菌目、多孔菌科、薄孔菌属的珍稀药用真菌[1]。牛樟芝主要生长在台湾特有植物牛樟树(Cinnamomumkanehirai)的树干空洞内[2]。在台湾地区,牛樟芝一直作为一种药物被广泛用于治疗高血压、皮肤瘙痒等疾病,甚至还可用于改善肝功,增强脾胃免疫力[3]。近年来还发现,牛樟芝的提取物具有良好的抗癌、抗氧化、抗炎等活性[4]。经过分离提取鉴定后,研究人员最终确定牛樟芝所具有的种种活性主要来源于其内含有的倍半萜、三萜以及甾醇类化合物[5]。之后,牛樟芝内的萜类化合物研究陆续得到报道[6-8]。早在1995年,研究人员就从牛樟芝中分离鉴定出了倍半萜内酯[9],但是之后对于牛樟芝内的倍半萜化合物研究报道较少。直到2013年,Yeh等人发现从牛樟芝中分离出的一种名为antrocin的倍半萜物质能够使得肺癌细胞凋亡[10],牛樟芝中的倍半萜化合物再次吸引研究人员。倍半萜类化合物是指由3分子异戊二烯单位聚合而成,分子中含有15个碳原子的天然萜类化合物群,其广泛存在于植物界和微生物界[11]。在生物体内,许多倍半萜类化合物通常起防御与介导作用[12],除此之外,倍半萜类化合物具有抗肿瘤、抗菌消炎、抗神经毒性、抗虫活性、昆虫拒食、抗病毒、保肝强心等生物活性[11]。所有萜类化合物都是由五碳单元的异戊二烯二磷酸酯及其衍生物二甲基烯丙基二磷通过异戊烯转移酶连接形成的,而倍半萜最终是由法尼基焦磷酸途径(farnesyl diphosphate, FPP)中的倍半萜合酶所合成[13]。倍半萜合酶基因以基因家族的形式存在,家族中不同成员基因表达催化生成不同的倍半萜终产物[14]。在倍半萜生物合成研究上,最具代表性的是青蒿素的生物合成,青蒿素是由乙酰CoA经甲羟戊酸(mevalonic acid,MVA)途径合成FPP,经紫穗槐-4,1l-二烯合酶(ADS)催化生成紫穗槐-4,1l-二烯,在紫穗槐-4,11-二烯P450羟基化酶(CYP7lAVl)催化下生成青蒿酸,再经过其他催化反应最后生成青蒿素。由于青蒿素的生物合成途径得到较为全面的揭示,使用工程菌发酵获得青蒿素的办法已经基本实现[15-16]。牛樟芝内的倍半萜类化合物虽然有良好活性,但是对牛樟芝倍半萜的生物合成未见报道,与青蒿素倍半萜的生物合成相同,如果研究得到牛樟芝某种倍半萜类化合物的生物合成途径,那么使用工程菌发酵同样也能够获得相应的倍半萜类化合物。本文对牛樟芝已经公布的基因组数据进行分析,结合已有文献基础,推测出与牛樟芝倍半萜合成相关的功能基因片段,并克隆获得全长cDNA,检测不同培养基对牛樟芝倍半萜合成酶的表达状况,最终为揭示牛樟芝倍半萜生物合成奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种来源 牛樟芝菌丝体由昆明食用菌研究所提供,该牛樟芝菌丝体生长于Malt extract培养基上。
1.1.2 不同碳氮源以及市售培养基的配制 根据之前研究结果[17],筛选出15种适合于牛樟芝快速生长的培养基。配方见表1。
1.1.3 试剂及仪器 试验所用试剂为Ultrapure RNA Kit,TAKARA PrimeScriptTMRT reagent kit with gDNA Eraser试剂盒,Reverse Transcriptase M-MLV试剂盒,等。所用仪器为BIO RAD C1 000 PCR仪,霉菌培养箱(上海培因实验仪器有限公司)等。

表1 培养基配方及编号

续表1
1.2 方法
1.2.1 牛樟芝菌丝体培养 将牛樟芝菌丝体(1 mm)接种于配制好的不同配方培养基平板中央,24 ℃暗培养。
1.2.2 总RNA提取 收获在Glu培养基24 ℃暗培养2个月的牛樟芝菌丝,使用Ultrapure RNA Kit(康为世纪)提取其总RNA。并用Nanodrop 2 000 (Thermo USA) 进行浓度及纯度检测后,再用1%琼脂糖凝胶电泳检测所提总RNA的完整性。采用TAKARA PrimeScriptTMRT reagent kit with gDNA Eraser试剂盒对所提总RNA进行反转录,合成 cDNA第一链。
1.2.3 cDNA全长克隆 依据DNA序列设计牛樟芝倍半萜合酶基因特异引物AcTPS1F和AcTPS1R(表2),以1.2.2反转录获得的cDNA为模板,用设计得到的特异引物扩增AcTPS1基因。反应条件为95 ℃ 3 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 2 min,30个循环;72 ℃延伸5 min。扩增结束后,对扩增产物进行纯化处理,再将纯化产物连接到pEASY-T1载体中。最后测序验证插入的cDNA全长。
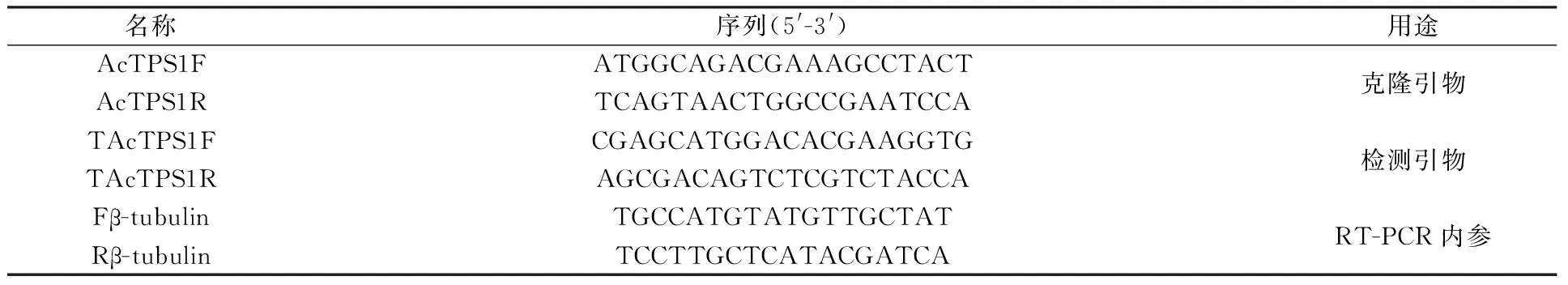
表2 研究所用引物
1.2.4 牛樟芝倍半萜合酶AcTPS1基因表达的半定量测定 计以ACTPS1基因序列为模板的检测引物TAcTPS1F和TAcTPS1R(表2)。将表1中的15种不同配方培养基培养两个月后的牛樟芝菌丝体收获立即放入液氮中,经液氮研磨后,分别提取各培养基培养的牛樟芝菌丝体总RNA并用琼脂糖凝胶电泳检测RNA质量。分别取15种培养基培养的牛樟芝菌丝体RNA各1 μg,参照Reverse Transcriptase M-MLV试剂盒说明书合成cDNA。然后各自取1μL cDNA用于半定量PCR检测。半定量PCR反应体系:引物TAcTPS1F和TAcTPS1R各1 μL,PCR master Mix:10 μL, cDNA:1 μL, distilled water:7 μL,并以β-tubulin为内参,参照张文娟等[18]的方法,利用GENESNAPS图像分析软件测定凝胶成像系统中获得的条带的积分光密度,用积分光密度的相对定量绘制表达柱状图。
1.2.5 AcTPS1基因cDNA序列及其编码蛋白氨基酸序列生物信息学分析 用NCBI的Blast在线工具以及本地软件DNAMAN对AcTPS1以及4种真菌的倍半萜合酶基因进行氨基酸同源序列比对。MEGA软件的邻位相连算法(1 000次检举)绘制系统进化树。亚细胞定位由TargetP完成,并用ExPASy 站点工具Protparam与在线软件ProtScale分析蛋白理化特性以及亲水性/疏水性,最后用Tmpred软件分析AcTPS1蛋白序列的跨膜结构域。
2 结果与分析
2.1 全长cDNA克隆与序列分析
经过反转录PCR后,克隆并获得完整的牛樟芝cDNA序列,经测序后可知全长为969 bp,编码323个氨基酸, GenBank登录号为KY056179。将牛樟芝DNA进行克隆,并测序,可知牛樟芝DNA序列全长为1 153 bp。将克隆得到的牛樟芝菌丝体cDNA与DNA序列进行比对,发现DNA中含有3个内含子,在DNA序列上的位置从起始密码子算起分别是50~111 bp,714~770 bp以及801~866 bp处。图1为克隆得到的cDNA与DNA电泳图。
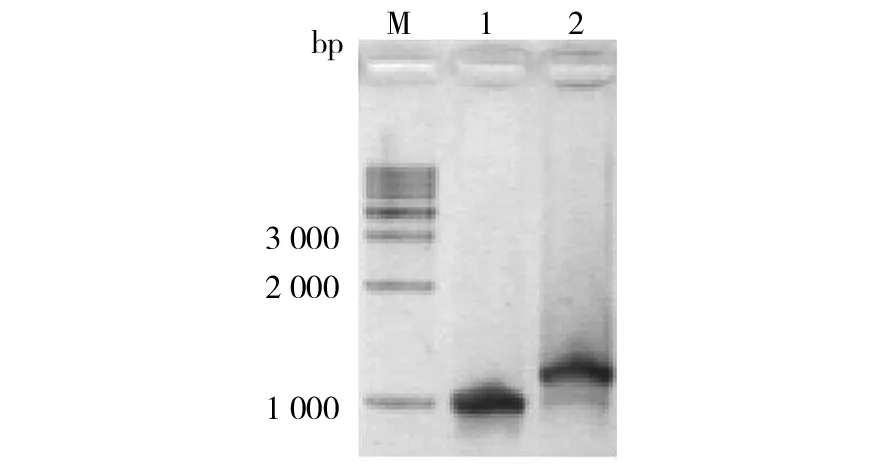
图1 牛樟芝菌丝体cDNA与DNA克隆Fig.1 Cloning of cDNA and DNA from Mycelia Antrodia camphorataM:Takara 1K DNA marker;1:克隆所得cDNA;2:克隆所得DNAM: Takara 1K DNA marker; 1: The cloned of cDNA; 2: The cloned of DNA
2.2 不同培养基对菌丝体内AcTPS1基因表达量影响
将1 μg RNA反转录获得的cDNA各取1 μL并用β-tubulin为内参,用AcTPS1基因特异引物检测倍半萜合酶基因在不同培养基中的表达情况。结果如图2、3所示。
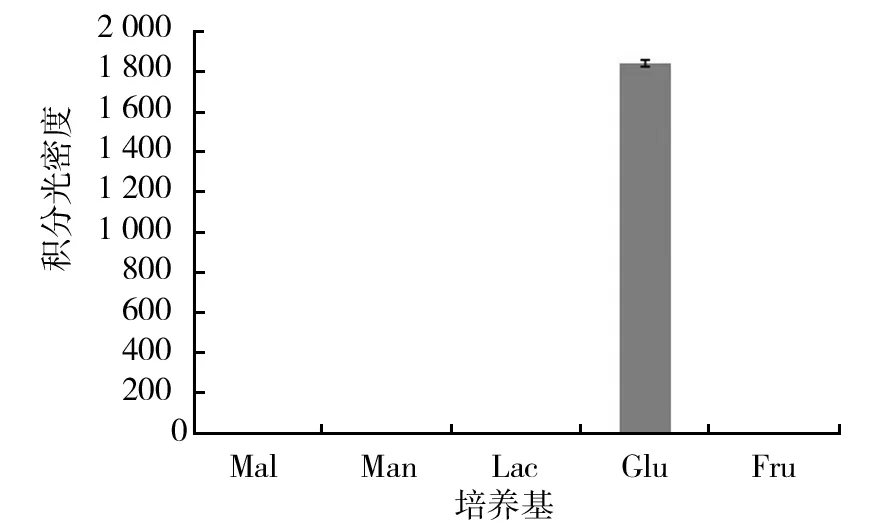
图2 不同碳源牛樟芝倍半萜合酶基因表达Fig.2 Gene expression of Antrodia camphorata cultured in different carbon sources
由于4种市售培养基中没有该基因表达,因此,4种市售培养基的表达没有放在图中。由图2、3可以看出,使用不同碳源培养牛樟芝菌丝体时,只有葡萄糖作为碳源时该基因表达,而在剩余4种碳源中并没有检测到表达。在使用不同氮源时,以番茄浸粉和酪蛋白胨为氮源时,该基因表达,剩余4种氮源中均没有该基因表达。结合图2与图3来看,表达量最高的是以葡萄糖为碳源的培养基。
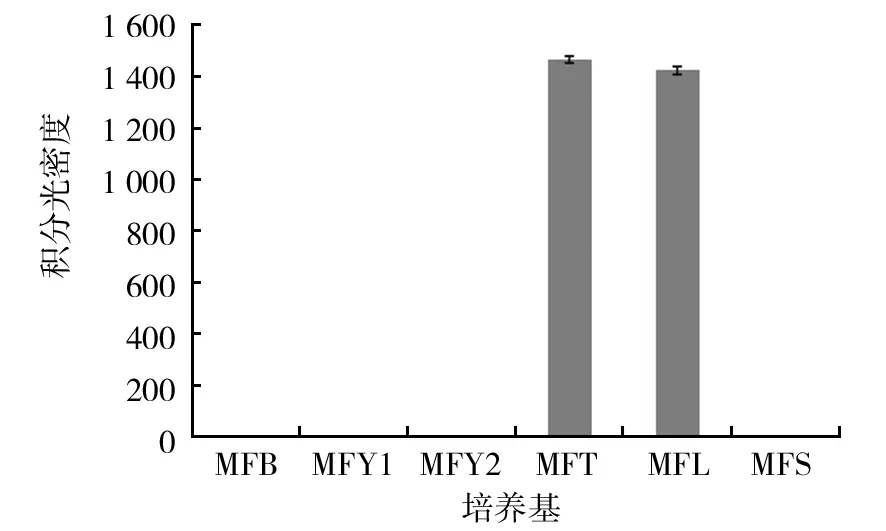
图3 不同氮源倍半萜合酶基因表达Fig.3 Gene expression of Antrodia camphorata cultured in different nitrogen sources
2.3 牛樟芝倍半萜合酶AcTPS1氨基酸序列分析
AcTPS1基因氨基酸序列经过在线软件Protparam分析后可知该氨基酸序列由323个氨基酸残基组成,氨基酸组成种类为20种。其分子量为35 842.8 D,理论等电点5.29,摩尔消光系数1.308,蛋白质不稳定指数38.35。利用亚细胞定位软件推测AcTPS1位于细胞质中。经ProtScale分析后,推测该氨基酸序列有一定疏水性。将AcTPS1氨基酸序列用NCBI在线工具推测出其保守结构域,结果如图4所示,由图4中的信息可以看出AcTPS1具有真菌萜类合成酶的保守序列。再将AcTPS1氨基酸保守序列与其他4种真菌倍半萜合酶氨基酸序列进行比对分析,还发现了AcTPS1具有倍半萜合成酶的保守结构域RRx8W,在图5中已用虚线框标出。
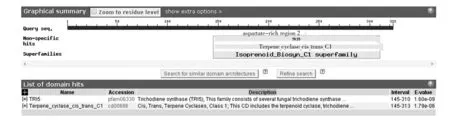
图4 AcTPS1保守序列推断Fig.4 The Putative conserved domains of AcTPS1

图5 AcTPS1与4种真菌倍半萜合酶序列比对Fig.5 Sesquiterpene synthase amino acid sequence alignmentFRTP:Fibroporia radiculosa(XP_012177824);GSTP:Gelatoporia subvermispora(EMD36641);LSTP:Laetiporus sulphureus(KZT00027);DQTP:Daedalea quercina(KZT73360);*代表相同序列 FRTP:Fibroporia radiculosa(XP_012177824);GSTP:Gelatoporia subvermispora(EMD36641);LSTP:Laetiporus sulphureus(KZT00027);DQTP:Daedalea quercina(KZT73360);*indicates the same sequence
2.4 牛樟芝倍半萜合酶AcTPS1系统进化树分析
从NCBI数据库中选取真菌类的倍半萜合酶基因、单萜合酶基因以及双萜合酶基因与AcTPS1基因进行序列比对并绘制系统进化树。从系统进化树(图6)上可以看出,AcTPS1基因与8种真菌的倍半萜合酶聚为一类,因此可以进一步确定克隆出的AcTPS1基因正确。
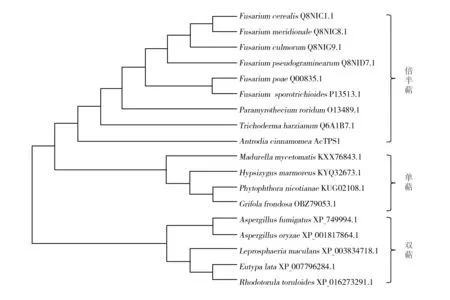
图6 AcTPS1与不同种真菌萜类合酶系统进化树Fig.6 The phylogenetic tree of different fungi′s terpene synthase
3 讨 论
本研究以牛樟芝基因组为基础[19],从中分析推断出与其倍半萜合成相关的功能基因。根据系统进化树聚类,可以看到克隆得到的AcTPS1基因与不同种真菌的倍半萜合酶基因聚为一类,由此初步推断该基因为倍半萜合酶基因。由于真菌类的倍半萜功能基因研究较少,从系统进化树中难以得到与牛樟芝倍半萜合成基因亲缘关系较近的真菌。采用不同培养基培养牛樟菌丝体,研究该倍半萜合酶基因在不同培养基中的表达发现,不同培养基对该基因的表达影响差别很大,当氮源一致碳源不相同时,只有以葡萄糖作为碳源时该基因表达,其余4种均没有表达,而碳源一致氮源不同时,只有两种培养基使该基因表达。因此,想要大量获得与该基因相关的倍半萜化合物,选择以麦芽浸粉,酵母提取物为氮源,葡萄糖为碳源对牛樟芝菌丝体进行大量液体培养会获得较好效果。
不同培养基中倍半萜合酶基因表达量不同,恰恰解释了培养真菌时的单菌多产物策略(OSMAC)为何在改变培养基时会得到不同化合物[20],由于培养基成分不同,刺激了微生物的不同基因的表达,从而使得同种微生物在不同培养基中产生不同化合物[21]。同时,这一结果的发现也为牛樟芝发酵培养提供了一种新思路,在以往的发酵培养中,研究人员大多只注意到不同培养基对三萜总含量以及生物活性的影响[22-24],然而利用生物信息学分析与分子生物学技术快速定位出功能基因并检测其表达情况,能够在较短时间内从根本上找到最适宜某种化合物产生的培养条件,从而有目的地大量培养牛樟芝以得到目标化合物。
以往,对萜类化合物的研究主要是以植物为主[11],在研究植物中的倍半萜类物质时,需要采集大量的植物材料进行分离提取,但是微生物不同,可以通过液体发酵等培养方式进行培养,最后再分离得到倍半萜类化合物进行研究,相较于采集大量植物材料用于提取分离后者更为环保且快速[25]。随着分子生物学的发展,真菌中的萜类化合物也逐渐得到重视。真菌能够产生大量的活性物质,萜类化合物只是其中的一类[26],与植物相比,真菌能够产生一些特殊的倍半萜类化合物[27],这就使得真菌倍半萜类化合物更具研究价值。Yeh等人在2013年发现从牛樟芝中分离出的倍半萜类化合物具有抗癌活性这一发现证明牛樟芝内的倍半萜类化合物具有极大开发潜力[10],虽然牛樟芝倍半萜类化合物具有开发潜力,但牛樟芝生长极为缓慢,通过原始菌发酵获得的提取物产量较低[28],在培养技术上也有困难,比如生长缓慢、化合物分离难度大、生产和修饰改造受到限制等等一系列问题[29]。如果对牛樟芝内倍半萜化合物生物合成途径清楚,就能够利用基因工程手段获得倍半萜等活性化合物。并且由于微生物体内天然产物的合成、调控和抗性基因通常是成簇排列的,只要在合适的宿主内异源表达基因簇就能够获得大量天然产物及其衍生物[30]。因此,获得潜在活性化合物生物合成基因是进行基因工程手段获得活性化合物的第一步。本研究成功地从牛樟芝克隆获得一个诱导型倍半萜合酶基因,并确定其大量表达的条件,为发酵获得牛樟芝倍半萜奠定理论基础,同时,也为未来利用基因工程手段获得牛樟芝倍半萜奠定基础。
[1] 胡鸥,张君逸,卢喜.樟芝及其研究开发概况[J].福建热作科技,2006,31(4):40-42.
[2] Geethangili M, Tzeng Y M. Review of pharmacological effects ofAntrodiacamphorataand its bioactive compounds[J]. Evidence-based complementary and alternative medicine, 2011, 1-17.
[3] Lee Y P,Tsai W C,Ko C J,et al.Anticancer effects of eleven triterpenoids derived fromAntrodiacamphorata.[J]. Anticancer Research, 2012, 32(7):727-734.
[4] Peng, Chiung-Chi, Chen, et al. Human urinary bladder cancer T24 cells are susceptible to theAntrodiacamphorataextracts[J].Cancer Letters, 2006, 243(1):109-119.
[5] Huang N K, Cheng J J, Lai W L, et al. Antrodia camphorata, prevents rat pheochromocytoma cells from serum deprivation-induced apoptosis[J]. Fems Microbiology Letters, 2005,244(1):213-219.
[6] Du Y C, Wu T Y, Chang F R, et al. Chemical profiling of the cytotoxic triterpenoid-concentrating fraction and characterization of ergostane stereo-isomer ingredients fromAntrodiacamphorata[J]. Journal of Pharmaceutical & Biomedical Analysis, 2012, 58(1):182-192.
[7] Huang C C, Hsu M C, Huang W C, et al. Triterpenoid-Rich Extract fromAntrodiacamphorataImproves Physical Fatigue and Exercise Performance in Mice[J]. Evidence-based Complementary and Alternative Medicine, 2012, 2012(12): 741-749.
[8] Lin T Y, Chen C Y, Chien S C, et al. Metabolite Profiles forAntrodiacinnamomeaFruiting Bodies Harvested at Different Culture Ages and from Different Wood Substrates[J]. Journal of Agricultural & Food Chemistry, 2011, 59(14):626-635.
[9] Lu M K, Cheng J J, Lai W L, et al. Adenosine as an active component ofAntrodiacinnamomea, that prevents rat PC12 cells from serum deprivation-induced apoptosis through the activation of adenosine A 2A, receptors[J]. Life Sciences, 2006, 79(3):252-258.
[10] Yeh C T, Huang W C, Rao Y K, et al. A sesquiterpene lactone antrocin fromAntrodiacamphoratanegatively modulates JAK2/STAT3 signaling via microRNA let-7c and induces apoptosis in lung cancer cells[J]. Carcinogenesis, 2013, 34(12):2918-2928.
[11] 朴英花,朴惠顺.倍半萜类化合物生物活性研究进展[J].职业与健康,2012,28(18):2291-2293.
[12] Mercke P, Crock J, Croteau R, et al. Cloning, expression, and characterization of epi-cedrol synthase, a sesquiterpene cyclase fromArtemisiaannuaL[J]. Archives of biochemistry and biophysics, 1999, 369(2): 213-222.
[13] Wawrzyn G T, Bloch S E, Schmidt-Dannert C. Discovery and Characterization of Terpenoid Biosynthetic Pathways of Fungi[J]. Methods in enzymology, 2012, 515(3): 83-105.
[14] Dhingra V, Rao K V, Narasu M L. Current status of artemisinin and its derivatives as antimalarial drugs[J]. Life sciences, 1999, 66(4): 279-300.
[15] 高允允,王秋艳,黄黎锋,等.萜类微生物生物合成研究进展[J].杭州师范大学学报:自然科学版,2012,11(4):374-379.
[16] 申海燕,李振秋,王红,等.青蒿倍半萜合酶(环化酶)研究进展[J].生物工程学报,2007,23(6):976-981.
[17] 赵能,原晓龙,陈剑,等.不同碳氮源对牛樟芝菌丝体生长的影响[J].西部林业科学,2016,45(4):7-12.
[18] 张文娟,刘薇,魏锋,等.聚合酶链式反应-限制性片段长度多态性法用于检定川贝母掺伪情况的研究[J].药物分析杂志,2014,34(10):1830-1835.
[19] Lu M Y, Fan W L, Wang W F, et al. Genomic and transcriptomic analyses of the medicinal fungusAntrodiacinnamomeafor its metabolite biosynthesis and sexual development.[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(44):4743-4752.
[20] Hewage R T, Aree T, Mahidol C, et al. One strain-many compounds (OSMAC) method for production of polyketides, azaphilones, and an isochromanone using the endophytic fungusDothideomycetesp[J]. Phytochemistry, 2014, 108(1): 87-94.
[21] 卢轩,陈刚,裴月湖.单菌多产物策略及其在药物先导化合物研发中的应用[J].沈阳药科大学学报, 2011,(8):640-645.
[22] 刘华,贾薇,刘艳芳,等.珍稀药用真菌-樟芝深层发酵培养条件的优化[J].微生物学通报,2007,34(1):70-74.
[23] Chang C Y, Lee C L, Pan T M. Statistical optimization of medium components for the production ofAntrodiacinnamomeaAC0623 in submerged cultures[J]. Applied Microbiology & Biotechnology, 2006, 72(4):654-661.
[24] Chen Q, Zhao Z, Xie H, et al. Pharmacological Actions ofAntrodiacinnamomeaand Its Cultivation Modes[J]. Medicinal Plant, 2014(9):1-3.
[25] 王谦,胡卫静.大型食药用真菌深层发酵研究进展[J].食品安全质量检测学报,2016,(3):1240-1246.
[26] Spiteller P. Chemical Defence Strategies of Higher Fungi[J]. Chemistry, 2008, 14(30):9100-9110.
[27] Agger S, Lopez-Gallego F, Schmidt-Dannert C. Diversity of sesquiterpene synthases in the basidiomyceteCoprinuscinereus[J]. Molecular Microbiology, 2009, 72(5):1181-1195.
[28] Zhong J J, Tang Y J. Submerged Cultivation of Medicinal Mushrooms for Production of Valuable Bioactive Metabolites[J]. Advances in Biochemical Engineering/biotechnology, 2004, 87(3):25-59.
[29] 黄颖,赵晨,关雄,等.微生物源化合物合成基因簇异源表达研究进展[J].中国粮油学报,2015,30(9):133-138.
[30] Fortman J L, Sherman D H. Utilizing the Power of Microbial Genetics to Bridge the Gap Between the Promise and the Application of Marine Natural Products[J]. Chembiochem, 2005, 6(6):960-978.