淹水胁迫对湖北海棠生长和生理特性的影响
2018-01-30范俊俊张往祥
刘 雪 ,彭 冶,范俊俊 ,张往祥 ,李 鑫 ,邹 旭
(1. 南方现代林业协同创新中心,江苏 南京 210037;2. 南京林业大学a.生物与环境学院;b.林学院,江苏 南京 210037)
湖北海棠Malus hupehensis (Pamp.) Rehd.又名野海棠、茶海棠,隶属于蔷薇科Rosaceae 苹果属Malus,广泛分布于我国黄河流域以南大部分省区,由于其生长健壮、具有无融合生殖特性、种子易繁殖且不带病毒等优良性状,常被作为苹果属的优良砧木,是一种十分重要的苹果种质资源[1],湖北海棠还是一种传统的药食两用植物,不仅含有有大量的蛋白质和茶多酚,还含有丰富的黄酮类物质、根皮苷及多种微量元素[2],具有抗氧化、降低血糖和保肝等药理活性,在饮料、药品和保健食品的开发利用方面具有广阔的应用前景。目前,针对湖北海棠的研究多集中在其黄酮类物质、多酚、根皮苷的提取工艺方面[1-5],而有关耐涝性的研究却鲜有报道。
受全球气候变暖的影响[6-7],我国洪涝灾害频发,这给我国农林业以及环境造成了巨大的经济损失[8-9]。因此,在洪涝多发地区(如沿江、沿海等)培育耐受洪涝灾害的观赏树种,对其景观的营造和恢复具有重要意义。
湖北海棠树姿优美,花色艳丽,是我国南方地区园林绿化的传统树种。本试验通过人工模拟淹水胁迫,对淹水胁迫下湖北海棠幼苗形态、生长和叶片生理生化指标进行了研究。探讨湖北海棠的抗涝性机制和适应机制,以期为今后培育出观赏价值高且抗逆境能力强的湖北海棠提供理论依据,也为湖北海棠在洪涝多发地区的推广应用提供理论依据。
1 材料与方法
1.1 试材及取样
试验材料为3年生湖北海棠实生苗。试验在江苏省扬州市江都区仙女镇(119°55′E,32°42′N)实验基地展开。试验共设淹水和对照2种处理:对照为田间持水量的75%,淹水为水面高于土壤表面5cm。每个处理选取长势和大小基本一致苗木100株。每个处理单元种植面积为8m2(长8 m、宽1 m) ,土壤厚度30 cm。每个处理单元在底部和侧面分别铺 2层塑料膜,分别在土层表面下的30、0 cm 和高出土层5cm处设有排水孔。2015年11月15日种植湖北海棠幼苗,2017年4月6日开始淹水处理,5月25日结束淹水。淹水期间,每天观察土壤水面变化,进行水分排灌。分别在淹水处理后的7、14、21、35、49 d的13:00采集湖北海棠叶片,样品采集后立即采用干冰速冻,当天放入超低温冰柜中,用于各生理指标的测定。
1.2 指标测定及方法
超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑光还原测定法[10];可溶性糖和丙二醛(MDA)含量的测定参考孔祥生的方法[11];叶绿素和类胡萝卜素含量的测定采用 95%乙醇浸提法[12]。
1.3 数据统计分析
采用 Excel 2013、Word2003 和SPSS 22. 0对数据进行处理和统计分析,用 Duncan 法进行差异显著性检验。所有数据采用平均值 ± 标准差。
2 结果与分析
2.1 淹水胁迫对湖北海棠形态的影响
2.1.1 叶色的变化
湖北海棠的叶色伴随淹水过程发生了显著变化,见图1。由图1可知,淹水0~21 d,湖北海棠叶片颜色逐渐由绿色变为紫红色。其中,在21 d时叶片呈深紫红色。随后,其叶片颜色由紫红色向黄绿色转变,至淹水49 d叶片颜色均变为黄绿色。
2.1.2 皮孔和不定根的变化
本试验观察到淹水28 d时,湖北海棠茎基部皮孔变得肥大;淹水35 d,茎基部皮孔持续变大;淹水42 d茎基部皮孔不仅变得肥大,其数量也显著增加。在淹水49 d时,较多数量的不定根从茎基部皮孔伸出(见图2)。
2.2 淹水胁迫对湖北海棠生长的影响
2.2.1 淹水胁迫对湖北海棠存活率的影响
存活率可以最直观地反映苗木的耐水能力。本试验淹水49 d,湖北海棠苗木的存活率为100%,说明湖北海棠的耐涝能力极强。
2.2.2 淹水胁迫对湖北海棠苗高的影响

图1 淹水胁迫对湖北海棠叶片颜色的影响Fig.1 Effects of waterlogging stress on leaf color in M. hupehensis seeding

图2 淹水胁迫对湖北海棠茎部的影响Fig.2 Effects of waterlogging stress on stem in M. hupehensis seeding
淹水胁迫对湖北海棠苗高的影响情况见图3。由图3可知,在整个淹水过程中,对照和处理的湖北海棠的苗高均呈增长的趋势,对照的苗高的相对增长率为53.25%,处理组的苗高相对增长率为27.04%。此外,淹水的各个时期(0~49 d),湖北海棠苗木的苗高均高于对照,其中,0~42 d,对照与淹水间差异不显著(P>0.05);淹水49 d时,湖北海棠苗木的苗高显著低于对照(P<0.05)。这说明短期淹水(0~42 d)对湖北海棠苗木的苗高生长没有显著影响,当淹水时间达到49 d时,会显著抑制其苗高生长。

图3 淹水胁迫对湖北海棠苗高的影响Fig.3 Effects of waterlogging stress on height of M. hupehensis seeding
2.2.3 淹水胁迫对湖北海棠地径的影响
淹水胁迫对湖北海棠地径的影响情况见图4。由图4可知,在整个淹水过程中,对照和处理的湖北海棠的地径均呈增长的趋势,对照的苗高的相对增长率为88.26%,处理组的苗高相对增长率为54.86%。淹水0~35 d,地径高于对照,其中,只有在淹水至21 d时,地径显著高于对照(P<0.05)。淹水35 d后,对照组幼苗的地径显著高于处理(P<0.05)。这说明短期淹水对湖北海棠苗木的地径的增长有一定的促进作用,当淹水时间超过35 d后,会显著抑制其增长。
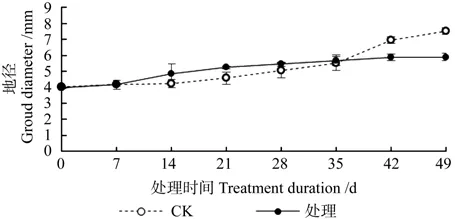
图4 淹水胁迫对湖北海棠地径的影响Fig.4 Effects of waterlogging stress on ground diameter of M.hupehensis seeding
2.3 淹水胁迫对湖北海棠可溶性糖含量的影响
可溶性糖是植物体内一种重要的渗透调节物质[13-14],植物为了适应逆境条件会主动积累一些可溶性糖以维持细胞膨压[19]。如图5,淹水胁迫下(0~49 d),湖北海棠叶片可溶性糖的含量总体呈上升趋势,且其含量均显著高于对照(P<0.01),其中,淹水42 d时,叶片可溶性糖含量达到了峰值287.47 mg·g-1,为对照的1.47倍。

图5 淹水胁迫对湖北海棠可溶性糖含量的影响Fig.5 Effects of waterlogging stress on soluble sugar content in M. hupehensis seeding
2.4 淹水胁迫对湖北海棠SOD酶活性的影响
淹水胁迫对湖北海棠SOD活性的影响情况见图6。由图6可知,在整个淹水期间,湖北海棠叶片的SOD酶活性总体呈现出先升高后下降的趋势。淹水前期(0~7 d),处理与对照间差异不显著(P>0.05),淹水7 d后,湖北海棠叶片的SOD酶活性上升,淹水21 d时SOD酶活性达到最大值1501.28 U·mg·g-1,为对照的 1.82 倍。淹水处理21 d后,SOD酶活性急剧下降,到淹水结束时,SOD酶活性降为968.51 U·mg·g-1,淹水处理14~49 d,叶片SOD酶活性均显著高于对照(P<0.05),且始终保持在一个较高的水平。
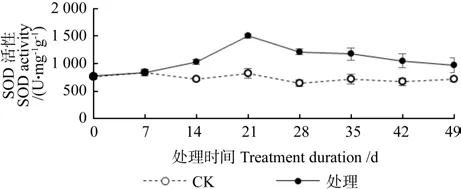
图6 淹水胁迫对湖北海棠SOD活性的影响Fig.6 Effects of waterlogging stress on SOD activity in M. hupehensis seeding
2.5 淹水胁迫对湖北海棠MDA的影响
淹水胁迫对湖北海棠MDA的影响情况见图7。由图7可知,在整个淹水期间,叶片的MDA的含量呈现出先上升后下降的趋势。其中,淹水前期(0~7 d),MDA的含量较低,与对照间差异不显著(P>0.05),淹水7~42 d,MDA的含量急剧上升,显著高于对照(P<0.05),且在淹水42 d 时达到最大值130.70 umol·g-1,为对照的2.87倍。淹水42 d后MDA含量显著下降(P<0.01),到淹水结束时,MDA含量为93.02 umol·g-1,仍显著高于对照(P<0.01)。这说明长期淹水对湖北海棠叶片细胞膜造成了一定程度的伤害。

图7 淹水胁迫对湖北海棠MDA的影响Fig.7 Effects of waterlogging stress on MDA content in M. hupehensis seeding
2.6 淹水胁迫对湖北海棠光合色素的影响
淹水胁迫对湖北海棠叶片光合色素含量的影响情况见表1。由表1可知,淹水结束时,湖北海棠叶片的叶绿素a 、叶绿素b、 叶绿素a/叶绿素b、叶绿素(a + b)、类胡萝卜素含量均显著下降。而类胡萝卜素/ 总叶绿素的比值显著升高。
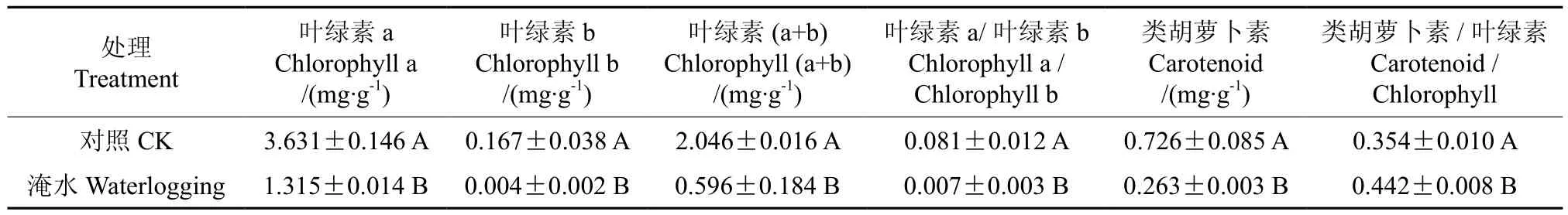
表1 淹水胁迫对湖北海棠叶片光合色素含量的影响†Table1 Effects of waterlogging stress on photosynthetic pigments contents in M. hupehensis seeding leaf
3 讨论与结论
3.1 淹水胁迫对湖北海棠形态的影响
3.1.1 淹水胁迫对湖北海棠叶色变化的影响
植物依靠叶片进行光合作用积累的有机物质来维持植株的生长。植物叶片的颜色主要由叶绿素、类胡萝卜素和花青素等决定。当叶片叶绿素的含量占的比值较大时(>60%),叶片呈现绿色;当叶片中花色素苷占的比值较大时( 60%~80%),叶片呈现红色;当叶片中叶绿素和花色素苷比例减少到一定程度时(< 60%),叶片呈现出类胡萝卜素的黄色[15]。本试验淹水期间,湖北海棠叶色变化与大多数不耐水涝植物如银杏Ginkgo biloba、黄连木Pistacia chinensis和东北山樱Cerasus sachalinensis等幼苗[16],在淹水初期就出现水渍斑,在后期叶片卷曲、枯萎等现象不同。由图1可看出,湖北海棠的叶色伴随淹水过程发生了显著变化。淹水0~21 d,湖北海棠叶片颜色逐渐由绿色变为紫红色,其中,在21 d时叶片变为深紫红色,这可能是淹水使湖北海棠叶片细胞的膜系统受到伤害,间接影响了叶绿体的功能;随后,其叶片颜色由紫红色向黄绿色转变,至淹水49 d叶片颜色均变为黄绿色,这可能是因为在此期间湖北海棠皮孔肥大、数量增多以及形成不定根,缓解了淹水对细胞膜系统造成的伤害。
3.1.2 淹水胁迫对湖北海棠皮孔和不定根变化的影响
大量研究表明,耐涝树种对淹水的形态响应是茎部形成大量的不定根和皮孔变得肥大[17-18]。
皮孔肥大而显著的现象是耐淹木本植物对淹水胁迫的重要响应之一[19-21]。皮孔肥大可能是细胞间隙增大,使细胞分散以及细胞体积增大延伸使茎基部组织的膨胀造成的[19-20],这可能与乙烯的产生有关。本试验观察到淹水28 d时,湖北海棠茎基部皮孔变得肥大;淹水35 d,茎基部皮孔持续变大;淹水42 d茎基部皮孔不仅变得肥大,其数量也显著增加。这与汪贵斌等人[21]对喜树Camptotheca acuminata在淹水胁迫下的研究结果一致,其结果表明在涝渍胁迫下,喜树的茎在水面以下部位出现许多皮孔,并随处理时间的延长皮孔不断增大、增多。此外,Phukan[17]等人报道,裸子植物如大叶南洋杉Araucaria bidwellii、落叶松属Larix laricina、红豆杉属Taxus sp、云杉属Picea sp和被子植物如中华蚊母树Distylium chinense、橡胶树Hevea brasiliensis、梨属Pyrus sp、美洲榆Ulmus americana,在淹水环境下茎部也会出现皮孔变得肥大的现象。这种结构不仅有利于O2的向下扩散,还有利于根部厌氧代谢产生的副产物如乙醇、CH4、CO2的从茎中排到大气中[19]。
不定根的形成是耐淹木本植物适应淹水环境的重要特征之一[17,19,22]。有研究表明,植物淹水胁迫后,其组织中高水平的乙烯会增加对IAA的敏感[17],一定浓度的IAA会诱导NO的暂时积累,激活了一个MAPK级联,最终导致不定根的生成[19]。如喜树在长期淹水下初生根大量死亡,不定根大量形成[21];美洲榆在淹水环境中产生两种类型的不定根,一种是密而多分枝且深入土壤,另一种是疏而无分枝并漂浮在水面[22];朴树Celtis sinensis幼苗在淹水环境下,原有根系大量发黑死亡,并在茎基部产生大量较为发达的不定根,而在原有根系粗大主根的上部也发出大量的新生根[22]。这些新生的根常常呈膨大状,其中可能存在较为发达的通气组织,从而使朴树幼苗在一定程度上适应了淹水环境。本试验淹水49 d,较多数量的不定根从湖北海棠茎基部皮孔伸出(见图2)。这与朴树、喜树、美洲榆等树种在淹水下形成不定根的情况类似。不定根细胞间的隙腔较大,它减小了氧气传输的距离,降低了O2的径向损失,从而提高了氧气扩散能力[23],也可代替受损的主根系吸收水和营养物质,这对于植物在淹水胁迫环境中的生存具有重要意义。
大量研究表明[17,23],不定根和皮孔彼此联系创造了一个气体运输体系,它使根能进行呼吸作用,水和营养物质也能向上运输到植物各器官。因此,在淹水逆境下,湖北海棠能通过形成较多数量的肥大皮孔、不定根适应逆境。
3.2 淹水胁迫对湖北海棠生长的影响
苗木的存活状况直观地反映了植物耐涝性的强弱。本试验淹水过程中,湖北海棠苗木的存活率为100%,说明湖北海棠的耐涝能力极强。
众多研究结果表明植物在淹水胁迫下,其高生长会受到抑制。如乌桕Sapium sebiferum、麻栎Quercus acutissima、美洲黒杨无性系Populus deltoides clones、黄山栾树Koelreuteria Integrifoliola、无患子Sapindus saponaria幼苗的高生长会因淹水胁迫而降低[1,22,24,25]。本试验淹水0~42 d,湖北海棠的苗高与对照间差异不显著(P>0.05),淹水49 d时,湖北海棠的苗高显著低于对照(P >0.05)。说明短期淹水对湖北海棠的苗高没有影响,淹水时间过长会显著抑制其苗高生长。曹福亮等人[26]认为,淹水造成苗高生长降低的直接原因是阻碍了节间的生长,间接原因是阻止叶原基分化、叶片生长,诱导叶衰老、脱落等。
地径是反映苗木质量的指标之一,且与苗木生长量及其抗逆性密切相关[27],一般情况下逆境胁迫越强,耐涝林木的地径增粗越明显,这可能是由于形成了肥大的皮孔以及在茎基部形成了通气组织导致,但因树种不同,地径生长存在差异[28]。本试验结果表明,短期淹水对湖北海棠苗木地径的增长有一定的促进作用,当淹水时间超过35 d后,会显著抑制其地径增长。
3.3 淹水胁迫对湖北海棠光合色素的影响
植物叶片中的光合色素参与光合作用中光能的吸收、传递和转换,其含量能影响植物光合作用的能力[29]。Ge等人[30]研究表明,水分胁迫不仅使植物的叶绿素含量降低[7],类胡萝卜素的含量也会降低。本试验淹水结束时,湖北海棠叶片的叶绿素a 、叶绿素b、 叶绿素a/叶绿素b、叶绿素(a + b)、类胡萝卜素含量均显著下降,类胡萝卜素/总叶绿素的比值显著增大。这可能是淹水引起活性氧(Reactive oxygen species, ROS)增多,引起叶片细胞膜脂过氧化,导致了光合色素的合成能力下降。
3.4 淹水胁迫对湖北海棠可溶性糖含量的影响
土壤淹水使植物根系暴露在低氧或缺氧的条件下,这会导致能量和糖类的不足,会使根内产生乙醇、乙醛等有害物质[31],会对植株的生长发育造成严重的危害。为了确保渗透调节,植物体内会积累高水平的可溶性溶质,如可溶性糖、脯氨酸、蛋白质[32]等。Pociecha认为植物可以通过积累额外的碳水化合物储备,提高其淹水耐受性及在淹水胁迫下的存活能力[33]。Kreuzwieser等人[20]认为一些敏感植物在淹水一段时间后会消耗可溶性糖,而一些耐涝性较强的植物在淹水过程中可以保持稳定和充足的碳水化合物的供应,以调高糖酵解,这是树木在低氧胁迫下生存的关键。在本试验淹水的各个时期,湖北海棠叶片的可溶性糖含量始终保持在一个较高的水平,说明湖北海棠在淹水逆境中,通过积累可溶糖来缓解淹水逆境对其造成的伤害。
3.5 淹水胁迫对湖北海棠细胞膜和SOD酶活性的影响
活性氧(ROS)的产生是淹水胁迫下的一种次生效应[34]。淹水逆境下,植物ROS代谢易失衡,导致超氧阴离子自由基(O2-·) 、羟自由基(·OH)、过氧化氢(H2O2)等的过度积累[36],会引起膜系统损伤及细胞氧化,发生膜脂过氧化作用[35-37]。丙二醛是膜脂过氧化的最终产物,其积累量通常被作为细胞膜伤害程度的指标[35,38]。Li等人[39]研究显示,低氧胁迫下,湖北海棠和变叶海棠Malus toringoides根内的O2-·和H2O2显著上升,叶片MDA含量显著增高。廖德志等人[40]研究表明,水涝逆境下3个种源青冈栎Cyclobalanopsis glance的MAD含量均呈显著上升的趋势,且在淹水条件下 MDA 含量均显著高于湿害处理。本试验淹水前期(0~7 d),MDA的含量较低,与对照差异不显著(P>0.05);淹水7~42 d,MDA的含量急剧上升,显著高于对照(P<0.05),且在淹水42 d 时达到最大值130.70 umol·g-1,为对照的2.87倍。这说明在此期间,淹水对湖北海棠叶片细胞膜造成了一定程度的伤害;淹水42 d后MDA含量显著下降(P<0.01),可能是在淹水后期茎基部形成肥大皮孔、不定根,这2种结构不仅有利于O2的向下扩散,还有利于根部厌氧代谢产生的副产物如乙醇、CH4、CO2的从茎中排到大气中,从而缓解了淹水对叶片细胞膜的伤害。
植物在淹水下受到的伤害不是因为水分过多造成的,而是植物处于缺氧环境,产生过多的活性氧,导致细胞受到氧化损伤[41]。SOD作为一种O2-·的清除剂,能将O2-·转化成 H2O2和O2[30,42],最终由POD酶清除[35,43]。在本试验淹水的前21 d,SOD酶活性呈上升趋势,且在21 d,酶活性达到最大为1501.28 U·mg·g-1,是对照的1.82倍,说明在淹水的前21 d,湖北海棠可以通过调节SOD酶活性以增大自身的抗氧化能力及清除活性氧的能力;处理21 d后,SOD酶活性急剧下降,但仍显著高于对照(P<0.05)。这说明此时湖北海棠的活性氧清除能力仍较强。
由于植物固着的特性,不能逃避淹水胁迫,在此环境下,耐涝性木本植物可以通过形态适应和生理调节适应淹水逆境[18,20,44]。本试验中,湖北海棠在淹水后期可以通过形成较多数量的肥大皮孔、不定根以及保持较高的碳水化合物水平和较高的SOD酶活性来缓解淹水逆境对其造成的伤害。因此,湖北海棠属于耐水涝的观赏树种,可在洪涝多发区(如沿江、沿海等)推广种植。
植物的抗涝性是一种复合性状,包含形态、生长、解剖构造、生理生化和分子表达等方面[45]。本试验设置淹水和对照2种处理,以苗木的形态特征、生长状况、生理生化指标等的变化为研究对象,对湖北海棠的抗涝性进行初步探索。有关淹水胁迫下苗木茎结构的变化,以及淹水过程中内源激素的变化,本试验未能深入探究。若想更深入地了解湖北海棠在淹水胁迫的响应机理,可增加淹水胁迫后恢复性试验,并结合解剖结构、内源激素变化等指标对湖北海棠抗涝能力进行全面评价。
[1] 陈琳琳, 吴瑞姣, 刘连芬, 等. 湖北海棠的研究进展及应用前景[J]. 北方园艺, 2013,37, (16):217-221.
[2] 李 艳, 黎开燕. 湖北海棠的化学成分和药理活性研究进展[J].中国实验方剂学杂志, 2016,22 (2):226-229.
[3] 张宏岐, 汪鋆植, 邹 坤,等. 湖北海棠提取物的体外抗氧化活性研究[J]. 食品科技, 2008, 33(11):183-186.
[4] 方 荣, 杨 茜, 李 莉,等. 湖北海棠中根皮苷含量测定[J].食品科技, 2008,33 (6): 247-249.
[5] 王耀峰, 宫智勇, 方 敏. 湖北海棠叶黄酮类物质提取工艺的研究. 武汉工业学院学报, 2008,27(2): 12-15.
[6] Bansal R, Srivastava J P. Antioxidative responses to short term waterlogging stress in pigeon pea[J]. Indian Journal of Plant Physiology, 2015, 20(2):182-185.
[7] Zhou C, Bai T, Wang Y, et al. Morpholoical and enzymatic responses to waterlogging in three Prunus, species[J]. Scientia Horticulturae, 2017, 221:62-67.
[8] Zhang Y, Chen Y, Lu H, et al. Growth, lint yield and changes in physiological attributes of cotton under temporal waterlogging[J].Field Crops Research, 2016, 194:83-93.
[9] 曹福亮, 蔡金峰, 汪贵斌, 等. 淹水胁迫对乌桕生长及光合作用的影响[J]. 林业科学, 2010,46 (10):57-61.
[10] Mustroph A, Albrecht G. Tolerance of crop plants to oxygen deficiency stress: fermentative activity and photosynthetic capacity of entire seedlings under hypoxia and anoxia[J].Physiologia Plantarum, 2003,117(4):508-520.
[11] 孔祥生. 植物生理学实验技术[M]. 北京:中国农业出版社,2008: 257-259.
[12] Wellburn A R, Lichtenthaler H. Formulae and program to determine total carotenoids and chlorophylls A and B of leaf extracts in different solvents[M]. Springer Netherlands, 1984:9-12.
[13] 梁文斌, 聂东伶, 吴思政,等. 水分胁迫对短梗大参生理生化特征的影响[J]. 经济林研究, 2016, 34(3):99-104.
[14] 张富玮, 张东亚, 李建贵. 低温胁迫对蓝靛果忍冬渗透调节物质的影响[J]. 经济林研究, 2017,35(2):127-131.
[15] 楚爱香, 张要战, 王萌萌. 四种槭树属(Acer)植物秋色叶变化与色素含量和可溶性糖的关系[J]. 江西农业大学学报,2013, 35(1):108-111.
[16] 秦嗣军, 吕德国, 李志霞, 等. 水分胁迫对东北山樱幼苗呼吸等生理代谢的影响[J]. 中国农业科学, 2011,44(1):201-209.
[17] Phukan U J, Mishra S, Shukla R K. Waterlogging and submergence stress: affects and acclimation[J]. Crit Rev Biotechnol, 2016,36(5):956-966.
[18] Argus R E, Colmer T D, Grierson P F. Early physiological fl ood tolerance is followed by slow post-f l ooding root recovery in the dryland riparian tree Eucalyptus camaldulensis subsp refulgens[J]. Plant Cell & Environment,2015,38(6):1189.
[19] Kreuzwieser J, Rennenberg H. Molecular and physiological responses of trees to waterlogging stress[J]. Plant Cell &Environment, 2015, 37(10):2245-2259.
[20] Shimamura S, Yamamoto R, Nakamura T, et al. Stem hypertrophic lenticels and secondary aerenchyma enable oxygen transport to roots of soybean in fl ooded soil[J]. Annals of Botany,2010, 106(2):277-284.
[21] 汪贵斌, 蔡金峰, 何肖华. 涝渍胁迫对喜树幼苗形态和生理的影响[J]. 植物生态学报, 2009,33(1):134-140.
[22] 刘春风. 淹水对15个树种苗木生长和形态特征的影响[D].南京:南京林业大学, 2009.
[23] Sauter M. Root responses to flooding[J]. Current Opinion in Plant Biology, 2013, 16(3):282.
[24] Yang F, Wang Y, Wang J, et al. Different eco-physiological responses between male and female Populus deltoides clones to waterlogging stress[J]. Forest Ecology and Management, 2011,262(11): 1963-1971.
[25] 张晓磊, 马风云, 陈益泰, 等. 水涝胁迫下不同种源麻栎生长与生理特性变化[J]. 西南林学院学报, 2010,30 (3):16-19.
[26] 曹福亮, 罗伯特·法门. 人工淹水逆境处理对美洲黑杨苗生理特性的影响[J]. 南京林业大学学报(自然科学版), 1993,17(2): 18-24.
[27] 刘 勇. 我国苗木培育理论与技术进展[J]. 世界林业研究,2000,13(5):43-49.
[28] 王哲宇. 九种木本植物幼苗的淹水胁迫生理特征研究[D]. 南京:南京林业大学, 2014.
[29] 吴丽君, 李志辉, 戴 玲,等. 土壤水分胁迫下不同赤皮青冈种源生理特性的研究[J]. 中南林业科技大学学报, 2014,34(2):12-15.
[30] Ge Y, He X, Wang J, et al. Physiological and biochemical responses of Phoebe bournei seedlings to water stress and recovery[J]. Acta Physiologiae Plantarum,2014,36(5):1241-1250.
[31] 吴 麟,张伟伟,葛晓敏,等.植物对淹水胁迫的响应机制研究进展[J].世界林业研究,2012, 25(6):27-33.
[32] Yin D, Chen S, Chen F, et al. Morphological and physiological responses of two chrysanthemum cultivars differing in their tolerance to waterlogging[J]. Environmental and Experimental Botany, 2009, 67(1):87-93.
[33] Pociecha E. Different physiological reactions at vegetative and generative stage of development of fi eld bean plants exposed to flooding and undergoing recovery[J]. Journal of Agronomy &Crop Science, 2013, 199(3):195-199.
[34] Porto B N, Alves J D, Magalhães P C, et al. Calcium-dependent tolerant response of cell wall in maize mesocotyl under fl ooding stress[J]. Journal of Agronomy & Crop Science, 2013, 199(2):134-143
[35] Bor M, Özdemir F, Türkan I. The effect of salt stress on lipid peroxidation and antioxidants in leaves of sugar beet Beta vulgaris L and wild beet Beta maritima L[J]. Plant Science, 2003,164(1):77-84.
[36] Mittal R, Dubey R S. Behaviour of peroxidase in rice: Changes in enzyme activity and isoforms in relation to salt tolerance[J].Plant Physiology & Biochemistry, 1991, 29:31-40.
[37] Foyer C H, Lopez-Delgado H, Dat J F, et al. Hydrogen peroxideand glutathione-associated mechanisms of acclimatory stress tolerance and signalling[J]. Physiologia Plantarum, 1997, 100(2):241-254.
[38] Xu L, Pan Y, Yu F. Effects of water-stress on growth and physiological changes in Pterocarya stenoptera seedlings[J].Scientia Horticulturae, 2015,190:11-23.
[39] Li C, Bai T, Ma F. Hypoxia tolerance and adaptation of anaerobic respiration to hypoxia stress in two Malus species[J]. Scientia Ho rticulturae,2010,124(2):274-279.
[40] 廖德志,陈家法,刘 球,等 . 水涝胁迫对不同种源青冈栎幼苗叶绿素含量和抗氧化酶活性的影响 [J]. 中南林业科技大学学报,2017, 37(9): 1-6.
[41] Mittler R, Vanderauwera S, Gollery, et al. Abiotic stress series reactive oxygen gene network of plants[J]. Trends Plant Sci,2004, 9(2):490-498.
[42] Blokhina O, Virolainen E, Fagerstedt K V. Antioxidants,oxidative damage and oxygen deprivation stress: a review[J].Annals of Botany, 2003,91(2):179.
[43] Saha R R, Ahmed F, Mokarroma N, et al. Physiological and biochemical changes in waterlog tolerant sesame genotypes[J].Agri, 2016,14 (2):31.
[44] Loreti E, H Van V H, Perata P. Plant responses to flooding stress[J]. Plant Biology, 2016 ,33: 64-71.
[45] 武燕奇,郭素娟 .5个板栗品种(系)对持续干旱胁迫和复水的生理响应 [J]. 中南林业科技大学学报,2017, 37(10):67-74.
