Bacillus coagulans BP-2非活性菌株对Cd2+的吸附特性及机理研究
2018-01-29王伟彤彭燕周舒薏郑邦丰陈迪云龙建友
王伟彤,彭燕,,周舒薏,郑邦丰,陈迪云,,龙建友*
1. 广州大学环境科学与工程学院,广东 广州 510006;2. 广东省放射性核素污染控制与资源化重点实验室,广东 广州 510006
随着现代工业的迅速发展,含镉废水的不合理排放不仅污染地表、海洋和地下水资源,还通过食物链累积危及人类生活和身体健康(Mahmoud et al.,2017;Mousumi et al.,2017)。传统处理镉的物理化学方法有离子交换、超滤、反渗透、化学沉淀和溶剂萃取等,但这些方法存在操作成本高、运行时间长、去除不完全,以及难以处置的大量有毒污泥等问题,严重限制了它们的推广应用(Ryszard et al.,2017;Li et al.,2017)。与之相比,微生物由于种类多、分布广、繁殖快、适应性强和易于培养,表面存在大量功能基团如羧基、羟基、氨基、酰胺基等和活性位点,使得重金属很容易被吸附到微生物细胞表面(王泽煌等,2016;Luo et al.,2017)。近年来,利用微生物作为经济、高效的吸附材料去除环境介质中的重金属的研究得到了广泛的关注,如周赓等(2017)研究发现,在温度为30 ℃,pH为 9.0,Cd2+质量浓度为 100 mg∙L-1条件下,利用Streptomyces sp. Cd TB01粉剂吸附溶液中的镉,吸附量可达到70.45 mg∙g-1;王继勇等(2017)利用一株产脲酶菌株对镉吸附特性及机理进行分析,该菌株对镉的去除率可达 70.5%,菌株细胞表面的-OH,-NH,-C=O起主要吸附贡献作用。同时研究表明,非活性微生物菌株对重金属的吸附效果优于活性菌株,如黄飞(2013)发现非活性Bacillus cereus RC-1菌株对的镉吸附量为31.95 mg∙g-1,高于活性菌株(24.01 mg∙g-1)。目前虽然有关细菌吸附Cd2+的研究报道很多,但利用非活性Bacillus coagulans菌株吸附重金属镉的报道相对较少。从韶关大宝山矿区土壤中筛选、分离、纯化得到一株功能菌株Bacillus coagulans BP-2,研究其非活性菌株在不同环境变量下对Cd2+的吸附效果;运用不同模型拟合其吸附过程;利用 FTIR、XRD、XPS等表征手段初步判定菌株与镉的吸附机制,旨在为有效指导实际环境中镉的污染治理提供依据。
1 材料与方法
1.1 材料
1.1.1 实验材料
菌株分离于韶关大宝山矿区土壤,经驯化筛选后保藏于广州大学环境生物学实验室。
1.1.2 实验试剂
稀HCl、硝酸、NaOH溶液、待测金属Cd2+来自分析纯试剂 CdCl2标准溶液,质量浓度为 1000 μg∙mL-1。
1.1.3 培养基
固体培养基(牛肉膏5 g,蛋白胨10 g,氯化钠5 g,琼脂18 g蒸馏水1000 mL,调节至pH 7.0);液体培养基(蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1000 mL,调节至pH 7.0)。
1.2 方法
1.2.1 培养条件
挑取Bacillus coagulans BP-2纯菌落于新鲜无菌的固体培养基中进行划线,置于 25 ℃恒温培养箱中培养24 h,以供菌株液体培养制备吸附剂用。
1.2.2 非活性菌株吸附剂的制备
用无菌水将固体培养基中的Bacillus coagulans BP-2菌落制成孢子悬浮液,并按3%体积比接种到液体培养基中,在150 r∙min-1、25 ℃条件下摇床培养24 h,离心后保留沉淀得到菌体,取菌体用去离子水洗涤后置于恒温烘箱中75 ℃烘干6 h,菌体研磨后得到的粉末即为非活性菌株的吸附剂,然后将粉末进行过筛保存。
1.2.3 菌株16S rDNA基因序列分析
PCR扩增引物为16 F(5′-AGAGTTTGATCCT GGCTCAG-3′)和 16 R(5′-TACGGTTACCTTGTTA CGACTT-3′),扩增程序:94 ℃预变性 2 min,94 ℃变性1 min,55 ℃退火40 s,72 ℃延伸50 s,反复36 个循环,72 ℃再延伸 2 min(Osama et al.,2012)。基因扩增产物纯化后经上海生工测序,将所得序列与 GenBank数据库中已有的16S rDNA序列进行BLAST对比分析,利用MEGA 5.2进行多重序列比对,采用Kimura-2模型构建NJ(Neighbor-joining)系统进化树(Kim et al.,2015)。
1.2.4 吸附试验
准确称取一定量的非活性菌株粉末添加至 50 mL不同质量浓度的镉溶液中,置于100 mL锥形瓶中研究不同环境变量对Cd2+吸附的影响:Cd2+溶液初始质量浓度为10~210 mg∙L-1,接触时间为1~140 min,菌株生物量为 1~5 g∙L-1,在温度为 25 ℃,pH为5,摇床转速为150 r∙min-1条件下进行吸附,吸附完成后取上清液离心,再经0.45 μm滤膜过滤后,采用电感耦合等离子体原子发射光谱(ICP-AES)测定上清液中剩余Cd2+的质量浓度,并按下列公式计算Cd2+的吸附率和吸附量(Antonio et al.,2017;周丹丹等,2016)。
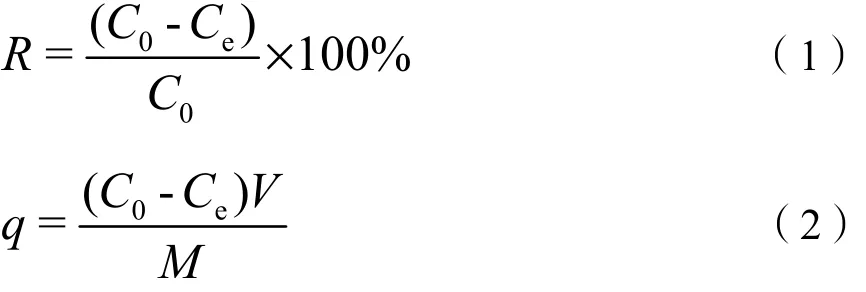
式中,R为非活性菌株粉末对 Cd2+的吸附率,%;C0为溶液中Cd2+初始质量浓度, mg∙L-1;Ce为吸附平衡时溶液中剩余 Cd2+质量浓度,mg∙L-1;q为非活性菌株粉末对 Cd2+的吸附量,mg∙g-1;V为溶液体积,L;M为非活性菌株粉末质量,g。
1.2.5 表征分析
FTIR:取干燥的非活性菌株粉末与KBr混匀研磨、压片,然后在UK61M/RENISHAW型傅立叶变换红外光谱仪上在 400~4000 cm-1内扫描(Chinnannan et al.,2017)。
XRD:将吸附前后的菌株固体粉末压片后,利用JF-2000型X-射线粉末衍射仪进行分析,分析条件如下:Cu靶 Ka能级,扫描角度 2θ=100°~800°,温度25 ℃,电流100 mA,加速电压50 KV,采用连续扫描方式,扫描速度50 min-1(Ge et al.,2017)。
XPS:将吸附前后的菌株粉末冷冻干燥,用Perkin-Elmer型X射线光电子能谱检测Cd2+结合能的变化,判断 Cd2+与菌株结合前后电子能谱差异(Lalhmunsiama et al.,2017)。
1.2.6 吸附等温模型
基于吸附特性试验中得到的对 Cd2+的最佳吸附条件,考察菌株在平衡条件下的吸附等温特征,可运用Langmuir和Freundlich模型表示拟合:

式中,qmax为最大吸附量;mg∙g-1;b 为 Langmuir吸附常数;n和Kf为Freundlich吸附常数。
1.2.7 吸附动力学模型
基于吸附特性试验中得到的对 Cd2+的最佳吸附条件,考察菌株在不同吸附时间下吸附量之间的变化。可分别用一级动力学(pseudo-first-order)模型和二级动力学(pseudo-second-order)模型进行拟合:

式中,K1为一级动力学模型吸附常数;t为时间,min;qt为t时刻菌株粉末对Cd2+的吸附量;k2为二级动力学模型吸附常数。
2 结果与分析
2.1 菌株16S rDNA序列的系统发育树
菌株的16S rDNA序列扩增后得到一段大小为1439 bp的基因片段,通过 GenBank将序列提交NCBI数据库进行Blast同源性分析,结果显示,BP-2菌株与Bacillus coagulans序列有99%的同源性,利用Mega 5.2软件绘制与其相关的种的16S rDNA序列并构建NJ(neighbor-joining)系统发育树(图1),由图1可知,BP-2菌株与Bacillus coagulans的亲缘关系最近,表明该菌株属于芽孢杆菌属,将其命名为 Bacillus coagulans BP-2,该菌株序列已提交NCBI数据库,登录号为JF901703。
2.2 Cd2+初始浓度对Bacillus coagulans BP-2菌株吸附的影响
在微生物吸附重金属影响因素研究中,重金属的浓度是其中一个重要的影响因素。由图2可知,非活性菌株Bacillus coagulans BP-2受Cd2+初始质量浓度影响较大,在初始质量浓度为 20~150 mg∙L-1时,吸附量随之增加,这是由于菌株表面的吸附位点没有被 Cd2+充分占据,当 Cd2+浓度增加时,吸附量也增加,之后随着 Cd2+初始质量浓度继续增加,吸附量保持不变;吸附率随着 Cd2+初始质量浓度的增加而降低,这可能是因为过高的Cd2+浓度会导致其对吸附位点的竞争,从而导致吸附率降低(宋瑛瑛等,2016)。

图2 Cd2+初始浓度对Bacillus coagulans BP-2菌株吸附的影响Fig. 2 Effects of Cd2+ initial concentration of Bacillus coagulans BP-2 on biosorption
图3 吸附时间对Bacillus coagulans BP-2菌株吸附的影响Fig. 3 Effects of contact time of Bacillus coagulans BP-2 on biosorption

图1 BP-2菌株与相关种16S rDNA序列的系统发育树Fig. 1 Molecular phylogenetic consensus of strain BP-2 based on 16S rDNA gene sequence
2.3 接触时间对Bacillus coagulans BP-2菌株吸附的影响
由图 3可知,随着时间的延长,菌株对 Cd2+的吸附量也逐渐增加,当接触时间为80 min时,该菌株对镉的吸附量达到最大,为72.36 mg∙g-1,这可能是由于在吸附开始阶段,菌株表面存在大量可利用的吸附位点,可以吸附更多的金属离子,导致吸附量增加;但随着吸附时间的延长,吸附量不发生变化,这是由于随着时间的增加,反应趋向平衡,菌株吸附已达到饱和,故吸附量不再增加(Weon et al.,2014)。由此推断,菌株吸附Cd2+的最佳时间为80 min。
2.4 生物量对Bacillus coagulans BP-2菌株吸附的影响
由图4可知,当生物量浓度为0~2.5 g∙L-1时,吸附量随着生物量的增加而增加,这可能是因为生物量的增加导致菌株表面吸附位点的增加,同时菌株与Cd2+的接触概率逐渐增大,并在2.5 g∙L-1时达到峰值,此时吸附量最高,为73.15 mg∙g-1;继续增加生物量浓度,吸附量保持不变,这是由于溶液中Cd2+吸附达到饱和的缘故(Yang et al.,2017)。

图4 生物量对Bacillus coagulans BP-2菌株吸附的影响Fig. 4 Effects of biomass of Bacillus coagulans BP-2 on biosorption
2.5 Bacillus coagulans BP-2菌株吸附Cd2+前后FTIR分析
对比菌株吸附前后峰值偏移及强度变化,由图5可知,位于3406 cm-1附近的吸收峰显示的是-OH或-NH伸缩振动的重叠吸收带,本研究发现该菌株由吸附前的3406.42 cm-1偏移到吸附后的3415.20 cm-1,这可能是由于菌株表面的-OH或-NH与Cd2+发生了配位作用导致峰位的偏移;吸收峰由吸附前的2904.33 cm-1偏移到吸附后的2940.19 cm-1,说明C-H参与了其吸附过程;1631.53 cm-1处的强吸附可能是-C=O的伸缩振动所产生,其吸附完成后峰位从1631.53 cm-1偏移到1649.83 cm-1,说明菌株表面的功能基团-C=O与溶液中Cd2+发生了反应;1022 cm-1附近处峰位是由 C-OH的伸缩振动所产生的,吸附后由1022.58 cm-1偏移到1067.23 cm-1,且峰的强度有明显减弱,说明C-OH参与了吸附过程。综上所述,非活性菌株细胞表面的-OH或-NH、C-H、-C=O及C-OH与Cd2+发生了作用,吸附前后特征峰的位置和强度都发生了变化(李璐玮等,2016;Zhou et al.,2017)。

图5 BP-2菌株吸附Cd2+前(A)后(B)红外光谱分析Fig. 5 FT-IR analysis of strain BP-2 before (A) and after (B)adsorbing Cd2+
2.6 Bacillus coagulans BP-2菌株吸附Cd2+前后XRD分析
Bacillus coagulans BP-2对 Cd2+吸附前后的XRD分析结果如图6所示,通过衍射角出现的Cd2+的特征峰可知,Bacillus cereus在吸附Cd2+前后发生了变化,吸附前,无Cd2+特征峰出现,吸附后,分别在 13.3°、39.1°处出现了明显的 Cd2+特征峰,与 MDI Jade软件标准卡进行对比,推测 Bacillus coagulans BP-2吸附 Cd2+后在菌株表面形成了(NH4)4CdS6化合物,说明Cd2+被成功吸附到了菌株的表面(Wang et al.,2017)。
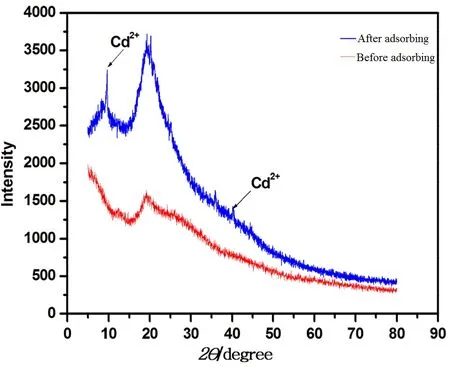
图6 BP-2菌株吸附Cd2+前(A)后(B)XRD分析Fig. 6 XRD analysis of strain BP-2 before and after adsorbing Cd2+
2.7 Bacillus coagulans BP-2菌株吸附Cd2+前后XPS分析
菌株吸附前后的 XPS全峰分析结果如图 7所示,吸附前后元素含量变化见表1。由图7和表1可知,吸附后的C从64.48%增加到69.15%,说明菌株细胞表面的-OH可能在吸附过程中与Cd2+发生了相互作用;-NH官能团的结合能位于400 eV附近,吸附完成后,N的含量由吸附前的 11.55%降至吸附后的7.14%,这说明-NH参与了Cd2+的吸附过程;532 eV附近代表的-C=O官能团由吸附前的23.51%减少到了22.27%,说明-C=O亦对Cd2+的吸附有贡献作用;而菌株表面 Cd2+的含量增加了0.96%,说明Cd2+被成功吸附到了菌株的表面(操艳兰等,2016;Tan et al.,2017;Lata et al.,2017)。总之,由XPS分析可知,非活性菌株表面的-OH、-NH和-C=O基团参与了 Cd2+的吸附过程,这与FTIR分析的结果一致。

图 7 BP-2菌株吸附Cd2+前(A)后(B)XPS分析.Fig. 7 XPS analysis of strain BP-2 before (A) and after (B)adsorbing Cd2+
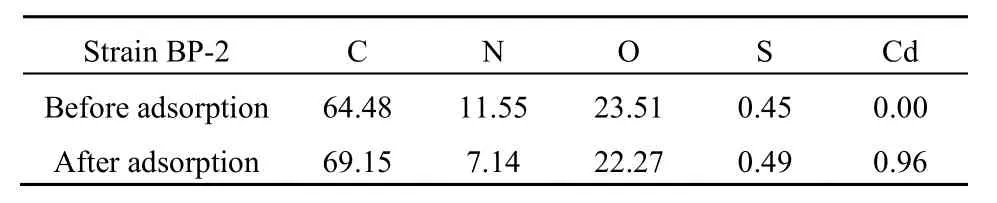
表1 Bacillus coagulans BP-2非活性菌株吸附Cd2+前后元素含量分析Table 1 Element content analysis of Cd2+ before and after the adsorption by the inactive Bacillus coagulans BP-2
2.8 Bacillus coagulans BP-2菌株对Cd2+的吸附等温模型
本研究采用Langmuir和Freundlich吸附模型对Cd2+的吸附过程进行线性拟合,结果如图 8(a),图8(b)所示,其拟合的相关参数计算见表 2。由图 8可知,菌株吸附Cd2+的Langmuir等温模型的相关系数r2(0.9911)高于Freundlich模型的r2(0.9767),因此,Langmuir模型更能准确描绘菌株的吸附过程,说明该菌株对Cd2+的吸附以单层吸附为主(Gao et al.,2017;Tang et al.,2017)。

表2 Bacillus coagulans BP-2非活性菌株吸附Cd2+等温常数Table 2 Isotherm constants for the adsorption of Cd2+ by the inactive Bacillus coagulans BP-2
2.9 Bacillu
s coagulans BP-2菌株对Cd2+的吸附动力学
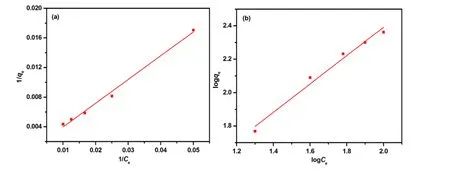
图8 BP-2菌株吸附Cd2+的Langmuir和Freundlich模型Fig. 8 Langmuir and Freundlich model of strain BP-2 adsorbing Cd2+
Bacillus coagulans BP-2菌株对Cd2+吸附过程的一级、二级动力学模型分别如图9(a),图9(b)所示,相关参数见表3。由图9和表2可知,二级动力学模型相关系数(r2=0.9814)高于一级动力学模型(r2=0.9653),说明二级动力学模型更能准确描绘 Cd2的+吸附过程(Pugazhendhi et al.,2014;Filomena et al.,2017);同时,二级动力学模型拟合计算的吸附量(qe=57.77 mg∙g-1)与实际测定的吸附量(qe=60.10 mg∙g-1)较为接近,说明二级动力学模型更能反映该菌株对Cd2+的全过程吸附。
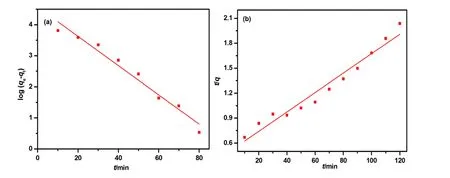
图9 BP-2菌株吸附Cd2+一级动力学和二级动力学模型Fig. 9 Pseudo-first-order and Pseudo-second-order model of strain BP-2 adsorbing Cd2+

表3 Bacillus coagulans BP-2非活性菌株吸附Cd2+动力学参数Table 3 Kinetic parameters for the adsorption of Cd2+ by the inactive Bacillus coagulans BP-2
3 结论
(1)在NCBI数据库中对BP-2菌株的16S rDNA基因序列进行Blast同源性比对,发现其与Bacillus coagulans序列相似性高达 99%,初步鉴定该菌株属于芽孢杆菌属,并命名为 Bacillus coagulans BP-2。
(2)Bacillus coagulans BP-2非活性菌株吸附Cd2+的最佳条件为:Cd2+初始质量浓度为 100 mg∙L-1,非活性菌株生物量为 2.5 g∙L-1,吸附时间为80 min,在该条件下菌株对Cd2+的最大吸附量可达73.26 mg∙g-1。
(3)FTIR结果表明,非活性BP-2菌株细胞壁上的-OH或-NH、C-H、-C=O及C-OH在其对Cd2+的吸附过程中起主要贡献作用。XRD结果表明,吸附后,在13.3°、39.1°处出现了2个明显的Cd2+特征峰,说明Cd2+被成功吸附到菌株表面,并推测吸附后在菌株表面可能形成了(NH4)4CdS6化合物。XPS结果表明,菌株表面的-OH、-NH和-C=O基团参与了Cd2+的吸附过程。
(4)吸附动力学模拟结果表明,二级动力学模型能较好拟合菌株对Cd2+的吸附过程。吸附等温模型结果表明,Langmuir模型更能准确地描绘菌株对Cd2+的吸附过程,拟合后的最大吸附量可达 86.19 mg∙g-1。
ANTONIO J M, FRANCISCO E, ENCARNACIÓN R. 2017. Biosorption of Ag (I) from aqueous solutions by Klebsiella sp. 3S1 [J]. Journal of Hazardous Materials, 329: 166-177.
CHINNANNAN K, SELVARAJ B, ARIVALAGAN P. 2017. Evaluation of Cr(VI) reduction mechanism and removal by Cellulosimicrobium funkei strain AR8, a novel aloalkaliphilic bacterium [J]. Journal of Hazardous Materials, 333: 42-53.
FILOMENA C, TERESA T. 2017. Bioremoval of Ni and Cd in the presence of diethyl ketone by fungi and by bacteria-A comparative study [J].International Biodeterioration & Biodegradation, 120: 115-123.
GAO X P, ZHANG Y, ZHAO Y M. 2017. Biosorption and reduction of Au(III) to gold nanoparticles by thiourea modified alginate [J].Carbohydrate Polymers, 159: 108-115.
GE N, XU J J, PENG B Z, et al. 2017. Adsorption mechanism of tenuazonic acid using inactivated lactic acid bacteria [J]. Food Control, 82:274-282.
KIM S Y, JIN M R, CHUNG C H, et al. 2015. Biosorption of cationic basic dye and cadmium by the novel biosorbent Bacillus catenulatus JB-022 strain [J]. Journal of Bioscience and Bioengineering, 119(4): 433-439.
LALHMUNSIAMA, PRABUDDHA L G, HYUNHOON J, et al. 2017.Insight into the mechanism of Cd(II) and Pb(II) removal by sustainable magnetic biosorbent precursor to Chlorella vulgaris [J]. Journal of the Taiwan Institute of Chemical Engineers,71: 206-213.
LATA R, AVIK H, ABHRADEEP M. et al. 2017. Industrial waste derived biosorbent for toxic metal remediation: Mechanism studies and spent biosorbent management [J]. Chemical Engineering Journal, 308:1048-1064.
LI D D, XU X J, YU H W. 2017. Characterization of Pb2+biosorption by psychrotrophic strain Pseudomonas sp. 13 isolated from permafrost soil of Mohe wetland in Northeast China [J]. Journal of Environmental Management, 196: 8-15.
LUO S, LI L L, CHEN A W, et al. 2017. Biosorption of diethyl phthalate ester by living and nonliving Burkholderia cepacia and the role of its cell surface components [J]. Chemosphere, 178: 187-196.
MAHMOUD R, ZAHRA S, YAR M B. 2017. Removal of cadmium ions from aqueous solutions using TMU-16-NH2 metal organic framework[J]. Environmental Nanotechnology Monitoring & Management, 7:89-96.
MOUSUMI B, ARUN K G, LALITAGAURI R. 2017. Adsorption behavior of Cadmium on husk of lentil [J]. Process Safety and Environmental Protection, 106:11-22.
OSAMA A M, HAO X L, XIE P, et al. 2012. Biosorption of Copper (II)from Aqueous Solution Using Non-Living Mesorhizobium amorphae Strain CCNWGS0123 [J]. Microbes and Environments, 27(3):234-241.
PUGAZHENDHI A, DHIVYA S, VALSALA H. 2014. Removal of cadmium from aqueous solution by batch studies using Bacillus cereus[J]. Ecological Engineering, 71: 728-735.
RYSZARD D, ALEKSANDRA S, MAGDALENA C. 2017. Studies of cadmium (II), lead (II), nickel (II), cobalt (II) and chromium (VI)sorption on extracellular polymeric substances produced by Rhodococcus opacus and Rhodococcus rhodochrous [J]. Bioresource Technology, 225: 113-120.
TAN L, DONG H G, LIU X X, et al. 2017. Mechanism of palladium(II)biosorption by Providencia Vermicola [J]. RSC Advance, 7(12):7060-7072.
TANG J, LI Y, WANG X. 2017. Effective adsorption of aqueous Pb2+by dried biomass of Landoltia punctata and Spirodela polyrhiza [J].Journal of Cleaner Production, 145: 25-34.
WANG T S, ZHENG X Y, WANG X Y. 2017. Different biosorption mechanisms of Uranium(VI) by live and heat-killed Saccharomyces cerevisiae under environmentally relevant conditions [J]. Journal of Environmental Radioactivity, 167: 92-99.
WEON B, MEJIAS C, GLAUCIA M S, et al. 2014. Copper removal using a heavy-metal resistant microbial consortium in a fixed-bed reactor [J].Water Research, 62: 156-166.
YANG W C, TIAN S Q, TANG Q Z, et al. 2017. Fungus hyphae-supported alumina: An efficient and reclaimable adsorbent for fluoride removal from water [J]. Journal of Colloid and Interface Science 496:496-504.
ZHOU Z, LIU Y G, LIU S B, et al. 2017. Sorption performance and mechanisms of arsenic(V) removal by magnetic gelatin-modified biochar [J]. Chemical Engineering Journal, 314: 223-231.
操艳兰, 朱能武, 石超宏, 等. 2016. 鲍希瓦氏菌吸附Au3+的影响因素及机理研究[J]. 环境科学学报, 36(6): 1962-1970.
黄飞. 2013. 蜡状芽孢杆菌对水体中镉的吸附特性与机理研究[D]. 广东:华南理工大学: 79-89.
李璐玮, 祝方, 任腾飞, 等. 2016. 表面印迹材料对水中Cd (II)的吸附动力学[J]. 环境化学, 35(4): 793-799.
宋瑛瑛, 王春燕, 杨玉荣, 等. 2016. 铅吸附深色有隔内生真菌的筛选及其吸附特性[J]. 环境科学学报, 36(5): 1630-1638.
王继勇, 陈加立, 杨子陆, 等. 2017. 一株产脲酶菌株的分离及其对Cd2+的去除研究[J]. 环境科学学报, 37(8): 2911-2917.
王泽煌, 王蒙, 蔡昆争, 等. 2016. 细菌对重金属吸附和解毒机制的研究进展[J]. 生物技术通报, 32(12): 13-18.
周丹丹, 吴文卫, 赵婧, 等. 2016. 花生壳和松木屑制备的生物炭对Cu2+的吸附研究[J]. 生态环境学报, 25(3): 523-530.
周赓, 杨辉, 潘虎, 等. 2017. 一株耐镉链霉菌的筛选、鉴定及基本特性分析[J]. 环境科学学报, 37(6): 2076-2084.
