冬虫夏草对糖尿病肾病大鼠肾小管细胞中AMPK/mTOR信号传导途径的影响*
2018-01-29徐喆赵凯李志军
徐喆,赵凯,李志军
(1.天津医科大学研究生院,天津 300070;2.天津市南开医院 心内一科,天津 300100;3.天津市第一中心医院 中西医结合科,天津 300192)
糖尿病肾病(diabetic nephropathy,DN)又称糖尿病肾小球硬化症,是常见的糖尿病慢性微血管并发症,近年来其发病率呈逐渐上升趋势[1-2]。糖尿病肾病的主要病理改变是细胞外基质的重构引起肾小球硬化和肾间质纤维化的病理改变,最终导致肾功能衰竭[2-3]。其中,肾小管上皮细胞间充质转分化是损伤的肾细胞转变成纤维细胞,进而发生肾纤维化的引发糖尿病肾病的关键[3-4]。研究表明,细胞自噬可以通过与细胞生长,增殖,存活和死亡相关的多种信号传导途径诱导和加速肾小管上皮细胞的损伤和死亡。LC3作为自噬激活的主要细胞学标志,定位于前自噬泡和自噬泡膜表面,主要由AMPK/mTOR信号通路调控。LC3主要分为LC3-I和LC3-Ⅱ 2个亚型,其中LC3-Ⅱ共价结合在磷脂酰乙醇胺的羧基端,并且更加牢固地结合在自噬体膜上,因此,通过检测细胞内LC3-Ⅱ的含量变化,可以方便地判断细胞状态,LC3-II是细胞自噬泡膜的通用标记物。AMPK是一种重要的受体,有助于细胞识别能量调节的变化,mTOR激酶是自噬的主要调节剂和关键信号分子,该自噬途径启动受触发因素影响,如营养剥夺、胰岛素和其他生长因子,该因素可以与酪氨酸激酶受体结合而导致相关受体和磷酸肌醇3激酶(phosphoinositide 3-kinase,PI3K)/AMP依赖的蛋白激酶(adenosine 5'-monophosphate AMP-activated protein kinase,AMPK)信号通路的激活,最终激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),而mTOR的激活可直接抑制自噬的启动,通过调控自噬相关基因LC3-Ⅱ阻断自噬通路。因此,对于探寻有效的方法阻止和缓解肾小管上皮细胞的损伤,合理的控制和缓解细胞自噬造成的细胞损伤是DN研究的重点。本探讨传统中药冬虫夏草对DN肾小管上皮细胞增殖和分化的作用,及冬虫夏草对糖尿病肾病的治疗和防护作用。
1 材料与方法
1.1 主要试剂与仪器
60只成年雄性Wistar大鼠(购自北京维通利华实验动物技术有限公司)。大鼠饲养在无特定病原体(SPF)级动物实验室,12 h/12 h昼夜循环光照,温度为(22±2)℃。冬虫夏草(商品名:百令胶囊),规格:0.5 g每粒,批号:110826(杭州中美华东制药有限公司)。一抗兔抗多克隆抗体p-AMPK、p-mTOR、LC-II和ACTB(美国Santa Cruz生物技术有限公司),二抗碱性磷酸酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司),TUNEL细胞凋亡检测试验盒(上海碧云天生物工程有限公司),SDS-PAGE电泳设备及转膜仪(美国Bio-rad公司)。
1.2 大鼠糖尿病模型复制
大鼠随机分为对照组、模型组和实验组,每组20只。参照文献[5]。模型组和实验组大鼠给予腹腔内1次注射链脲佐菌素(STZ)55 mg/kg诱导糖尿病模型。3 d后大鼠尾静脉取血,监测大鼠血糖在16.7~27.0 mmol/L,视为糖尿病造模成功。1周后对大鼠进行尿蛋白测定,若蛋白含量均<30 mg/24 h,则为糖尿病大鼠的成功模型。模型成功后第2天给予实验组大鼠冬虫夏草灌胃[2.5 g/(kg·d)],对照组和模型组给予同剂量生理盐水灌胃,连续灌胃8周后处死大鼠。常规测定尿蛋白量和血肌酐;HE法检测肾脏病理改变;TUNEL检测肾小管细胞凋亡;采用Western blot检测AMPK、mTOR和LC-Ⅱ的蛋白表达。
1.3 采样与指标检测
成模后第8周末将大鼠放入代谢笼中,收集排泄24 h的尿液,大鼠血糖用血糖仪测定。10%水合氯醛(300 mg/kg)将大鼠腹腔注射麻醉,双缩脲法测定大鼠尿蛋白含量;心脏穿刺采血,终点酶法测血清肌酐含量。
处死大鼠后,分离两肾,取左肾测定左肾体重比(LKW/BWT),置于液氮中备用;取右肾称重后,用10%中性甲醛固定,常规脱水、透明及浸蜡包埋,连续石蜡切片6张(5 μm/张),切片用于HE染色和TUNEL原位凋亡细胞检测。
1.4 TUNEL检测原位凋亡细胞
切片加入标记液37℃孵育2 h后,加入生物素37℃孵育30 min。37℃恒温孵育SABC试剂30 min,加入DAB显色液进行显色。切片用×20、×40物镜显微镜进行观察,细胞核中有棕黄色颗粒者即为凋亡细胞。每张切片选择6个高倍镜视野进行计数(×400),平均值即为切片凋亡细胞数。
1.5 Western blot检测蛋白表达水平
取大鼠肾组织冰上裂解2 h,离心后用BCA试剂盒进行蛋白浓度检测,将各组蛋白浓度总量调整为30 μg/μl。将各组蛋白样品加入到10% SDS聚丙烯酰胺凝胶中进行电泳,转膜至PVDF膜后按1∶500的稀释比例加入多克隆抗体p-AMPK、p-mTOR、LC-II、ACTB和二抗。ECL显色剂显色,用Bio-Pro凝胶成像分析仪成像以及用Quantity-one软件对各泳道条带进行灰度扫描得出相应蛋白表达量。
1.6 统计学方法
数据处理采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,比较做单因素方差分析,两两比较用Bonferroni's Multiple Comparison Test检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠物理及生化指标
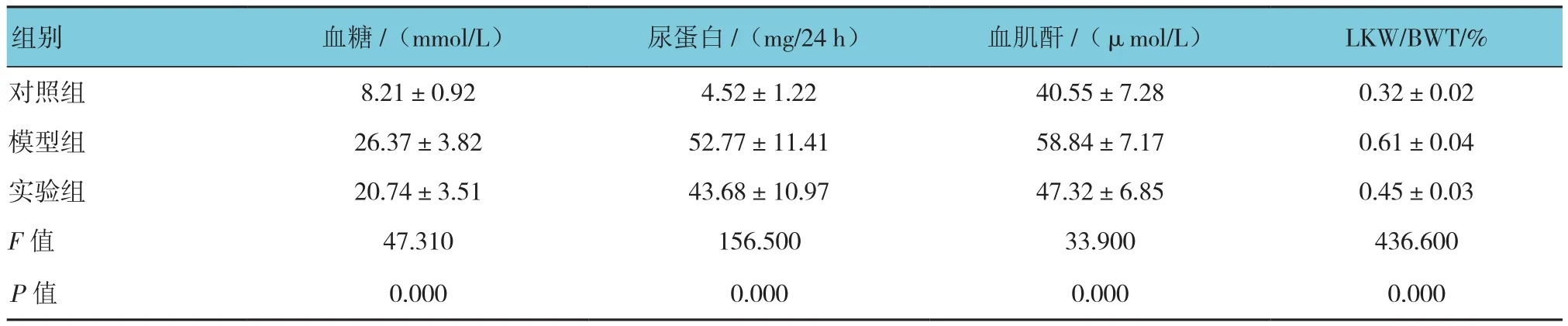
与对照组比较,模型组和实验组大鼠血糖含量增加,差异有统计学意义(F=47.310,P=0.000);模型组和实验组大鼠尿蛋白含量增加,差异有统 计 学 意 义(F=156.500,P=0.000); 模 型 组和实验组大鼠血清肌酐含量增加,差异有统计学意 义(F=33.900,P=0.000); 模 型 组 和 实 验 组大鼠LKW/BWT增加,差异有统计学意义(F=436.600,P=0.000)。
与模型组比较,实验组大鼠血糖含量降低,差异有统计学意义(t=2.950,P=0.000);尿蛋白含量降低,差异有统计学意义(t=3.141,P=0.000);血清肌酐含量降低,差异有统计学意义(t=5.130,P=0.000);LKW/BWT降低,差异有统计学意义(t=16.270,P=0.000)。见附表。
附表 3组大鼠物理及生化指标的比较 (n =20,±s)
附表 3组大鼠物理及生化指标的比较 (n =20,±s)
组别 血糖/(mmol/L) 尿蛋白/(mg/24 h) 血肌酐/(μmol/L) LKW/BWT/%对照组 8.21±0.92 4.52±1.22 40.55±7.28 0.32±0.02模型组 26.37±3.82 52.77±11.41 58.84±7.17 0.61±0.04实验组 20.74±3.51 43.68±10.97 47.32±6.85 0.45±0.03 F值 47.310 156.500 33.900 436.600 P值 0.000 0.000 0.000 0.000
2.2 HE染色结果
对照组大鼠的肾组织形态未见明显异常,肾间质、肾小球和肾小管的结构基本正常。模型组大鼠可见肾小管上皮细胞出现大量的空泡变性,上皮细胞出现变形、脱落和部分坏死;肾小管出现管腔扩张、纤维化或萎缩,出现水肿和炎症细胞浸润;肾小球基底膜增厚,肾小球出现部分硬化,肾间质出现明显的纤维组织增生。实验组症状改善,肾间质肾小管结构破坏并不明显,损伤有所改善。见图1。

图1 大鼠的肾组织形态 (HE×400)
2.3 凋亡细胞
对照组仅见少量凋亡细胞,模型组和实验组大鼠肾内凋亡细胞数量增多,与对照组大鼠凋亡细胞数量(47.232±5.118)比较,模型组大鼠凋亡细胞数量(184.734±13.610)和实验组大鼠凋亡细胞数量(136.878±12.433)增加,差异有统计学意义(F=798.800,P=0.000)。与模型组比较,实验组大鼠凋亡细胞数量降低,差异有统计学意义(t=13.700,P=0.000)。见图 2、3。
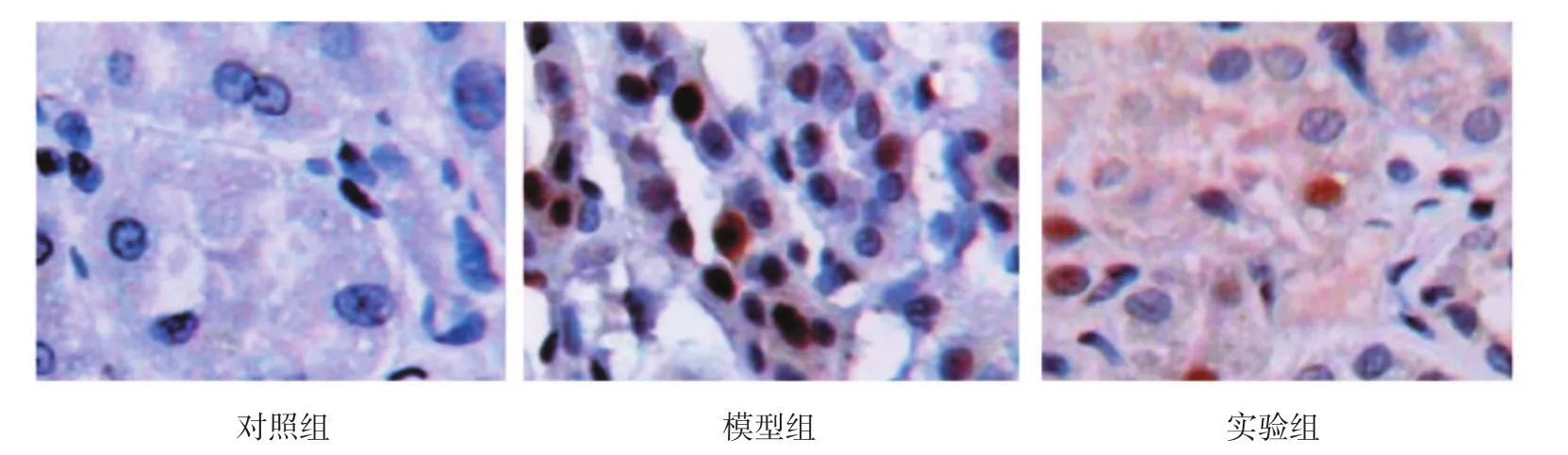
图2 原位凋亡细胞 (TUNEL×400)
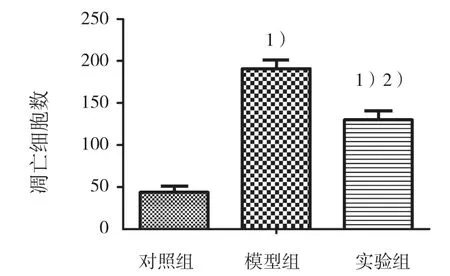
图3 3组凋亡细胞比较
2.4 3组蛋白表达水平比较
与对照组比较,模型组和实验组中p-mTOR蛋白含量(47.234±5.122)降低,差异有统计学意义(F=272.100,P=0.000);模型组和实验组中p-AMPK蛋白含量升高,差异有统计学意义(F=198.400,P=0.000);模型组和实验组中LC-Ⅱ蛋白含量升高,差异有统计学意义(F=328.100,P=0.000)。
与模型组比较,实验组p-mTOR蛋白含量升高,差异有统计学意义(t=13.720,P=0.000);p-AMPK蛋白含量降低,差异有统计学意义(t=9.064,P=0.000);LC-Ⅱ的蛋白含量降低,差异有统计学意义(t=10.456,P=0.000)。见图 4。

图4 3组mTOR、AMPK和LC-Ⅱ蛋白表达水平比较
3 讨论
CS是一种名贵的虫草属植物类药用真菌,主要由氨基酸、脂肪酸、多糖、有机酸和多种微量元素构成[6-7]。研究表明,CS可有效降低血尿素氮和尿蛋白,减轻肾脏病理改变,阻止肾小球代偿性肥大[8-9];能够拮抗氨基糖苷所致的溶酶体损伤和脂质过氧化损伤,保护和调节肾组织表皮生长因子的表达,促进肾小管的修复和再生[9-10];CS可以抑制肾组织和肾小球硬化,减轻肾小管萎缩和肾间质损伤,促进肾小管上皮细胞的修复,同时对肾间质纤维化有明显的防治作用[11-12];同时,冬虫夏草能够降低糖尿病动物模型中血胆固醇、血肌酐和血Ⅳ型胶原的表达,抑制和缓解肾组织纤维化,减轻和延缓肾脏病理变化,对糖尿病肾病所致的大鼠肾损伤起到治疗和防护作用[10-12]。
本研究表明,冬虫夏草可以缓解糖尿病肾病导致的大鼠血糖含量、尿蛋白含量、血清肌酐含量和LKW/BWT等常规指标增高的状态。同时,CS持续作用糖尿病肾病大鼠后,大鼠肾脏的肾小管、肾小球和肾基质损伤缓解,还可以有效减轻肾小管细胞的细胞损伤和坏死。由于mTOR和AMPK已被确定为自噬的主要调节剂,AMPK是一种重要的受体,活化的AMPK负调节mTOR,在富含氨基酸和生长因子的营养充足时,细胞中mTOR被激活,用于阻断自噬通路;而当营养缺乏,细胞处于饥饿环境时,mTOR的活性受到抑制,促进细胞自噬通路的发生[13-15]。LC-Ⅱ作为参与mTOR信号通路的主要细胞自噬蛋白,在细胞自噬,细胞周期,细胞凋亡的过程中起到主要的调节作用[15]。研究表明,冬虫夏草的肾脏保护作用可通过有效调节AMPK/mTOR信号通路的表达,降低LC-3II蛋白的含量,可以有效降低肾小管细胞自噬的发生。
综上所述,本研究表明冬虫夏草提取物能改善糖尿病肾病大鼠的肾小管细胞的自噬作用,减轻肾小管细胞的损伤,延缓大鼠糖尿病肾病的进展。冬虫夏草可能通过调节AMPK/mTOR信号通路的基因表达,延缓肾小管细胞的损伤。
[1]段玉蕊, 杨素霞, 陈宝平. 冬虫夏草胶囊联合替米沙坦片对糖尿病肾病大鼠肾小管上皮细胞转分化的调节作用[J]. 中国临床药理学杂志, 2016, 32(23): 2170-2173.
[2]施海涛, 杨庆春, 王雪峰, 等. 冬虫夏草对延缓糖尿病肾病肾小球系膜细胞增殖的研究[J]. 中国现代医生, 2011, 49(22): 11-12.
[3]KHWAJA A, EL KOSSI M, FLOEGE J, et al. The management of ckd: alook into the future[J]. Kidney Int, 2007, 72(11): 1316-1323.
[4]KUME S, KITADA M, KANASAKI K, et al. Anti-aging molecule,SIRT1: a novel therapeutic target for diabetic nephropathy[J]. Arch Pharm Res, 2013, 36(2): 230-236.
[5]金永东, 宁建平, 张义雄, 等. 冬虫夏草对糖尿病大鼠肾小管上皮细胞ILK表达的影响[J]. 医学临床研究, 2008, 25(6): 1022-1025.
[6]高玉梅, 刘国平. 冬虫夏草对肾脏的保护作用研究进展[J]. 医学综述, 2010, 16(2): 289.
[7]胡征, 李华屏, 叶茂青, 等. 冬虫夏草菌药理功能研究进展[J].氨基酸和生物资源, 2003, 25(4): 20-23.
[8]GIMBLE J M, KATZ A J, BUNNELL B A. Adipose-Derived stem cells for regenerative medicine[J]. Cite Res, 2007, 100(9): 1249-1260.
[9]刘乃琴, 邵卉, 赵香芳, 等. 冬虫夏草肾保护的分子生物学机制研究进展[J]. 医学综述, 2014, 20(1): 123-126.
[10]张惠丽, 徐米清, 肖洁. 冬虫夏草对梗阻性肾病大鼠肾间质表皮生长因子及转化生长因子-β1表达的影响[J]. 广东医学,2015, 36(2): 174-177.
[11]郭山脉, 仲芳, 周桥, 等. 冬虫夏草制剂拮抗5/6肾切除大鼠肾脏纤维化作用研究[J]. 上海交通大学学报, 2012, 32(1): 1-8.
[12]洪学敏, 周巧玲, 唐荣, 等. NRK-52E缺血再灌注损伤时Kim-1、NO变化及虫草对其的干预作用[J]. 中国现代医学杂志,2011, 21(31): 3866-3871.
[13]杨湘怡, 陶润知, 聂亚雄. mTOR依赖的自噬通路与神经变性疾病[J]. 中南医学科学杂志, 2014, 42(2): 191-195.
[14]NAZIO F, STRAPPAZZON F, ANTONIOLI M, et al. mTOR inhibits autophagy by controlling ULK1 ubiquitylation, selfassociation and function through AMBRA1 and TRAF6[J].Nature Cell Biology, 2013, 15(4): 406-416.
[15]WU S T, SUN G H, CHA T L, et al. CSC-3436 switched tamoxifen-induced autophagy to apoptosis through the inhibition of AMPK/mTOR pathway[J]. Journal of Biomedical Science,2016, 23(1): 60.
