基于Image J软件的肌原纤维蛋白SDS—PAGE优化
2018-01-27朱萌石柳汪兰熊光权吴文锦李新丁安子
朱萌+石柳+汪兰+熊光权+吴文锦+李新+丁安子


摘要:采用浓缩胶浓度为5%,分离胶浓度为12%的SDS-PAGE凝胶系统,运用Image J软件分析不同蛋白质浓度、pH、NaCl浓度对肌原纤维蛋白的分离效果。结果表明,在蛋白质浓度为1.2 mg/mL、pH为7.5、NaCl浓度为0.5 mol/L时,肌原纤维蛋白中各蛋白质及其亚基实现较好分离,均匀分布于整个电泳条带,且各蛋白条带光密度值能清晰分辨。Image J软件能有效地应用于SDS-PAGE图像分析。
关键词:肌原纤维蛋白;SDS-PAGE;Image J软件
中图分类号:TS254.1 文献标识码:A 文章编号:0439-8114(2017)24-4839-05
Image J软件是由National Institutes of Health开发的基于Java的图像处理软件,可计算选定区域内分析对象的一系列几何特征。现已广泛应用于植物叶片形态特征描述[1]、金属显微定量分析[2]、针织物孔隙率统计[3]、淀粉表面几何特征分析[4]等场景。目前,Image J软件在电泳图像分析中也有应用,可将蛋白条带数据进行量化,转化为光密度值,解决了肉眼观察的不确定性问题[5]。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)作为一种快速、经济、可重复的蛋白质定性、定量分析及特征鉴定的方法,已广泛应用于各种畜禽肉[6]、水产品[7]、水稻[8]、大豆[9]等农产品蛋白质的分析检测。采用条件适宜的缓冲溶液稀释提取的样品蛋白,并制备电泳样品,利用SDS-PAGE中网状结构聚丙烯酰胺凝胶所具有的分子筛效应,将不同分子量的蛋白质及其亚基进行分离,从而达到分辨蛋白质的目的。但对于一些极端条件下的样品蛋白,如高NaCl浓度的酱油发酵液、蛋白酶解液等,不能直接运用SDS-PAGE手段进行分析检测。因此,本试验对肌原纤维蛋白在不同溶液环境(蛋白质浓度、pH和NaCl浓度)条件下进行SDS-PAGE,采用Image J软件对电泳图像进行数据量化,综合光密度值指标,得到适宜的溶液环境条件范围,为极端条件下的SDS-PAGE的样品准备提供参考依据。
1 材料与方法
1.1 材料与试剂
1 500 g左右的新鲜健康草鱼(Ctenopharyngodon idellus),购于湖北省武汉市武商量贩农科城店。30 min内低温运送到实验室用于提取肌原纤维蛋白。
磷酸、盐酸、氯化钠、十二烷基硫酸钠、甲醛、冰乙酸、氯化镁、考马斯亮蓝R-250、G-250,国药集团化学试剂有限公司;过硫酸铵、30%丙烯酰胺Acr-Bis、蛋白上样液、电泳缓冲液、1.5 mol/L Tirs-HCl,武汉科瑞生物技术有限公司;Pre-stained Protein Marker,天根生化科技有限公司(11-245 kDa);EGTA,美國Biosharp公司;Tris-BASE、0.5M Tris-HCl,美国Dow Chemical公司;四甲基乙二胺(TEMED),美国MYM公司。
1.2 仪器与设备
F050A片冰机,福建雪人股份有限公司;GL-21M离心机、HI650R离心机,湖南湘仪实验仪器开发有限公司;722N可见分光光度计,上海仪电分析仪器有限公司;PB-10 Sartorius pH计,德国Sartorius公司;T18高速均质机,德国IKA公司;DYY-12型电泳仪电源、24DN制胶器、电泳槽、WD-9406型胶片观察灯,北京市六一仪器厂;Universal Hood Ⅱ凝胶拍照系统,美国Bio-Rad公司;SHA-C恒温振荡器,常州国华电器有限公司。
1.3 试验方法
1.3.1 提取肌原纤维蛋白 参照Wu等[10]的方法,取新鲜草鱼背部肌肉45 g,切碎,加入4倍体积的分离缓冲溶液(0.1 mol/L NaCl,10 mmol/L H3PO4,2 mmol/L MgCl2,1 mmol/L EGTA,pH 7.0)高速匀浆30 s后,低温离心(2 000 g,15 min,4 ℃),重复操作2次;取沉淀再用4倍体积0.1 mol/L NaCl溶液高速匀浆30 s,低温离心(2 000 g,15 min,4 ℃),重复操作1次,得到的沉淀即为肌原纤维蛋白,保存于 4 ℃冰箱,48 h内可用。蛋白质浓度采用考马斯亮蓝法[11]测定。
1.3.2 制备电泳样品 不同蛋白质浓度:采用Tris-HCl缓冲液(0.5 mol/L NaCl,pH 7.5)对肌原纤维蛋白进行稀释,获得终浓度为0.3、0.6、0.9、1.2、1.5、1.8 mg/mL的蛋白质溶液。
不同pH:采用20 mmol/L Tris-HCl缓冲液(含0.5 mol/L NaCl)调节肌原纤维蛋白浓度至1.2 mg/mL,然后采用1 mol/L NaOH、1 mol/L HCl调节pH为5.0、5.5、6.0、6.5、7.0、7.5、8.0的蛋白质溶液。
不同NaCl浓度:采用20 mmol/L Tris-HCl缓冲液(pH 7.5)对肌原纤维蛋白进行稀释,获得终浓度为1.2 mg/mL,NaCl浓度为0、0.5、1.0、1.5、2.0、2.5 mol/L的蛋白质溶液。
分别取100 μL上述蛋白质溶液置于1.5 mL的离心管,加50 μL上样液,混匀并在沸水中加热3 min,冷却至室温,即为制备的SDS-PAGE样品。将样品储存于-20 ℃冰箱,一周内进行试验。
1.3.3 电泳条件 制胶:参考Laemmli[12]的方法,采用5%的浓缩胶、12%的分离胶进行制胶。
上样:蛋白样品上样量为10 μL,Marker上样量为5 μL。
电泳:将适量电泳缓冲液加入电泳槽中,直至没过凝胶。连接电源,设定起始电压80 V,电流50 mA;待样品从浓缩胶进入分离胶后,电压调整至120 V;待凝胶中蓝色指示线完成消失,电泳结束。endprint
染色及脱色:将玻璃板上凝胶剥离,在染色液(50%甲醇+10%冰乙酸+0.1%考马斯亮蓝R-250+40%水)中振荡浸泡2 h,然后转至脱色液(50%甲醇+10%冰乙酸+40%水)中脱色30 min,再用去离子水浸泡凝胶,并每2 h更换1次去离子水,直至凝胶中电泳条带清晰。
照相:采用Universal Hood Ⅱ凝胶拍照系统进行拍照,光源选择白光,无滤光片,其余设置为自动。
1.4 凝胶电泳图的Image J软件分析
参考张美硕[13]和陈炜烨等[5]的方法,采用Image J软件对肌原纤维蛋白SDS-PAGE图进行量化分析。
2 结果与分析
2.1 分离胶浓度的影响
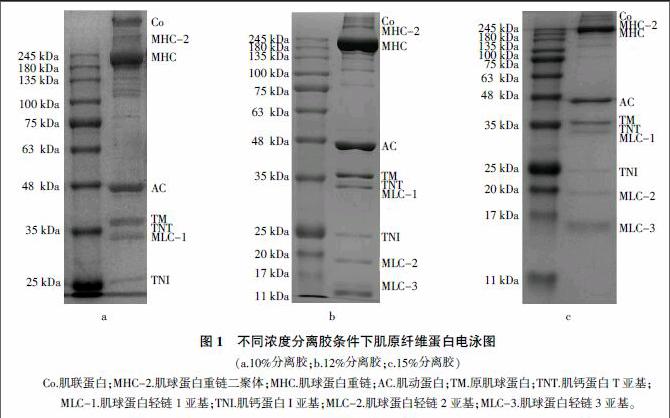
1.2 mg/mL肌原纤维蛋白溶液(20 mmol/L Tris-HCl,0.5 mol/L NaCl,pH 7.0)在不同分离胶浓度(10%、12%、15%)下的电泳图如图1所示。参考Shi等[14]和Araki等[15]的相关研究,对电泳条带所属蛋白质亚基进行标注。当分离胶浓度为10%时,标准蛋白(Marker)中分子量为11~25 kDa的蛋白条带未显示,样品中肌球蛋白轻链2亚基和3亚基(MLC-2、MLC-3)条带缺失(图1a);与此相反,分离胶浓度为15%时,尽管所有条带均可见,但样品中大分子量的肌联蛋白(Co)、肌球蛋白重链二聚体(MHC-2)、肌球蛋白重链(MHC)条带分布过于紧凑,小分子蛋白条带模糊(图1c)。12%的分离胶浓度条件下,肌原纤维蛋白分子量范围为11~245 kDa的所有条带清晰可见,且分散均匀(图1b)。
研究表明,丙烯酰胺聚合物的有效孔径随着分离胶浓度的增加而减小[16]。当分离胶浓度为7.5%时,平均孔径约为50?魡,当分离胶浓度增大至30%时,丙烯酰胺聚合物的平均孔径则减小到20?魡[17]。本试验中,当分离胶浓度为10%时,SDS-PAGE凝胶中孔径较大,在电场作用下肌原纤维蛋白分子量较小的MLC-2(18 kDa)、MLC-3(16 kDa)亚基和部分Marker条带(11、17、20 kDa)可能因无法被截留而穿透凝胶。当分离胶浓度为15%时,SDS-PAGE凝胶中孔径较小,虽然实现了MLC-2和MLC-3的分离,但是分子量较大的Co、MHC-2和MHC因迁移率最慢,被截留聚集在凝胶顶部,未得到有效分离。当分离胶浓度为12%时,肌原纤维蛋白中各蛋白质及其亚基均实现较好分离,且均匀分布于整个电泳条带。因此,后续试验中选用12%的分离胶浓度。
2.2 肌原纤维蛋白浓度的影响
不同肌原纤维蛋白浓度的SDS-PAGE如图2所示。随着蛋白质浓度的增加,MHC、AC等条带逐渐变宽,颜色也逐渐加深。当蛋白质浓度为0.3~0.6 mg/mL时,MHC、AC、TM、MLC-1、MLC-3清晰可见,但是TNT、TNI、MLC-2较为模糊,50~100 kDa范围的蛋白質没有显现。当蛋白质浓度为0.9 mg/mL时,50~100 kDa范围的蛋白质条带仍不明显。当蛋白质浓度为1.2~1.8 mg/mL时,各蛋白条带均清晰可见。
采用Image J软件对SDS-PAGE电泳图进行分析,各蛋白条带光密度值见表2。结果表明,检测到17组蛋白条带,随着蛋白质浓度的增加,各蛋白条带光密度值也逐渐增大。当蛋白质浓度为0.3~0.9 mg/mL时,只检测到12组,在50~100 kDa范围内的蛋白条带与凝胶基色差异不明显,未被软件识别。当蛋白质浓度为1.2~1.8 mg/mL时,肌原纤维蛋白中各蛋白条带光密度值均能清晰识别。但随着蛋白质浓度的进一步增加,肌原纤维蛋白中主要蛋白如MHC、AC等条带光密度值变化不明显。因此,蛋白质浓度为1.2~1.8 mg/mL时均能得到较好试验结果,但从实际操作角度考虑,最佳蛋白质浓度为1.2 mg/mL。
2.3 pH的影响
不同pH条件下的肌原纤维蛋白SDS-PAGE如图3所示。结果表明,缓冲溶液pH对肌原纤维蛋白SDS-PAGE影响不明显。pH在5.0~8.0范围内变化时,肌原纤维蛋白中各蛋白及其亚基条带分布均匀、清晰可见。
Image J软件分析结果见表3。共检测到17组蛋白条带,与蛋白质浓度的Image J检测结果一致。随着缓冲溶液pH的变化,肌原纤维蛋白中主要蛋白如MHC、AC等条带光密度值呈先下降后上升趋势,在pH为6.5和7.0时最小,在pH为7.5时最大。因此,缓冲溶液pH在5.0~8.0范围内均能得到较好试验结果,缓冲溶液pH为7.5时最佳。
2.4 NaCl浓度的影响
不同NaCl浓度条件下的肌原纤维蛋白SDS-PAGE如图4所示。当NaCl浓度为0时,肌原纤维蛋白条带整体色浅不易见,且有部分蛋白条带缺失,如TNT。当NaCl浓度为1.0~2.5 mol/L时,随着NaCl浓度的增加,肌原纤维蛋白中主要蛋白MHC、AC、TM等条带逐渐变窄,颜色变浅;大分子量的Co、MHC-2等条带逐渐丢失;小分子量的TM、TNT、TNI、MLC-1、MLC-2、MLC-3条带变化不大。只有当离子强度为0.5 mol/L时,肌原纤维蛋白中各蛋白质及其亚基均清晰可见,效果最优。
Image J软件分析结果见表4。当NaCl浓度为0时,肌原纤维蛋白中主要蛋白MHC、AC、TM等条带光密度值远低于NaCl浓度为0.5 mol/L时。这是因为肌原纤维蛋白为盐溶蛋白,在NaCl浓度为0时,蛋白质溶解度较低,只有少部分蛋白被溶解,使得制备的电泳样品中蛋白质浓度低于1.2 mg/mL。当NaCl浓度由0.5 mol/L增加至1.0 mol/L时,肌原纤维蛋白中肌球蛋白亚基(MHC、MLC-1、MLC-2、MLC-3)、肌钙蛋白亚基(TNT、TNI)、AC、TM条带的光密度值均有不同程度增大,表明这些蛋白在NaCl浓度为1.0 mol/L时具有较高的溶解性;大分子量的MHC-2亚基和180 kDa的未知蛋白电泳条带的光密度值明显减小,Co条带消失不见;分子量在35~180 kDa时,蛋白条带的光密度值维持不变。当NaCl浓度大于1.0 mol/L时,随NaCl浓度的增加,肌原纤维蛋白质所有蛋白及其亚基的光密度值均明显减小,甚至消失。因此,NaCl浓度为0.5 mol/L时,所有蛋白条带都能得到最优显示。endprint
3 結论
肌原纤维蛋白中复杂的蛋白质包含多种蛋白质,分子质量在16~480 kDa。分离胶浓度会影响蛋白的迁移率,浓度为12%时肌原纤维蛋白中各蛋白质及其亚基实现较好分离。
综合肉眼观察和Image J软件分析,确定了肌原纤维蛋白的SDS-PAGE最佳环境条件为蛋白质浓度1.2 mg/mL、pH 7.5、NaCl浓度0.5 mol/L。对于高NaCl浓度的酱油发酵液、蛋白酶解液等极端样品,在制备电泳样品时需进行脱盐、稀释等处理,以降低NaCl浓度。Image J将肌原纤维蛋白中各蛋白及其亚基条带转化为光密度值,解决了肉眼观察的不确定性,提高了准确性,能有效地应用于SDS-PAGE图像分析。
参考文献:
[1] 戴志聪,杜道林,司春灿,等.用扫描仪及Image J软件精确测量叶片形态数量特征的方法[J].广西植物,2009(3):342-347.
[2] 朱骥飞,张 立,徐 涛,等.基于Image J软件的硬质合金显微组织参数化定量分析[J].粉末冶金材料科学与工程,2015(1):26-31.
[3] 冯爱芬,张永久.应用Image J软件进行图像处理统计织物孔隙率[J].针织工业,2015(1):9-11.
[4] 刘 智,王玲玲,周卫东,等.用Image J分析水稻胚乳淀粉粒表面几何特征的方法[J].电子显微学报,2011(s1):466-471.
[5] 陈炜烨,刘冬冬,徐建华,等.Image J软件在重组质粒pET32a-CDK2中蛋白表达的应用[J].中国热带医学,2014,14(1):23-25.
[6] 董佩谕,孙京新,徐幸莲,等.SDS-PAGE法检测动物肌肉蛋白质加热终点温度的研究[J].食品工业科技,2011,32(11):65-67,71.
[7] 刘顺湖,王瑞韬.五种深海鱼提取蛋白的SDS-PAGE分析[J].济宁学院学报,2014,35(3):43-45.
[8] 李 鹏.应用盐溶蛋白SDS-PAGE技术鉴定杂交水稻种子纯度的研究[D].福州:福建农林大学,2007.
[9] 王显生,麻 浩,向世鹏,等.不同SDS-PAGE分离胶浓度条件下大豆贮藏蛋白亚基的分辨效果[J].中国油料作物学报,2004(2):76-81.
[10] WU M G,XIONG Y L,CHEN J. Rheology and microstructure of myofibrillar protein-plant lipid composite gels:Effect of emulsion droplet size and membrane type[J].Journal of Food Engineering,2011,106(4):318-324.
[11] 李 娟,张耀庭,曾 伟,等.应用考马斯亮蓝法测定总蛋白含量[J].中国生物制品学杂志,2000(2):118-120.
[12] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970, 227(5259):680-685.
[13] 张美硕.高产碱性蛋白酶基因工程菌构建、表达与其粗酶微胶囊化研究[D].长春:吉林大学,2016.
[14] SHI L,BEAMER S K,YIN T,et al. Mass balance for isoelectric solubilization/precipitation of carp,chicken,menhaden,and krill[J].LWT-Food Science and Technology,2017,81:26-34.
[15] ARAKI H,SEKI N. Comparison of reactivity of transglutaminase to various fish actomyosins[J].Nihon-suisan-gakkai-shi, 2008,59(4):711-716.
[16] HJERTEN S.“Molecular sieve” chromatography on polyacrylamide gels,prepared according to a simplified method[J].Archives of Biochemistry & Biophysics,1962,1(3):147-151.
[17] ORNSTEIN L. Disc electrophoresis-1. Background and theory in Gel Electrophoresis[J].Annals of the New York Academy of Sciences,1964,121:321-349.endprint
