白及组织培养的建立与快速繁殖研究
2018-01-27陈巧玲杨国才程群高剑华徐怡
陈巧玲+杨国才+程群+高剑华+徐怡
摘要:以白及(Bletilla Reichb.f.)种子为外植体,通过不同的培养基进行愈伤组织诱导培养与继代生根培养,研究白及种子快速繁殖的最优培养基配方。结果表明,愈伤组织诱导培养最佳培养基组合为液体培养基1/2 MS+1.5 mg/L 6-BA+6.0 mg/L IAA+pH 8.2;在植物生长调节剂6-BA与NAA愈伤组织液体诱导培养中以1/2 MS+4 mg/L 6-BA+0.2 mg/L NAA+pH 5.8最佳;MS+pH 5.8培养基对生根较好,1/2 MS+pH 5.8对丛生芽的增殖较好;试验为白及建立植株繁殖体系提供了科学依据。
关键词:白及(Bletilla Reichb.f.); 种子;组织培养;快速繁殖;培养基配方
中圖分类号:S567.23+9.1 文献标识码:A 文章编号:0439-8114(2017)24-4807-04
白及属(Bletilla Reichb.f.)为兰科(Orchidaceae)多年生草本植物,地下部分具肥厚的肉质根状茎或假鳞茎;作为中药材有3个种,分别是华白及[B.sinensis(Rolfe)Schltr.]、黄花白及(B.ochracea Schltr.)和小白及[B. formosana(Hayata)Schltr.][1,2]。白及假鳞茎含白及胶质(白及甘露糖)黏液(约55%),还含淀粉挥发油等成分[3]。可用于痈疽疮肿、跌打损伤、刀箭创伤及烫火伤治疗,能生肌止痛,具美容作用,治面部痤疮、除疥廯、止肺部出血等[4]。其不仅具有医药用途,同时也有极高的观赏价值。白及在每年的9-10月蒴果由淡黄到褐色而成熟,然后破裂,散出种子;但白及的种子在自然环境中几乎不萌发,可能与种子发育不完整有关。目前白及的栽培主要采用分株繁殖方式,繁殖系数低,生长周期较长,不宜进行大规模的商业化生产。随着植物组织培养技术的发展,白及的试管繁殖已成为可能。已经有选用白及种子进行无菌播种、初代培养、继代培养、壮苗培养、生根培养、移栽培养的报道[5],还进行了白及共生菌的分离、初步鉴定和伴生菌研究,这为建立完善的白及快繁体系奠定了技术基础,对扩大白及栽培规模、满足市场需求以及保护野生资源[6]都具有重要意义。有学者已在白及组织培养方面进行了实践,如曾宋君等[7]做了白及无菌播种及试管苗茎尖组织培养;田英翠等[8]进行了白及组织培养快繁技术研究;石云平等[9]以白及侧芽为外植体,进行白及组织培养快速繁殖技术研究,为人工栽培提供了大量种苗;余朝秀等[10]认为炼苗基质以60%腐叶土+30%珍珠岩+10%素红土为佳,炼苗温度23~27 ℃,空气相对湿度在80%~90%有利于提高炼苗成活率。试验采用未成熟的白及蒴果进行无菌播种培养和试管苗的组织培养,着重研究并筛选白及组织培养的最佳培养基配方及培养程序,旨在建立无性繁殖体系,探索脱毒白及生产快速繁殖技术,这不但能在短期内获得大量的无病毒种苗满足市场需求,而且通过放养有利于白及野生资源的保护。
1 材料与方法
1.1 材料
白及种子以及植物生长调节剂NAA、6-BA、IAA由恩施州农业科学院实验室提供;选取白及种子作为外植体,流水冲洗2 h后用滤纸吸干水分,在超净工作台上用75%酒精浸泡30 s左右,然后用0.1%的升汞振荡消毒3 min,去离子水清洗5次,再接种到培养基中。
1.2 方法
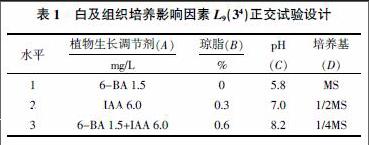
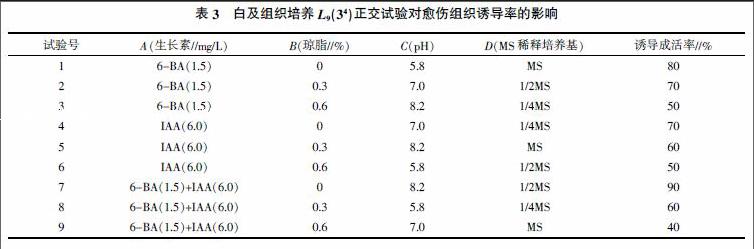
1.2.1 外植体诱导愈伤组织正交试验 以白及种子为试验材料,选用MS培养基为基础培养基,MS培养基母液的配制及保存参考文献[11]的方法。以植物生长调节剂、琼脂、pH和MS稀释倍数4因子、3水平设计L9(34)正交试验,具体见表1。每个处理10次重复, 培养条件为温度25 ℃、光照度1 500~2 500 1x、每天光照24 h。通过以上处理诱导出愈伤组织后,进行下一步继代培养及丛生芽增殖培养。
1.2.2 继代与生根培养 愈伤组织继代与生根培养采用4组培养基,各组培养基配方如下:Ⅰ组固体培养基、液体培养基为MS+pH 5.8;Ⅱ组固体培养基为MS+0.5 mg/L NAA+pH 5.8;Ⅲ组固体培养基为1/2 MS+0.5 mg/L NAA+pH 5.8;Ⅳ组固体培养基、液体培养基为1/2 MS+pH 5.8。每组10次重复,比较各组对白及愈伤组织继代与生根培养的影响。
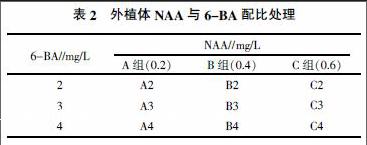
1.2.3 增殖培养 对继代与生根培养出来的外植体通过诱导培养基分别增殖培养,使已分化的外植体再次脱分化,诱导出更多的丛生芽。以1/2 MS (pH 5.8)为基础培养基,添加不同组合的6-BA、NAA,各处理组合见表2,每处理10个重复。比较不同植物生长调节剂对丛生芽增殖的影响。
2 结果与分析
2.1 愈伤组织诱导培养
L9(34)正交试验结果见表3。从表3中可以看出,白及愈伤组织生长状况与琼脂数量关系密切,在琼脂为0的处理中,愈伤组织诱导成活率较高,其次是与MS培养基稀释倍数相关。在琼脂为0(即液体培养基)的处理1、处理4、处理7这3个处理中,愈伤组织诱导成活率分别为80%、70%、90%,均处于较高水平;从表3中还可以看出,1/2MS培养基的处理(处理2、处理6、处理7)其愈伤组织具有较高的诱导成活率,分别为70%、50%、90%。最佳的为处理7,即1/2 MS+6.0 mg/L IAA+1.5 mg/L 6-BA+0 g琼脂+pH 8.2,其诱导成活率为90%。
2.2 继代与生根培养
白及愈伤组织继代与生根培养的试验结果分别见图1、图2、图3、图4。对继代与生根培养的Ⅰ组与Ⅱ组、Ⅲ组与Ⅳ组生长情况进行单一比较,以及Ⅰ组、Ⅱ组与Ⅲ组、Ⅳ组两两之间进行生长情况比较,结果见表4。从图1、图2、图3、图4、表4可知,在Ⅱ组、Ⅲ组中加入了0.5 mg/L NAA 后,根的产生极少,说明NAA对根的生长具有抑制作用,且对外植体的伸长生长也有抑制作用;1/2 MS培养基培养利于白及外植体不定芽的形成,进而可形成其他器官[12];MS利于白及外植体根及地上部分的形成。endprint
2.3 植物生长调节剂对增殖培养的影响
植物生长调节剂诱导白及丛生芽增殖的情况见图5。由图5可以看出,生长最佳的是A2组、A4组、C4组,其培养基组成分别为1/2 MS+2 mg/L 6-BA+0.2 mg/L NAA+pH 5.8、1/2 MS+4 mg/L 6-BA+0.2 mg/L NAA+pH 5.8、1/2 MS+4 mg/L 6-BA+0.6 mg/L NAA+pH 5.8;以A4组的丛生芽增殖成活率最高,达85%。从图5还可见,由A2组至B3组丛生芽的增殖成活率是递减的,而从B3组至A4组则呈现出递增的变化趋势,随着6-BA、NAA单因素各浓度的增加,丛生芽增殖成活率有增有减。说明低浓度的6-BA、NAA与高浓度的6-BA、NAA均有利于丛生芽进一步向茎叶方向的分化,这可能跟低浓度的植物生长调节剂有利于植株的生长、高浓度的植物生长调节剂会导致植株死亡有关[13]。
3 小結与讨论
3.1 种子组织培养与种子萌发优劣比较
本次试验培养出来的白及幼苗采用的种子也许会有种子本身萌发潜力[14]的干扰,为此,将其与种子萌发做一比较。首先,种子萌发注重种子的完整性,种子的结构不完整以及生理准备物质不足将使繁殖系数极低,影响整个植株的生长潜力。而采用组织培养不但可以避免这方面的不利,并且可以通过重复使诱导出来的愈伤组织建立起量大的繁殖体系,这就大大提高了繁殖系数。其次,自然状态下,白及种子极小,加之会遇到恶劣的自然环境,用种子很难繁殖出新的植株;而组织培养可在室内进行大量繁殖,通过炼苗,提高了植株对外界不良环境的抵御能力。
3.2 琼脂浓度与白及愈伤组织形成及发育的关系
培养过程中发现,在琼脂浓度相对较低的培养瓶中外植体容易形成比较好的愈伤组织,愈伤组织膨大、团状;在琼脂浓度相对较高的培养瓶里愈伤组织相对较小。这一现象的原因可能是:第一,在一定营养成分浓度的培养环境中,有利于愈伤组织的形成,不管是何种成分,只要浓度达到,产生有利于愈伤组织形成的膨压(位置效应)[15],就能诱导愈伤组织的形成;第二,跟琼脂本身一定浓度的成分相关,琼脂中的某些成分在其浓度较低时,促进愈伤组织的形成,从而诱导细胞分裂;第三,培养基的凝胶状态模拟了细胞的内环境,利于细胞的分裂、分化。
3.3 外植体成活率随着培养时间的延长而递减
外植体随着培养时间的延长,成活率呈递减趋势,其原因有二:一是外植体本身具有一定的营养物质,培养于另一培养基里时,自身的营养物质或生长调节物质可维持其生长一段时间;二是培养基中的营养物质有限,外植体在增殖的过程中大量消耗营养,营养物消耗殆尽时,植株的成活率自然降低。
3.4 外植体联合现象
在少部分愈伤组织中发现,培养一段时间后,各个独立的愈伤组织出现联合生长[16]的现象,进行继代培养时,联合的愈伤组织犹如一个没分开过的整体,出现一部分长茎、一部分长根的现象。这种现象出现的可能原因:一是外植体的同源性,外植体均为同种亲本,又处于愈伤组织环境中,具有识别作用的糖蛋白相同;二是细胞间的融合作用。依据此现象可以对外植体形成的愈伤组织分开进行不同的诱导方向培养,让其一部分长茎、长叶,一部分长根,一部分依然是愈伤组织;待长出不同的器官后,在同一培养基中进行诱导融合培养,发挥愈伤组织起联合的桥梁作用。
3.5 培养基物理状态对组织培养的影响
从整个试验处理来看,当用于愈伤组织的诱导培养时,液体培养的效果明显高于固体培养;当用于继代培养时,固体培养的效果又相对较好,使植株生长健壮。原因可能是液体具有流动性,外植体吸收养分更方便、更快捷,提供了有利于细胞增殖的环境;固体利于继代培养可能是固体对外植体的分化提供了一个理想的分化环境,对外植体还具有固定作用,使细胞的分化能够稳定进行;此外,这里的固相属于凝胶状态,具有跟细胞液相似的内环境,从而使分化更容易进行。
试验通过L9(34)正交设计,筛选出最佳诱导白及种子愈伤组织的培养基配方为1/2 MS+6.0 mg/L IAA+1.5 mg/L 6-BA+0 g琼脂+pH 8.2,琼脂浓度为零即培养基的状态为液体状态;此外,在继代培养后又进行的丛生芽增殖培养中,诱导出的丛生芽生长最好的培养基配方仍为液态下的诱导培养基,其配方分别为1/2 MS+4 mg/L 6-BA+0.2 mg/L NAA+ pH 5.8、1/2 MS+2 mg/L 6-BA+0.2 mg/L NAA+pH 5.8、1/2 MS+4 mg/L 6-BA+0.6 mg/L NAA+pH 5.8,它们均有利于白及种子愈伤组织形成后的丛生芽增殖,说明NAA与6-BA不同浓度的配比对白及种子愈伤组织的诱导成活率和丛生芽增殖存在着协同效应。MS+pH 5.8培养基对生根作用较好,1/2 MS+pH 5.8对丛生芽的增殖效果较好。NAA属于生长素类,生长素对器官建成的作用最明显的表现是在促进根原基形成及生长上,所以NAA在对根的诱导培养中具有促进生根作用。
参考文献:
[1] 中国科学院昆明植物研究所.云南植物志第十四卷种子植物[M].北京:科学出版社,2003.
[2] 曹春林.中药鉴定学[M].上海:上海科学技术出版社,1986.139.
[3] 谢宗万.全国中草药汇编上册[M].第二版.北京:人民卫生出版社,1996.285-286.
[4] [明]李时珍,著.俞小平,黄志杰,译.本草纲目精译[M].北京:科学出版社,1992.
[5] 韦卡娅,刘燕琴,秦 静,等.白及组培外植体的筛选研究[J].中国现代中药,2008,5(10):13-14.
[6] 郭巧生.药用植物栽培学[M].北京.高等教育出版社,2006.
[7] 曾宋君,黄向力,陈之林,等.白及的无菌播种和组织培养研究[J].中药材,2004,27(9):625-627.
[8] 田英翠,袁雄强.白芨组织培养快繁技术研究[J].江苏农业科学,2006(4):75-77.
[9] 石云平,李 锋,凌征柱.白芨组织培养与快速繁殖技术研究[J].南方农业学报,2009,40(11):1408-1410.
[10] 余朝秀,李枝林,王玉英.野生白芨组培快繁技术研究[J].西南农业大学学报(自然科学版),2005,27(5):601-604.
[11] 钱子刚.药用植物组织培养[M].北京:中国中医药出版社,2007.
[12] 黄宗戴.植物组织培养及其在生物技术上的应用[M].北京:科学出版社,1983.162.
[13] 李合生.现代植物生理学[M].第二版.北京:高等教育出版社, 2006.
[14] 张建霞,付志惠,李洪林,等.白芨胚发育与种子萌发的关系[J].亚热带植物科学,2005,34(4):32-35.
[15] 龙春林,程治英,王 俐,等.兰州百合器官离体培养外植体位置效应观察[J].云南植物研究,2004,26(2):221-225.
[16] 肖尊安.植物生物技术[M].北京:化学工业出版社,2005.endprint
