放线菌WS—24926产生的刀豆霉素分离纯化及含量测定
2018-01-27张亚妮王开梅张志刚王燕杨自文万中义
张亚妮+王开梅+张志刚+王燕+杨自文+万中义

摘要:从武汉地区土壤中分离到一株放线菌WS-24926,其发酵提取物具有较强的抑制真菌作用。以放线菌菌株WS-24926發酵提取物中的活性代谢产物为目的,应用高效制备液相色谱经过两次分离纯化,得到6个化合物。根据紫外吸收光谱、分子离子峰、物理性状及活性情况等确定组分1、组分2、组分3、组分4、组分6与刀豆霉素B、G、C、A、E较为相似。对菌丝提取物中的刀豆霉素含量进行测定,刀豆霉素B含量最高,为29.20 mg/L,刀豆霉素G含量为2.72 mg/L;刀豆霉素C的含量为0.92 mg/L;刀豆霉素A的含量为12.83 mg/L;刀豆霉素E的含量为18.67 mg/L。化合物5还未明确归属,含量较高,为28.51 mg/L。
关键词:放线菌WS-24926;抗生素;分离纯化;刀豆霉素
中图分类号:TQ450.1 文献标识码:A 文章编号:0439-8114(2017)24-4787-04
放线菌是最主要的抗生素产生菌,从微生物中分离的生理活性物质有60%以上为放线菌的次级代谢产物[1,2]。农用抗生素是微生物产生的次级代谢产物,可用于防治农业有害生物,是一类用途广泛、产业化程度很高的生物农药[3]。本研究在武汉某地土样中分离得到一株放线菌WS-24926,对WS-24926的发酵提取物进行了化学成分的分析,研究放线菌WS-24926的发酵、提取、分离纯化、初步结构确定及其提取物中活性物质的含量,现将结果报告如下。
1 材料与方法
1.1 菌株
1.1.1 抗生素产生菌 编号为WS-24926,在武汉某地的土样中分离得到,由湖北省生物农药工程研究中心保存。
1.1.2 生测指示菌 番茄灰霉菌(Botrytis cinerea)、小麦颖枯病菌(Septoria nodorum)、小麦赤霉病菌(Fusarium graminearum)、水稻纹枯病菌(Rhizoctonia solani)、水稻稻瘟病菌(Pyricularia oryzae)均为湖北省生物农药工程研究中心保存。
1.2 培养基
1.2.1 种子培养基 麦芽糖6.25 g,麦芽提取物6.25 g,酵母提取物1.00 g,磷酸二氢钾1.25 g,硫酸镁0.625 g,蛋白胨0.625 g,琼脂粉15.00 g,去离子水1 000 mL。
1.2.2 发酵培养基 葡萄糖72.00 g,蛋白胨8.00 g,酵母提取物4.00 g,磷酸二氢钾2.00 g,硫酸镁1.00 g,盐酸硫胺0.10 g,pH 6.0,去离子水1 000 mL。
1.2.3 生测培养基 采用PDA培养基,马铃薯(去皮)200 g,葡萄糖20 g,琼脂15~20 g,去离子水1 000 mL,pH 7.0。
1.3 仪器与试剂
1.3.1 仪器 BUCHI ROTAVAPOR R-200型旋转蒸发仪(瑞士);Waters 2695高效液相色谱仪(Waters 2996二级管阵列检测器,色谱工作站MasslynxV4.0);高效制备液相色谱仪(Waters 2525泵,带2767自动收集系统,Waters 2996二级管阵列检测器,色谱工作站MasslynxV4.0);液质联用仪:Waters 2695高效液相色谱系统,美国Micromass Quattro Micro?誖质谱仪(电喷雾离子源ESI),Masslynx V4.1液质联用分析软件。
1.3.2 试剂 甲醇(色谱纯,德国CNW),乙腈(色谱纯,德国CNW),去离子水(Millipore)。液质联用分析所用的高纯氮气购自武汉和远气体有限公司,纯度为99.5%。
标准品:刀豆霉素A(Concanamycin A)(纯度95%)、B(纯度95%)、C(纯度95%)、D(纯度95%)、E(纯度95%)、F(纯度95%)(自制)。
1.4 色谱条件
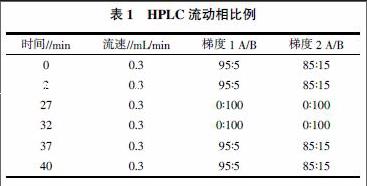
1.4.1 分析条件 色谱柱:美国SunFire Prep C18 OBD, 150 mm×2.0 mm(i.d),粒径3.5 μm;进样体积3 μL;流动相:A水,B乙腈;柱温40 ℃;流速0.3 mL/min;PDA全波长扫描。采用表1的方法进行梯度洗脱。
1.4.2 制备条件 色谱柱:美国SunFire Prep C18,OBD 250 mm×19 mm(i.d),粒径5 μm;柱温为室温;流动相:A水,B乙腈(梯度洗脱条件见表1);进样量2 000 μL;流速27 mL/min;PDA全波长扫描。
1.4.3 质谱检测条件 电喷雾电离(ESI),毛细管电压为3.5 kV,锥孔电压为45 V,离子源温度为100 ℃,脱溶剂气温度为300 ℃,脱溶剂气体流速500 L/h,锥孔气体流速为50 L/h。
1.5 试验方法
1.5.1 抗生素发酵 取低温(-20 ℃以下)保藏的WS-24926甘油管1支,在严格无菌条件下用吸管取1 mL甘油-菌丝悬浮物转入种子培养基中,在旋转式摇瓶机上28 ℃、140 r/min培养4 d后转入发酵培养基中,接种量为10%(V/V),相同条件下培养 5 d后结束发酵。
1.5.2 发酵液处理 将WS-24926发酵液用稀盐酸调pH至5.0,5 000 r/min离心10 min,将菌丝体和上清液分开。
1.5.3 活性物质的提取 用乙酸乙酯分别提取WS-24926发酵液上清液和菌丝体3次,合并3次提取液。再分别将上清液提取液和菌丝提取液减压浓缩至干,用适量体积色谱级甲醇溶解、离心,备用。
1.5.4 活性物质的制备 取10 mL甲醇溶解的提取物样品进行活性物质的制备。首先,采用分析液相探索出适合活性化合物分离的流动相梯度。然后将此梯度直接放大到制备液相中,分离纯化出活性物质单组分,制备时所用色谱柱为美国SunFire Prep C18反相柱(5 μm,19 mm×250 mm),进样体积2 000 μL,柱温为室温,流速为27 mL/min。流动相为乙腈、水,采用梯度洗脱,收集有活性的组分。endprint
1.5.5 WS-24926主要活性物质的确定 将“1.5.4”分离纯化到的单组分化合物干燥,溶于色谱级甲醇中,在“1.4.3”質谱检测条件下进样,根据样品中化合物的正负离子峰、碎片离子、紫外吸收光谱鉴别样品中主要活性化合物。
1.5.6 标准溶液的配制 精密称取刀豆霉素标准品10.53 mg于10 mL容量瓶中,用色谱级甲醇溶解、定容,配成1.0 mg/mL的标准储备液,后用色谱级甲醇稀释成2-1、2-2、2-3、2-4、2-5 mg/mL系列浓度的标准溶液。将系列浓度刀豆霉素(Concanamycins)标准品溶液分别进样3 μL,在液相色谱仪上测定峰面积,用测得的峰面积与对应的标准溶液的刀豆霉素浓度绘制标准曲线。
1.5.7 WS-24926发酵提取物样品中活性物质含量的测定 取1 mL“1.5.3”样品在“1.4.1”色谱条件下进样3针,根据其平均峰面积,采用外标法对样品进行定量分析,计算其含量。
2 结果与分析
2.1 WS-24926发酵提取物的活性测定
结果(表2)表明,WS-24926发酵提取物对番茄灰霉菌、小麦颖枯病菌、小麦赤霉病菌、水稻纹枯病菌均具有较强的抑制作用,对水稻稻瘟病菌具有一定的抑制作用。
2.2 放线菌WS-24926产生的活性物质的分离纯化
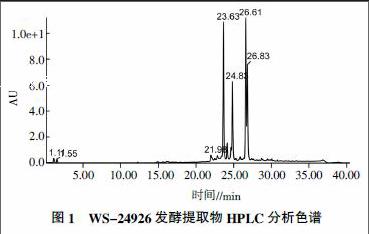
检测结果(图1)表明,在22~27 min保留时间段集中了峰23.63、24.12、24.71、24.83、26.61、26.83这6个较大峰,这些峰的紫外最大吸收值均为245、285 nm;可能为类似物或者同系物,属于中等偏弱极性化合物。峰24.71、24.83、26.61和26.83这4个组分的分离度较小,因此先采用梯度1条件收集到4个样品组分。然后根据梯度1的保留时间段流动相配比,设计出梯度2[4,5],将梯度1条件下收集到的组分再进一步分离纯化,得到6个单一组分的化合物。
2.3 放线菌WS-24926发酵提取物中的各组分LC-MS归属
对6个化合物进行LC-MS质谱分析(表3),明确其中5个化合物的分子质量分别为851.9(组分1)、660.6(组分2)、823.0(组分3)、866.0(组分4)、837.0(组分6)。组分5分子离子峰不明显,还需要核磁进一步明确。组分1的最大紫外吸收值为244、285 nm;组分2的最大紫外吸收值是228、284 nm;组分3、组分4的最大紫外吸收值均为243、284 nm;组分5的最大紫外吸收值均为236、284 nm;组分6的最大紫外吸收值为241、283 nm;6个组分在甲醇中均为白色晶体。对比这些化合物的分子质量、紫外吸收光谱、物理性状、来源及生物活性,查询天然产物化合物词典(DNP)和文献[6],可确定此5种化合物为刀豆霉素B(组分1)、G(组分2)、C(组分3)、A(组分4)、E(组分6)。表明刀豆霉素是由链霉菌属(Streptomyces diastatochromogenes)产生的18元大环内酯抗生素,已经分离出A~G多种组分[7-9]。
2.4 刀豆霉素HPLC分析方法的确定
对色谱柱、流动性组成、流动相配比进行对比筛选,确定分析条件。检测波长为243、285 nm。刀豆霉素的保留时间在22~27 min,峰形尖锐、对称,无拖尾现象(图2)。
2.5 HPLC分析方法的线性相关测定及发酵提取物中刀豆霉素的含量测定
在上述确定的色谱条件下进行相同体积的进样,以浓度为横坐标,峰面积为纵坐标作图,刀豆霉素的浓度在0.031 25~1.000 00 mg/mL,有较好的线性相关性,线性方程如表4所示。分别取1 mL甲醇溶解的菌丝及上清液的提取物样品进行活性物质的含量测定,将活性组分的峰面积带入方程中,采用外标法计算活性物质的含量,结果见表4。由表4可知,刀豆霉素主要分布在菌丝中,菌丝提取物总含量为92.85 mg/L,上清液提取物总含量仅有2.66 mg/L。因上清液在提取过程中具有较大的体积,需要用较多的乙酸乙酯进行提取,较为费时费力,且相比菌丝提取物,上清液提取物中分布的刀豆霉素含量较低,所以上清液可以不再进行提取。在菌丝提取物中,刀豆霉素B含量最高,为29.20 mg/L,刀豆霉素G含量为2.72 mg/L;刀豆霉素C的含量为0.92 mg/L;刀豆霉素A的含量为12.83 mg/L;刀豆霉素E的含量为18.67 mg/L。化合物5还未明确归属,但含量较高,为28.51 mg/L。
3 小结与讨论
1)从WS-24926的发酵提取物中分离得到的6个组分,组分1、组分2、组分3、组分4、组分6与化合物刀豆霉素相似,具有较强抗真菌作用。刀豆霉素由链霉菌属产生的18元大环内酯抗生素,已经分离出A~G多种组分。具有抗病毒、免疫制剂、细胞毒等活性,是V型ATP酶的特异性抑制剂,是生化研究的重要工具[10-13],研究多集中于医用价值上。由于该提取物具有较强的抗真菌活性,在农业生物防治方面具有一定的应用价值。
2)建立的HPLC分析方法及分离纯化方法,能较好地将WS-24926提取物中的活性组分刀豆霉素分离纯化。同时,通过此方法可对WS-24926提取物中的6种刀豆霉素进行含量测定。刀豆霉素主要分布在菌丝提取物中,刀豆霉素B含量最高,为29.20 mg/L;刀豆霉素G含量为2.72 mg/L;刀豆霉素C的含量为0.92 mg/L;刀豆霉素A的含量为12.83 mg/L;刀豆霉素E的含量为18.67 mg/L。化合物5还没有明确归属,但含量较高,为28.51 mg/L。本方法操作简便、准确、快速、成本低,可为其在农业生物防治上的研究提供一定的理论基础。
参考文献:
[1] 张一宾.由植物中放线菌产生的植物生理活性物质[J].世界农药,2003,25(1):9-12.endprint
[2] 安德榮.生物制药的原理及方法-抗菌素的制备[M].北京:中国科学文化出版社,2002.
[3] 朱昌雄,蒋细良,姬军红,等.我国生物农药的研究进展及对未来发展建议[J].现代化工,2003,23(7):1-4.
[4] 刘国诠,余兆楼.色谱柱技术[M].第二版.北京:化学工业出版社,2006.
[5] 张亚妮,万中义,张志刚,等.真菌SF-21483产生的活性物质分离纯化及初步确认[J].湖北农业科学,2015,54(17):2088-4191.
[6] 张致平,姚天爵.抗生素与微生物产生的生物活性物质[M].北京:化学工业出版社,2005.
[7] KINASHI H,SOMENO K,SAKAGUCHI K. Isolation and characterization of concanamycins A,B and C[J].Antibiotics,1984, 37:1333-1343.
[8] WESTLEY J W,LIU C M,SELLO L H,et al. The structure and absolute configuration of the 18-membered macrolide lactone antibiotic X-4357B(concanamycin A)[J].Antibiotics,1984, 37:1738-1740.
[9] WOO J T,SHINOHARA C,SAKAI K,et al. Isolation, characterization and biological activities of concanamycins as inhibitors of lysosomal acidification[J].Antibiotics,1992,45:1108-1116.
[10] MUROI M,SHIRAGAMI N,NAGAO K,et al. Folimycin (concanamycin A),a specific inhibitor of V-ATPase, blocks intracellular translocation of the glycoprotein of vesicular stomatitis virus before arrival to the Golgi apparatus[J].Cell Structure and Function,1993,18(3):139-149.
[11] WOO J T,SHINOHARA C,SAKAI K,et al. Inhibition of the acidification of endosomes and lysosomes by the antibiotic concanamycin B in macrophage J774[J].View issue TOC,1992, 207(1):383-389.
[12] MUROI M,TAKASU A,YAMASAKI M,et al. Folimycin (concanamycin A),an inhibitor of V-type H+-ATPase,blocks cell-surface expression of virus-envelope glycoproteins[J]. Biochemical and Biophysical Research Communications,1993, 193(3):999-1005.
[13] ITO K,KOBAYASHI T,MORIYAMA Y,et al. Concanamycin B inhibits the expression of newly-synthesized MHC class II molecules on the cell surface[J].Antibiotics,1995,48:488-494.endprint
