土一水界面磷的稳定性与生物有效性对水体富营养化的影响
2018-01-24金晶高扬王洋李艳华齐长青洪慧兰罗彬郑中华
金晶 高扬 王洋 李艳华 齐长青 洪慧兰 罗彬 郑中华


摘要:指出了磷(P)作为生物地球化学循环的关键生源要素之一,其在生态系统中的稳定性和生物有效性与土壤生产力和水体富营养化密切相关。系统阐述了P在自然界中的形态与环境行为,分析了P在土壤中的稳定性及迁移转化,并重点探讨了土壤pH值、外源性C输入及酸沉降对土壤P稳定性的影响;同时进一步研究了进入水体中P的稳定性和生物有效性,阐明了生物可利用P、溶解态磷酸酶在水体富营养化中的作用。并对我国现阶段P水体富营养化标准及分析方法提出了展望,未来应加强水体生物可利用P标准以及湿地生态系统P循环的研究,进一步提高森林土壤的供P潜力。
关键词:磷;生物可利用磷;生物地球化学循环;磷酸酶;水体富营养化
中图分类号:X522
文献标识码:A
文章编号:1674-9944(2018)4-0060-06
1 引言
土壤侵蚀导致P的流失和土壤生产力下降,并且随地表径流汇人各种水体,是控制浮游植物和藻类生长以及水体富营养化的关键因子[1-4]。自然界中P主要以PO3- 4的三价形态被大量固定在土壤中且移动性能差,而植物从土壤中吸收的P主要是初级磷酸(H2P04)和次级磷酸(HPO2- 4)的形态,因此土壤中普遍缺少植物可利用的P[5,6]。提高土壤无机态P的生物可利用性,需要提高矿物态P的活化作用,增强吸附态P的交换解吸以及增加水溶态P的含量才能充分发挥土壤自身供P潜力。有机形态P在土壤中的含量变幅比较大,主要是一些植物和微生物残骸、核酸类及磷脂类的有机态P。有机态P主要通过矿化作用以及植物根系作用转化为可供植物利用的无机态P。P在土壤中的生物可利用性和环境行为对土壤生产力的发展起着关键限制作用。P在土壤中的化学行为主要是吸附和解吸以及沉淀和溶解。
目前国内外对P在水一土界面的迁移转化途径、影响机制及其水环境效应都作了大量报道[2,3,7~12],但对生态系统P稳定性与生物可利用性及其对水体富营养化的影响尚未有系统地报道。因此,笔者基于长期对P的生物地球化学循环研究,探讨P在生态系统中的稳定性及其生物有效性,系统地理解P控制水体富营养化的关键因素,展望我国P生物地球化学循环需进一步加强的研究,为控制P水体富营养化提供新思路。
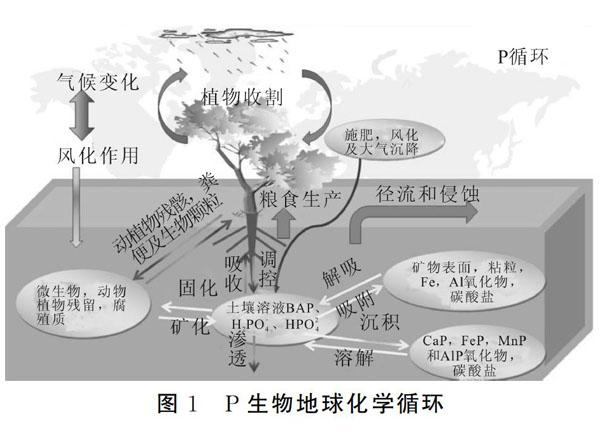
2 P生物地球化学循环
如图1所示,P在土壤中的吸附是以静电吸引为机制的阴离子交换吸附和配位体交换为机理的专性吸附,而沉淀则是与铁、铝、钙或与重金属元素形成磷酸盐沉淀,其反向过程则为P的释放过程(包括解吸和溶解)(反应式1和2)[13,14]。
式(1)为配位体交换反应,式(2)为磷酸钙化合物的溶解。大量的阴离子进入土壤中会大大降低土壤对磷酸根的吸附,增加土壤对P的解吸,而土壤中的酸性离子增加会导致磷酸盐沉淀发生酸溶作用,释放出无机态的P[15,16]。土壤中有机形态P的含量较低,是一些植物类、核酸类及磷脂类的有机P,主要通过矿化分解成植物吸收所需要的H2 P04、HPO24i以及溶解态P。P主要以颗粒态形式迁移,进入受纳水体沉积下来后,成为水体中P的潜在补给源;但农业土壤P的大量流失,会加速附近水体富营养化的产生[17]。除此之外,极少一部分P会通过大气沉降方式进入土壤和水体,改变生态系统P生物地球化学循环[18,19];动物粪便、森林凋落物、农田施肥、农户缺乏处理的化粪池、畜禽废弃物、生活污水等也会对P生物地球化學循环产生影响。
2.1 土壤介质中P的稳定性与生物有效性
P在土壤中的稳定性主要指土壤对P的吸附一解吸、矿化作用和固定过程发生的对P的生物转化、植物根系对土壤中P的吸收以及P在土壤液相和固相之间发生的化学固定与溶解反应等[20]。土壤中P的生物有效性是指土壤中可供植物直接吸收利用的P,一般是指水溶性P,水溶性P主要为无机P,其主要通过磷酸盐矿物的溶解以及被土壤吸附固定的P的释放[21]。
2.2 P的吸附一解吸
土壤对无机磷(IP)的固持主要是以配位体形式为氧化物表面所专性吸附,并可以因外加其它多价含氧酸根或氟离子而解吸[22]。无机P的吸附量主要与无定形铁、铝有关,而与晶型铁之间无显著相关性[23]。土壤淹水状态将导致铁氧化物被还原溶解,因此被铁吸附的P溶解性将增加;同时,土壤中P增加将减少S的吸附,而在sol4固持能力高的土壤中,SO2- 4的存在会减少磷酸根的吸附,亚硒酸根、砷酸根因为与P和S竞争土壤中的吸附点而加速吸附的P解吸[24~27]。Moharami和Jalall[15]研究中发现当土壤中有效P含量达到一定程度时就会发生土壤P的淋溶作用;王建林和陈家坊[13]也证实了砖红壤和高岭石中P解吸过程中的临界浓度分别为12.5μg/mL和4.85 μg/mL。
2.3 P的转化
土壤P的转化有四个过程:有机磷酸盐的矿化作用、无机P的固定作用、无机磷酸盐的溶解作用,无机磷酸盐的氧化一还原作用[28]。在石灰性土壤中的各形态无机磷中,Ca-P化合物是以Ca10 -P占绝对主导,平均占无机磷总量的70%左右[20]。对于植物根系的有效性而言,Ca2 -P的有效性要大于Ca8 -P的有效性,是土壤中潜在的缓效P源[28]。与Ca10 -P相比,Fe -P的有效性稍差,属中等偏下水平[29]。
2.4 P的迁移
土壤中的无机态P主要通过地表径流、淋溶及土壤侵蚀三种途径进行迁移[7]。多数情况下淋溶作用的P浓度很低,而随地表径流及土壤侵蚀流失是土壤中P流失的主要途径[2],土壤中的无机P大量流失会加速水体富营养化[7]。土壤溶液中的无机P是植物的主要P源,一般含量只有0.1~1 )μg/g,无机P的有效性与其在土壤固一液两相间的迁移转化密切相关[5],无机P随地表径流迁移主要影响土壤溶液中的无机P含量。随径流迁移的DP与PP间的比值决定了水体中生物可利用磷的数量及富营养化的潜能[30]。DP的有效直径<0.45μm;而PP>0.45 μm,也有<0.45 μm的,它容易被水生植物,尤其是藻类物质吸收利用,在水体中主要以正磷酸盐形式存在,部分以有机磷形式存在,当它与固体或胶体聚合在一起,也不属于DP[31]。
2.4 土壤P稳定性的影响因素
pH值是影响无机P解吸的一个重要因素,它与土壤无机P的吸附成负相关关系[32]。土壤中的正磷酸盐随着H+浓度增加逐步解离形成三种不同形式的磷酸根:H2 P04、HP02- 4和PO34,这三种磷酸根的浓度受溶液中H+的解离程度控制[33,34]。已有研究表明,低分子量的有机酸可以通过H+的酸溶作用和有机酸阴离子的络合作用活化土壤中难溶性无机P,使之转化为H。P04和HP02-4[35]。龚松贵等[36]进一步研究表明,当pH值升高时,有机酸质子浓度下降,其酸效应随之减弱;而有机酸阴离子浓度上升,其络合效应随之增强。Lento等[37]也认为有机酸活化土壤无机P的能力基本上随着酸度H+的增强而增大,酸效应的作用大于络合效应的作用。
酸沉降显著影响土壤粘粒及Fe、Al氧化物表面对无机P的固持以及微生物活动对矿物质无机P的溶解,这主要是因为酸沉降中的酸性离子在酸溶磷酸盐沉淀和活化无机P时起重要作用[38]。无机P的固定多发生在富铁铝化的酸性土壤中,因其可变电荷会对无机P产生固定作用,pH值变化明显影响着铁矿表面P的配位形式和吸附量[39]。无机P的固定还与土壤Al活性显著相关,活性Al含量越高,固定量越大,无机P在土壤中的固定导致有效性下降的实质是在吸附后进行了双核化和吸收作用[40];除Fe、Al外,Mn对无机态P的固定作用也不容忽视[41]。
P易与有机质互相吸附耦合进入生物体,P会被转化为植物和微生物难以利用的无效磷;然而,P在还原条件下更容易溶解[42]。由于P和有机质之间的竞争吸附吸附关系,有机质的减少将显著提高土壤对P的吸附;相应的增加土壤中活性铁铝的量,将提高便土壤中P的吸附数量及吸附强度[43]。
Gao等[44]研究发现:土壤壤中流中溶解性总有机碳及碳磷比(C/P)要大于地表径流,且淋溶效应显著;大量无机肥或有机肥的施用将加剧溶解性总有机碳和P在壤中的流失,这主要由于施肥增加了土壤C、P的竞争吸附或解吸过程,而有机肥对C壤中流过程的驱动力要大于P。De - Busk以及刘德燕和宋长春的研究表明:土壤中P输入与SOC的矿化速率和累积矿化量成正比,同时将加快土壤SOC的周转速率[46,47]。另外,溶解态SOC不仅是水体中微生物的重要碳源,还能改变不同形态P的可利用性,从而改变C循环、能量供给、生产量和富营养状态;相反,水体中P的增加能促进浮游植物的繁盛,增加SOC的产量[45]。
土壤微生物量C/P值可作为衡量微生物矿化土壤有机物质释放P或从环境中吸收固持P潜力的一种指标[48,49]。李春越等[50]研究表明,微生物量C/P比明显受土壤有效性P含量的影响,有效磷含量高的土壤其微生物量C/P较低;当土壤中施入无机P肥其微生物量C/P比均显著降低[51]。孟磊等[52]通过长期定位实验发现,以有机肥或以化肥形式配合施用N、P、K不但可以极大提高土壤生产力,而且有益于增加土壤SOC储量,有机肥对土壤SOC含量的提高作用显著高于化肥。土壤C、P的增加有利于促进土壤SOC、P的竞争吸附或解吸,从而提高SOC或P在土壤中的迁移[45](图2)。
3 水体中P的稳定性及生物有效性
土壤中的P迁移转化进入水体,其在水体中不同形态具有不同的环境化学行为和生物有效性,P在水体中的生物可利用性对水体富营养化过程中起着重要的作用,直接影响到水环境健康[1-3,7]。P在水体中的生物有效性通常就是指生物可利用磷(BAP),其定义主要分为两种,一种定义为可持续24 h提供缺P藻类生长利用的无机P量[53];另一种是指水体中直接可利用的P以及通过自然转化过程为藻类可直接吸收态的P[54]。本研究认为第二种定义BAP更为客观反映水体中P的生物有效性,这是因为水体中P通常需要靠水体中颗粒物(包括悬浮物和沉积物)自然解吸释放出来的内源性P来补给水生生物利用。
3.1 水体中P的迁移转化
地表水中水生植物可利用的P主要是溶解性正磷酸盐,只约占湖泊水总P的5%,而有机P占TP的25%,因此其他形态P转化为正磷酸盐的速率是决定湖泊富营养化的重要因素[55]。水体中P的迁移主要通过沉积物与水体中P的吸附与释放作用。其次,水体中微生物通过吸收和同化作用而产生的对P的生物固定以及水生植物可通過根系吸收底泥和水体中的P,并通过收割将P带出水体。当沉积物中P以可溶性无机P形式存在时,可通过扩散、沉积物再悬浮、生物扰动以及气体沸腾等方式进入上覆水体,这个过程叫做P的释放[56]。一般分为生物释放、物理释放、化学释放三种机制[57]。
水体pH值对主要影响颗粒态P以及鳌合态P的吸附解析。水体中pH值主要影响P04的存在形式,当pH值低时,P主要以HP02-4形式存在,而当pH值高时,则主要形态为H2 P04。水体中pH值升高有利于P04根离子从Fe(OH)3胶体中解吸到水体中。另外,温度升高可以减少沉积物中矿物对P的吸附,有利于沉积物释P[79]。主要由于温度升高会促进沉积物和水体中生物扰动、矿化作用和厌氧转化等过程,导致间隙水耗氧,使表层沉积物呈还原状态,加速磷酸盐的释放[57]。
3.2 BAP对水体富营养化的影响
水生生态系统中的P主要分为BAP、铁结合态P、钙结合态P、铝结合态P、沉积物有机P和碱土金属的磷酸盐。水生植物如藻类可直接利用的BAP形态为正磷酸盐(包括部分从颗粒态中释放出来弱结合态或交换态的P,但并不是所有的P形态都易于从颗粒物中释放出来,他们对水体富营养化的贡献并不相同[58,59]。另外吸附到颗粒物中水合金属氧化物上的P-般不能为生物所直接利用,如无定形的氧化铁或铝,这些P如果不解吸成生物可利用态,对水体富营养化的影响不大[59,60]。水体中的溶解态BAP是最容易被水生生物利用的,当水体中溶解态BAP不足或其浓度低到一定程度时,水生生物会通过水解、溶解态磷酸酶等生物化学反应将其它形态的P转化成可供其利用的BAP,因此P在水体中的生物可利用性一直是水体富营养化研究的热点[61]。
地表径流中的BAP是可以被藻类直接或潜在利用的P,包括溶解态的P(BDP)和颗粒态的P( BPP),其中大部分BDP可被藻类直接吸收利用,部分BPP是湖泊水库浮游生物长期可利用的潜在P源[7]。沉积物中钙结合P是较惰性的P,不易被溶解和吸附,对体中的BAP影响很小[62],而铝结合P能够被藻类等浮游植物优先吸收利用的[63]。其它碱土金属鳌合的P基本不能为水生生物利用,对水体的富营养化作用影响很小。
3.3 溶解态磷酸酶在水体富营养化中的作用
溶解态磷酸酶活性不仅能够反映水环境质量,还能够反映水环境中微生物量变化,水生生物对P的利用情况以及其水体富营养的贡献[64~66]。无机形态的小分子正磷酸盐能被水生生物直接利用[65],同时有机P的矿化分解可以使正磷酸盐得到有效补充,是生物直接利用P的另一主要途径,而磷酸酶在此过程中起着至关重要的作用[65,66]。作为调节营养循环的一个重要生物化学参数,溶解态磷酸酶的合成、分泌与稳定性反映了水体中P的营养水平,其活性的高低可以反映水体P的转化能力,进而影响水体富营养化程度[67,68]。已有研究表明,当水体中磷酸盐含量偏低时,微生物将诱使胞外碱性磷酸酶转化有机P,从而增加水体中磷酸盐的含量[69]。溶解态磷酸酶的分布往往反映了有机质的时空特征、磷含量以及水生生物对磷的需求等[70]。
溶解态磷酸酶活性的主要影响因素包括:酶的底物(以磷为主)、pH值、温度、添加剂或者螯合剂(包括:如甘氨酸、组氨酸、氯化钙、酪蛋白和甘油等)以及有机溶剂等[70]。由于溶解态磷酸酶易受环境条件影响,其功能时常变化,所以溶解态磷酸酶的活性常作为量度水生态系统磷的营养状况和生物量的指标[65,71];同时,在不同环境下的功能多样性说明溶解态磷酸酶具有独特的生态服务功能。德国Herrensee湖中由于缺少营养元素,水生生物所需的P半数以上通过是通过磷酸酶水解有机磷提供[72],而同样缺少磷元素的美国Lawrence湖中的溶解态磷酸酶活性却很低[73],德国Scholee湖中磷酸酶的相对比例却与P含量无关[74]。
周易勇等[75]对武汉东湖不同湖区的溶解态磷酸酶活性变化研究中发现,磷酸酶活性随水体深度呈现不同垂直分布规律,并且由于不同的土地利用方式及污水排放,湖区不同地点的磷酸酶活性变化规律也不同;Koch等[68]在美国佛罗里达湾研究中发现,最高碱性磷酸酶活性发生在水体含氰基细菌爆发时,是由于浮游植物的大量繁殖导致了溶解态磷酸酶活性突然增加,而此后水体中的溶解态磷酸酶活性则处于一个相对稳定的常数;Lomas等[76]则发现北大西洋Bats湖泊的碱性磷酸酶活性呈季节性变化特征并且与溶解态有机P浓度显著相关。Zablotowicz等[77]对三个湖泊的水质变化进行对比研究,发现不同土地利用方式下水体的磷酸酶活性变化与溶解态C、N及微生物变化显著相关;宋春雷等[78]则认为溶解态磷酸酶活性与磷营养水平以及叶绿素浓度相关,磷酸酶与相关的理化、生物因素的共同作用将驱动磷的释放并促进富营养化过程。从上述研究进展看,溶解态磷酸酶因其具有独特的存在方式、快速的营养转化能力和广泛的底物接触能力,在水体中营养物质的转化方面具有十分重要的生态学意义。
4 我国P研究存在的不足与展望
4.1 BAP分析方法
P生物有效性的研究始终是生态系统P生物地球化学循环的核心,解析P在生态系统内的迁移转化规律及其影响因素是P生物有效性研究的关键所在。我国目前TP是评价水体富营养化及其水质的主要指标,而实际上评价TP中不同形态的P的生物可利用性,比单一评价水体中的TP更有意义。目前针对我国的水体富营养特点和污染分布特征,至今还未提出自己的P富营养化标准和国家标准分析方法,应当尽快建立BAP的标准分析方法以及相关的BAP对水体富营养化的评价标准,提出更多P有效性的指标来评价其对水体生产力的影响。
4.2 湿地生态系统P循环
湿地P循环在整个生态系统P生物地球化学循环中起着关键纽带和调控作用,汇集了P的物理、化学、物理化学和生物化学过程,极具复杂性。湿地具有不同于河流的独特水文条件,其水文过程显著影响P的生物地球化学循环,复杂的生物地球化学反应不仅改变了湿地P的化学组成,而且影响P在湿地内迁移转化过程。干湿交替是湿地的特征之一,水位的变化影响湿地P的转化和释放。淹水后的湿地更容易释放P,因为在水位较高时,有机P不易分解;水位下降后,好氧環境促进了有机P的降解,更易导致P的淋溶释放。因此,未来明确干湿交替条件下湿地生态系统P的行为是正确调控土一水界面P稳定性和生物有效性的基础。干湿交替也显著影响着湿地中各形态P的分布特征,河水中大量P的输入以及湿地的截留作用增加了湿地中总无机磷酸盐的含量。
4.3 森林生态系统P循环
相比湿地生态系统P循环,我国森林生态系统P循环的研究更为缺乏。据估算,如果南方红壤中现存的P贮存量全部处于可利用状态且不出现损失的话,足够森林生长使用50年以上[80]。因此,提高森林土壤供P潜力是急需解决的问题。我国南方地区农业过分依赖化肥,磷肥利用率仅为15% -30%,70%以上的磷肥被土壤所固定,同时另一方面土壤酸化和暴雨导致P流失严重,土壤普遍缺P又极大限制了该地区的农林业生产。南方地区由于铁铝氧化物含量高,因此土壤中的P主要以Al- P、Fe-P和O-P的形态存在,所以能被植物直接利用的生物有效P严重偏低[81],植物生长受P的制约比较严重。
参考文献:
[1]高扬,朱波,汪涛,等,人工模拟降雨条件下紫色土坡地生物可利用磷的输出[J].中国环境科学,2008,28(6) :542~547.
[2]Gao Y,Zhu B,Zhou P,et al.Effects of vegetation cover on phosphorus loss from a hillslope cropland of purple soil under simulatedrainfall:a case study in China [J].Nutrient Cycling in Agroecosystems, 2009(13):263~273.
[3]Gao Y,Zhu B,Wang T,et al.Bioavailable phosphorus transportfrom a hillslope cropland of purple soil under natural and simulatedrainfall [J]. Environmental Monitoring and Assessment, 2010(171) :539~550.
[4]Gao Y,Zhu B,Yu GR, et al.Coupled effects of biogeochemicaland hydrological processes on C,N, and P export during extremerainfall events in a purple soil watershed in southwestern China[J]. Journal of Hydrology, 2014 (511):692~ 702.
[5]Hart M R,Quin B F,Nguyen M L.Phosphorus runoff from agricultural land and direct fertilizer effects:a review[J].J.Environ.Qual., 2004(33):1954~1972.
[6]Heathwaite A L,Dils R M. Characteristing phosphorous loss insurface and subsurface hydrological pathways[J]. Sci. Total Environ., 2005,25(1):529~538.
[7]Gao Y,Zhu B,Wang T,et al_Seasonal change of non- pointsource pollution - induced bioavailable phosphorus loss: a casestudy of Southwestern China[J].Journal of Hydrology, 2012 (420~421):373~379.
[8]張淑荣,陈利顶,傅伯杰,等.农业区非点源污染潜在危险性评价——以于桥水库流域磷流失为例[J].第四纪研究,2003, 23(3):262~269.
[9]Ekholm P,Turtola E,Gronroos J,et al_Phosphorus loss fromdifferent farming systems estimated from soil surface phosphorusbalance[J]. Agriculture, Ecosystems and Environment, 2005(110) :266~278.
[lO]Owens L B,Shipitalo M J.Surface and subsurface phosphoruslosses from fertilized pasture systems in Ohio [J].J.Environ.Qual., 2006(35):1101~1109.
[11]刘芳,沈珍瑶,刘瑞民.基于“源一汇”生态过程的长江上游农业非点源污染[J].生态学报,2009(6) :3271~3276.
[12]王珺,裴元生,杨志峰.营养盐对白洋淀草型富营养化的驱动与限制[J].中国环境科学,2010,30(增刊):7~13.
[13]王建林,陈家坊.土壤中磷的解吸[J].土壤学进展,1988(6):10~16.
[14] Hesketh N, Brookes P C.Development of an indicator for risk ofphosphorus leaching [J].J.Environ. Qual, 2000(29):105~110.
[15]Moharami S,Jalali M. Phosphorus leaching from a sandy soil inthe presence of modified and un-modified adsorbents [J]. Environmental Monitoring and Assessment. 2014, 186( 10): 6565~6576.
[16]Ouyang W, Huang,H B,Hao F H,et al. Evaluating spatial interaction of soil property with non- point source pollution at watershed scale: The phosphorus indicator in Northeast China [J].Science of the Total Environment. 2012(432):412~421.
[17]Sharma R, Bell R W, Wong M T F.Phosphorus forms in soil solution and leachate of contrasting soil profiles and their implications for P mobility [J]. Journal of Soils and Sediments, 2015 ,15(4) :854~862.
[18] Izquierdo R, Benitez - Nelson C R, Masque P, et al.Atmospheric phosphorus deposition in a near- coastal rural sitein the NE Iberian Peninsula and its role in marme productivity[J]. Atmospheric Environment, 2012 (49): 361~ 370.
[19]He J,Balasubramanian R, Burger D F,et al. Dry and wet atmospheric deposition of nitrogen and phosphorus in Singapore[J]. Atmospheric Environment, 2011(45):2760~2768.
[20]徐建明,蔣新,刘凡,等.中国土壤化学的研究与展望[J].土壤学报,2008,45(5) :817~829.
[21]向万胜,黄敏,李学垣.土壤磷素的化学组分及其植物效性[J].植物营养与肥料学报,2004,10(6) :663~670.
[22]邱亚群,甘国娟,刘伟,不同利用方式土壤中磷的吸附与解吸特性[J].环境工程学报,2013,7(7):2757~2762.
[23]Doody D, Moles R, Tunney H, et al. Impact of flow path lengthand flow rate on phosphorus loss in simulated overland flow froma humicgleysol grassland soil [J]. Sci Total Environ, 2006( 372):247~255.
[24]Kana J,Kopacek J,Camarero L,et al. Phosphate Sorption Characteristics of European Alpine Soils [J]. Soil Science Society ofAmerica Journal,2011, 75(3):862~ 870.
[25]李寿田,周健民,王火焰,等.不同土壤磷的固定特征及磷释放量和释放率的研究[J].土壤学报,2003,40(6):908~914.
[26]苏玲,林咸永,章永松,等.水稻土淹水过程中不同土层铁形态的变化及对磷吸附解吸特性的影响[J].浙江大学学报(农业与生命科学版),2001,27(2) :124~128.
[27]Hugunin-Elie O, Kikr G J D, Frossard E.Phosphorus uptakeby rice from soil that is flooded drained or flooded then drained[J]. European J Soil Sci., 2003,54(1):77~90.
[28]孙桂芳,金继运,石元亮.土壤磷素形态及其生物有效性研究进展[J].中国土壤与肥料,2011(2) :1~9.
[29]Alt F, Oelmann Y, Herold N, et al. Phosphorus partitioning ingrassland and forest soils of Germany as related to land- usetype, management intensity, and land use - related pH [J].Journal of Plant Nutrition and Soil Science, 2011, 174(2):195 ~209.
[30]刘海英,刘长海.农业系统中磷的输移及利用[J].水土保持科技情报,2004(2) :45~46.
[31] Hansen N C.The fate and transport of phosphorus in agriculturalsystems [J]. Journal of Soil and Water Conservation, 2002(6):32~33.
[32]Novak J M, Watts D W, Hunt P G, et al. Phosphorusmovement through a coastal plain soil after a decade[Jl.J.Environ. Qual., 2000(29):1310~1315.
[33]尹逊霄,华珞,张振贤,等.土壤中磷素的有效性及其循环转化机制研究[J],首都师范大学学报(自然科学版),2005, 26(3) :95~101.
[34]Radersma S,Grierson P F.Phosphorus mobilization in agroforestry: organic anions, phosphatase activity and phosphorus fraction in the thizosphere [J]. Plant and Soil, 2004(259):209~ 219.
[35]Kpomblekou A K, Tabatabai M A.Effect of low- molecularweight organic acids on phosphorus release and phytoavailabiltyof phosphorus in phosphate rocks added to soils [J]. AgricuIEcosyst Environ, 2003 (100):275~284.
[36]龚松贵,王兴祥,张桃林.低分子量有机酸对红壤无机磷活化的作用[J].土壤学报,2010,47(4):692~696.
[37]Lento J,Dillon P J,Somers K M. Evaluating long-term trendsin littoral benthic macroinvertebrate communities of lakes recovering from acid deposition [J]. Environ Monit Assess, 2012(184) :7175~7187.
[38]Moldovan C,Sbirna S,lonescu C,et al.Simulated Impact of AcidRain on Organic Matter, Phosphorus and Other Soil Components[J]. Environmental Engineering and Management Journal,2014,13(6):1389~1392.
[39]宋康,符志友,趙晓丽,等.腐殖酸对针铁矿吸附磷的影响机理[J].环境科学研究,2012(8) :904~910.
[40]鲁如坤,时正元,钱承梁,磷在土壤中有效性的衰减[J].土壤学报,2000,37(3):323~328.
[41]刘广深,许中坚,徐冬梅,酸沉降对土壤团聚体及土壤可蚀性的影响[J].水土保持通报,2001,21(4) :72~74.
[42]孙宏发,刘占波,谢安,湿地磷的生物地球化学循环及影响因素[J].内蒙古农业大学学报,2006,27(1):148~152.
[43]文亦芾,艾有群.南方红壤磷素化学研究进展和展望[J].云南农业大学学报,2005,20(4):534~538.
[44]Gao Y, Zhu B, He N P, et al.Phosphorus and carbon competitive sorption- desorption and associated non- point loss respondto natural rainfall events [J]. Journal of Hydrology, 2014( 517):447~457.
[45]Kang J H, Amoozegar A, Hesterberg D, et al.Osmond Phosphorus leaching in a sandy soil as affected by organic andinorganic fertilizer sources [J]. Geoderma, 2011(161): 194~201.
[46]刘德燕,宋长春,磷输入对湿地土壤有机碳矿化及可溶性碳组分的影响[J].中国环境科学,2008,28(9):769~774.
[47]De- Busk W F, Reddy K R.Turnover of detrital organic carbonin a nutrient-impacted everglades marsh [J]. Soil Sci. Soc. Am.J., 1998,62(5) :1460~1468.
[48]Peng P Q, ZhangW J,TongC L,et al_Soil C,N and P contentsand their relationships with soil physical properties in wetlands ofDongting Lake flood plain [J]. Chinese Journal of Applied Ecology, 2005,16(10):1872~1878.
[49]王绍强,于贵瑞.生态系统碳氮磷元素的生态化学计量学特征[J].生态学报,2008,28(8) :3937~3947.
[50]李春越,王益,Philip Brookes,等.外源碳磷的加入对农田土壤微生物碳磷比及磷素有效性的影响[J].西北农业学报,2012(11) :113 ~117.
[51]Koun0 0 K, Lukiot H P, Ando T.Minimum available N requirement or microbial biomass P formation in a regosol[J]. Soil Biology and Biochemistry, 1999 ,31(6) :797 ~802.
[52]孟磊,丁维新,蔡祖聪,等.长期定量施肥对土壤有机碳储量和土壤呼吸影响[J].地球科学进展,2005,20(6) :687~692.
[53]Songzogni W C, Chapras C, Armstrongd E, et al. Bioavailabilityof phosphorus inputs to lakes [J].J Environ Qual, 1982(11): 555 ~563.
[54]Bostrom B, Persson G, Broberg B.Bioavailability of differentphosphorus forms in freshwater systems [J]. Hydrobiologia ,1988(170) :133~155.
[55]王睿喆,王沛芳,任凌霄,等.营养盐输入对太湖水体中磷形态转化及藻类生长的影响[J].环境科学,2015,36(4) :1301~1308.
[56]Dong L M, Yang Z F,Liu X H, et al.Vertical distribution ofsediment organic phosphorus species and simulated phosphorusrelease from lake sediments[J]. Hydraulic Engineering, 2012Sree Conference,2013( 12):225 ~229.
[57]高丽,周健民,磷在富营养化湖泊沉积物一水界面的循环[J].土壤通报,2004,35(4) :512-515.
[58]Topcu A, Pulatsu S.Phosphorus Fractions and Cycling in theSediment of a Shallow Eutrophic Pond[J]. TarimBilimleriDergisi-Journal of Agricultural Sciences,2014,20(1): 63 ~70.
[59]Reynolds C S,Davies P S.Sources and bioavailability of phosphorus fractions in freshwaters:a British perspective. BiologicalReviews of the Cambridge Philosophical [J] Society, 2001, 76(1):27~64.
[60]Kerr J G,Burford M,Olley J,Udy J. Phosphorus sorption in soilsand sediments: implications for phosphate supply to a subtropicalriver in southeast Queensland [J], Australia. Biogeochemistry,2011,102(1~3):73~85.
[61]Peters R H. Phosphorus availability in LakeMemphremagog andits tributaries[J]. LimnolOceanogr, 1981(26):1150~1161.
[62]Wang S G, Jin X G, Pang Y,et al. Phosphorus fractions andphosphate sorption characteristics in relation to the sedimentcomposition of shallow lakes in the middle and lower reaches ofYangtze River region, China[J]. Journal of Colloid and InterfaceScience, 2005(289):339~346.
[63]孔明,張路,尹洪斌,等.蓝藻暴发对巢湖表层沉积物氮磷及形态分布的影响[J].中国环境科学,2014,34(5): 1285~1292.
[64]夏学惠,东野脉兴,周健民,等.滇池现代沉积物中磷的地球化学及其对环境影响[J].沉积学报,2002,20(3) :416~420.
[65]Young EB, Tucker RC, Pansch LA. Alkaline phosphatese infreshwater cladophora- epiphyte assemblages: regulation in response to phosphorus supply and location [J].J Phycol., 2010(46) :93~101.
[66]1van6i 6 I,Fuks D, Radi 6 T,et al_Phytoplankton and bacterialalkaline phosphatase activity in the northern Adriatic Sea [J].Marine Environmental Research, 2010( 69): 85 ~94.
[67]11 H, Veldhuis M J W, Post A F.Alkaline phosphatase activitiesamong planktonic communities in the northern Red Sea [J]. Marine Ecology Progress Series, 1998(173):107~115.
[68]Koch M S,Kletou D C, Tursi R.Alkaline phosphatase activityof water column fractions and seagrass in a tropical carbonate estuary. Florida Bay Estuarine[J]. Coastal and Shelf Science, 2009(83):403~413.
[69]Hoppe H G. Phosphatase activity in the sea[J]. Hydrobiologia,2003(493) :187~200
[70]宋春雷,曹秀云,李建秋,等.湖泊磷酸酶与微生物活性对内源磷负荷的贡献及其与富营养化的关系[J].中国科学(D辑),2005(35):90~100.
[71]Xu Y, Boucher J M, Morel F M M. Expression and diversity ofalkaline phsphatase EHAPl in EmilianiaHuxleyi (Prymnesiophyceae)[J].J Phycol., 2010(46) :85~92.
[72]Hantke B, Fleischer P, Dormany I,et al. P-release from DOPby phosphatase activity in comparison to P excretion by zooplankton[J]. Hydrobiologia, 1996 ,317 (2) :151~162.
[73]Wetzel R G. Longterm dissolved and particulate alkaline phosphatase activity in Hardwater lake in relation to lake stability andphosphorus enrichment [J]. Verh Internal VereinLimnol, 1981(21):369~381.
[74]Rai H, Jacobsen T R.Dissolved alkaline phosphatase activity(APA) by size fractionated plankton in Lake Schochsee[J].Verh Internal VereinLimnol, 1993(125):164~169.
[75]周易勇,李建秋,陈旭东,等.东湖溶解态磷酸酶的活性、动力学特征[J].环境科学,1997(18) :37~40.
[76]Lomas M W, Burke A L, Lomas D A, et al. Sargasso Sea phosphorus biogeochemistry: an important role for dissolved organicphosphorus (DOP)[J]. Biogeosciences, 2010(7):695~710.
[77]2ablotowicza R M, Zimba P V, Lockec M A, et al. Gordonaeffects of land management practices on water quality in Mississippi Delta oxbow lakes: Biochemical and microbiological aspects[J]. Agriculture, Ecosystems and Environment, 2010(139):214~223.
[78]宋春雷.溶解态磷酸酶与微生物活性在湖泊富营养化过程中的作用[D].北京:中国科学院,2005:18~21.
[79]王庭健,苏睿,金相灿.城市富营养湖泊沉积物中磷负荷及其释放对水质的影响[J].环境科学研究,1994,7(4) :12~19.
[80]余文煜.低分子有机酸、盐对南方红壤森林土壤磷的释放规律研究[D].福州:福建农林大学,2010.
[81]邵兴华,张建忠,毛勇,等.氧化还原条件下红壤磷吸附与解吸特性及需磷量探讨[J].土壤,2010,42(2):213~218.
