《科学》2017年度十大科学突破
2018-01-24编译姚人杰
编译 姚人杰
宇宙汇聚
2017年8月17日,全世界各地的科学家见证了一种从未被目睹过的景象:离地球1.3亿光年远的地方,两颗中子星在一次大爆炸中沿着螺旋路径撞向彼此,这次大爆炸受到伽马射线探测器、射电望远镜等各种天文观测仪器的研究。这次大爆炸证实了好几种关键的天体物理学模型,揭晓了众多重元素的一个生成地点,还前所未有地测试了广义相对论。对中子星并合的首次观测以及它所揭示的科学成果是《科学》杂志评选出的2017年度重大科学突破。
尤其值得注意的是,这次中子星并合被发现是通过探测太空本身的极微小涟漪(引力波)的方式,而这些引力波是螺旋运动的中子星在并合之前发出的。科学家最早在2015年探测到引力波,那时激光干涉引力波天文台(LIGO)检测到一场无形灾变中两个巨大黑洞螺旋并合而产生的空间颤动。引力波的发现是《科学》杂志评选出的2016年度科学突破。
假如那次观测听上去像大发现的号角声,2017年的发现就像一曲科学交响乐。二者的差别要归结到物质上。黑洞是一颗巨大恒星坍陷成一个点时残留的鬼魅的引力场。黑洞不包含物质,也就无法升温并向外辐射。对比之下,中子星是几乎纯粹由中子构成的球体,是世上最致密的东西。相撞的黑洞只发射出引力能,中子星的碰撞则会上演一场“灯光秀”,而这已经被70多家天文台研究。“我们在这一次天文学事件中所能获取的信息总量让我耳目一新。”佐治亚理工学院物理学家劳拉·卡多纳蒂(Laura Cadonati)说道,她也是LIGO团队的副发言人。

旋转的中子星发出的引力波不仅触发了位于华盛顿州汉福德和路易斯安那州利文斯顿的LIGO探测器,也触发了意大利比萨附近由法意两国合建的Virgo探测器,后者在历经5年的升级之后,正好在17天之前开始记录数据。研究者立刻知道,他们见证了两颗中子星的死亡螺旋。黑洞的并合会产生数秒长的低频引力波脉冲,质量较轻的中子星会产生更高频率的引力波脉冲,在100秒内频率和强度都会增长,从中泄露出真相。
这种越来越强的态势就像烟火一样。两秒钟之后,NASA的轨道飞行中的“费米伽马射线空间望远镜”探测到一种名叫“短伽马射线暴”的伽马射线脉冲。接着,其他望远镜瞄准了目标。因为引力波被3个相距遥远的探测器发现,所以研究者能够用三角测量法在天空中定位这对中子星的位置。11小时不到,好几支光学天文望远镜和红外天文望远镜团队已经在NGC 4993星系的边沿发现了新的信号来源。好几天里,光源从明蓝色逐渐褪至暗淡的红色。接着,在11天后,它开始发出X射线和无线电波。这次爆炸肯定是天文学历史上被研究得最多的事件,共有来自953家研究机构的3 674位研究者通力合作,以一篇论文概括了这起中子星并合事件及它的后果。
这些观测结果支持了一个25年前提出的假说,即中子星的并合会产生短伽马射线暴。而泛红的残光符合一种被称为“千新星”(Kilonova)的模型,也就是说中子星相撞使得富含中子的物质被抛入太空,发生一连串的核子相互作用(被称为γ-过程)。宇宙中一半比铁更重的元素被认为是由γ-过程产生,而最重的元素会吸收蓝光,使得发光的放射云显出红色。“看到一个过去仅仅是理论想法的东西成真让人激动万分,”加州大学伯克利分校的丹尼尔·卡森(Daniel Kasen)说道,他也是建立“千新星”模型的人,“基本上,这都是靠闭门造车的理论完成的。”观测结果甚至还支持了阿尔伯特·爱因斯坦的广义相对论,确证了引力波以光速传播,而不是像其他理论的提出者所预测的那样,以较慢的速度传播。
然而,这次并合也提出了新的谜团,刺激天体物理学家的胃口,让他们想获得更多数据。比如说,伽马射线暴非常微弱,薇姬·卡洛耶拉(Vicky Kalogera)说道,她是一位天体物理学家,也是LIGO团队成员,在位于伊利诺伊州埃文斯顿的西北大学任教。这样的射线暴被认为源自于中子星并合时以近乎光速的速度、以窄喷流形式喷射出的物质,就像探照灯的光束一样。最简单的解释是,喷流也许没有径直指向地球。然而,可能天体物理学家的模型不是相当准确,中子星并合可能只产生柔和的伽马射线暴,卡洛耶拉说道。为了解开疑问,天体物理学家需要见到更多的并合。
他们也想要见到中子星螺旋运动,互相撞上时的引力波。在首次观测中,LIGO和Virgo探测器追踪到两颗中子星绕着彼此旋转,速度越来越快,发出频率越来越高的引力波。然而,在大约每秒500周数时,引力波的频率超出了LIGO的仪器灵敏范围,探测器无法观察到导致并合的最后几圈旋转。
最后几圈旋转能够提供一窥中子星本质的机会。中子星是由纯核物质构成的球体,只不过比太阳更重一些,但是直径上多出20到30千米。天体物理学家想知道中子星的物质有多硬或多软——这个性质被概括于所谓的状态方程式中。从原理上来说,引力波能够揭示出中子星的性质:物质越硬,中子星就会越大,它们一起螺旋运动时就会越早地撕裂彼此,改变信号。“如果我们想要确定状态方程式,我们需要见到整个事件。”纽约州立大学石溪分校核天体物理学家詹姆斯·拉蒂默(James Lattimer)说道。研究者计划提高LIGO在高频区的灵敏度——比如说,通过操纵在巨大的探测器中循环的激光——但这么做也许要花上数年时间。
科学家也希望见到更多类型的天文学事件,譬如一颗中子星与一个黑洞的并合,理论暗示这类事件是稀少的。在我们的银河系里,单个恒星的超新星爆炸应该也会产生能够探测到的引力波,帮助天体物理学家弄明白恒星到底是怎么爆炸的。旋转中的中子星(被称为脉冲星)也许会持续地发送引力波。在未来10年里,科学家希望发射一台能够识别出低频波(比如星系中央的超大质量黑洞之间的并合)的天基引力波探测器。
斯坦福大学的一位理论物理学家罗杰·布兰福德(Roger Blandford)说,最激动人心的会是出现一种天体物理学家从未预测过的信号,“我十分想见到一些不符合预期的东西。”
在原子层面观察生命

一张合成的低温电子显微镜图像显示出分辨率在近年来是如何改善的
这项不寻常的创新继续增强影响力的同时,它也赢得了《科学》杂志的至高荣誉。2017年是冷冻电子显微镜(cryo-EM)大获成功的一年,这项技术允许科学家创造出复杂分子彼此相互作用时的定格图像。2017年,冷冻电子显微镜使我们窥见关键蛋白复合物的运作方式,美国国立卫生研究院在全国各地建立了冷冻电子显微镜中心网络,几位技术开拓者被授予诺贝尔化学奖。
冷冻电子显微镜使用液态乙烷来急骤冷冻水中运动的分子。研究者接着在电子显微镜下观察样本,使用计算机程序对图像分类整理,将数据整合成相干结构。不像X射线晶体学——结构生物学的标准研究方法——冷冻电子显微镜不要求目标分子结晶(这常常是个困难的任务),而且因为它能捕捉到分子在某个过程中的样子,所以它能够揭示出一些功能的线索。追根溯源的话,这项技术要追溯到几十年前,但相关仪器的改进、加速图像处理及分析的软件,还有工作中有助于减少差错的新质量标准,这些都帮助冷冻电子显微镜技术发生爆炸式的进步。
冷冻电子显微镜将接近原子级的分辨率运用到以前从未见到过的结构上,帮助解释了数十年间的生物化学和遗传学观测结果。今年,它使得研究者以全新视角看到剪接体(处理RNA的关键机器)如何运作,更清楚地看见在细胞周期中重建细胞膜的蛋白质,洞察那些修复DNA损伤的酶。这项技术也生成了阿尔茨海默症病人大脑内聚积的神经纤维缠结与形成斑块的纤丝的高分辨率模型,并显示出基因编辑的复合体CRISPR如何捕获和操纵DNA。研究者促进冷冻电子显微镜观察大大小小分子的能力,解开红藻硕大的捕光复合体和多种小型蛋白质复合体的结构,换作以前,这些已经超出了它的能力范围。
针对最害羞粒子的迷你探测器
2017年,物理学家发现,最为躲躲闪闪的亚原子粒子——中微子——以一种崭新的方式让原子核振荡。这一成果完成了40年之久的探索,而且它不需要通常用来探测中微子的庞大硬件装置。恰恰相反,研究者做出这个成绩是借助了一台便携式探测器,它的重量差不多等于一台微波炉。
中微子生成于某些核反应过程,极少与其他物质发生相互作用,于是有不计其数的中微子径直穿过地球。然而,偶尔会有一个中微子击中原子核里的中子,将它变成质子,同时它自身变成能够探测到的粒子,譬如电子。或者,中微子只会反弹走质子或中子,让原子核高速飞动。这两种相互作用都极为罕见,探测器必须包含很多吨的目标物质——物理学家已经用过许多种材料,从铁到干洗液都有——才能发现个把中微子。然而,在1974年,理论物理学家预测说,假如一个中微子的能量足够低的话,它会表现得像量子波,遇到所有原子核内的质子和中子都会立刻反射。这样的“相干散射”应该会极大地提升相互作用发生的概率,但原子核的低能反跳难以探测。

首次识别出相干中微子散射的探测器的原型
2017年,总计81个成员的COHERENT协作项目识别出长久以来寻找的相干散射。他们使用一个14.6千克重、用一大块掺钠碘化铯晶体制成的探测器,当晶体内部的原子核发生反跳时,它就会闪光。研究者将探测器暴露在橡树岭国家实验室的“散裂中子源”产生的中微子之下,“散裂中子源”的能量低得足以产生相干散射,但又高得足以产生能探测到的反跳现象。
未来某一天,这样的小型中微子探测器或许会帮助监测核反应堆,比如确保核反应堆依照防止核扩散的规章运行,或者搜索更加飘忽不定的“惰性中微子”。将相干中微子散射与不同原子核进行比较的话,物理学家也许还能以全新方式探测核结构。然而,增强后的散射也有不利方面:当物理学家试图用更加灵敏的探测器来探测出宇宙暗物质的粒子时,来自太阳的中微子的相干散射会变成一个干扰源。
智人的更早起源
来自摩洛哥一个洞穴的头颅化石长期受到忽视,却将我们种族“智人”的化石记录往前推了好多年,还在2017年激励了现代人类起源的研究。研究人员判定,这个头颅有着惊人的30万年历史,大约比埃塞俄比亚发现的化石要悠久了10万年。此前,被普遍接受的最悠久的早期智人遗骸纪录的保持者就是那些在埃塞俄比亚发现的化石。
这个头颅化石最早是在1961年由矿工发现的,很久以来都被认为属于非洲尼安德特人,因为它有着一些尼安德特人和人属的其他远古成员的颅骨上能发现的原始特征。对头颅化石的一颗牙齿运用放射测年法后,结果表明它有16万年的历史。
但头颅也显示出一些现代人的特征,譬如面庞缩在颅骨之下,而不是向前凸起,这点引起了马克斯·普朗克进化人类学研究所的古人类学家让-雅克·于布兰(Jean-Jacques Hublin)的兴趣。他想要知道这个头颅化石是否实际上属于一名智人的极早期成员。假如是那样,它肯定会比发现者所认为的更加有年头。
于布兰的团队重新挖掘了位于杰贝尔-伊罗业已倒塌的洞穴,那个地方在摩洛哥城市马拉喀什以西100公里处。他们希望从挖掘出头颅化石的地层中找到一小块完好的沉积物,重新确定年代。他们找到了沉积物,还有额外发现——他们发现了更多化石,其中有不完整的头颅、下颚、牙齿和肢骨,这些骨骸化石至少来自5名个体。
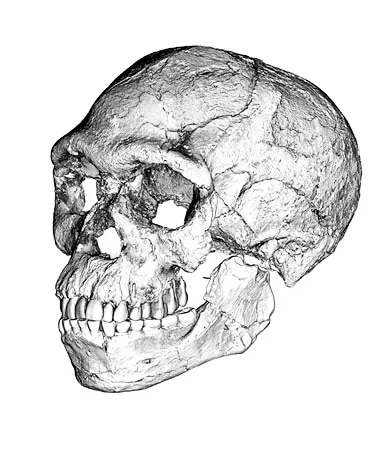

计算机重建了来自杰贝尔-伊罗地区有着30万年历史的化石
他们将一项名叫“热释光测年法”的技术应用到与化石一同发现的燧石工具上,确定这些工具有28万至35万年的历史。他们对一颗牙齿化石运用改进后的放射测年法,得到28.6万年这个新数据。这两个年代数据彼此吻合,它们也符合一项对非洲人DNA进行的研究,那项研究发现智人出现在至少30万年前。
于布兰的团队认为,杰贝尔-伊罗挖掘出的智人属于一个早期智人的大型的、变种间杂交群落,在33万到30万年前散布到非洲各地,进化成现代人类。那会让人类的非洲之根比之前所认为的更加深广——这一可能性已经让搜寻人类最早成员留下的新化石的行动重新变得如火如荼。
精确的基因编辑
超过6万种基因畸变已经与人类疾病关联上,其中将近有3.5万种是由最微小的差错引起的:只需基因组中的某个特定点的仅仅一个DNA碱基发生变化。2017年,研究者宣布一项名叫“碱基编辑”的初生技术有了重大改进,能够纠正这样的点突变,而且不仅仅是在DNA中,也能在RNA中。研究者早已经在利用这一进展,它最终可能引向医学应用。
哈佛大学的一位化学家刘如谦开创了碱基编辑技术,它借鉴了CRISPR,也就是在2012年作为一项强大实验室工具横空问世的“分子剪刀”。CRISPR擅长在特定位置切割DNA,也能引入一些会让基因关闭的差错。但它在修理点突变(DNA的4个核苷酸碱基A、C、T和G中的一个被替换成其他碱基)之类的差错时,成功的概率并不稳定。刘如谦的研究团队改进了CRISPR技术的工具箱,创造出一种碱基编辑器,解开而不是切断目标位置的DNA,再用化学方法替换某个碱基。去年,刘与同事们将一个异常的C碱基转变成T碱基,今年他们成功地将一个不正确的G碱基(这是最常见的点突变)替换成A碱基。另一支研究团队在博德研究所张锋领导下展示了碱基编辑能够将RNA中的G碱基变成A碱基。
2017年,中国科研人员也展示了碱基编辑的能力,他们修正了人类胚胎中一个导致疾病的点突变。他们从未打算移植胚胎,而且修复并不总是能成功,但这一成绩证明了碱基编辑有着研究人员口中的“巨大潜力”——并且说明了CRISPR是一件一直给予馈赠的礼物。

碱基编辑技术能够改变DNA和RNA中的碱基
生物学预印本腾飞
几十年以来,当物理学家在同行评议的学术期刊上发表论文之前,例行先在网上分享论文草稿,生物学家总是坐在一边旁观。但2017年生物学领域的预印本分享开始腾飞,数千位生命科学家会在网上张贴出他们尚未受到评议的论文,研究资助者们在这种科学交流方式背后施加着影响力。
这场运动的舞台是4年前打造的,当时位于纽约州的冷泉港实验室发起了免费生物学预印本服务器bioRxiv。bioRxiv上的论文原先集中于计算生物学,逐渐增长后包含了从微生物学到细胞生物学和神经科学领域的实验研究。杰出的生命科学家在各个地方说服同行,预印本能加速科学的进步,帮助年轻的课题负责人构建研究履历。
2017年早些时候,美国和英国的科研组织发布了鼓励预印本分享的政策,给予了预印本实践强大的推动。4月时又有一家慈善组织“陈-扎克伯格倡议”宣布,给予bioRxiv一笔金额未披露的资助,此举巩固了bioRxiv作为生物学领域最热门服务商的地位。现在的大多数学术期刊都允许作者将投稿的论文以预印本形式张贴于网上;有些编辑会在bioRxiv搜索论文,给予发表。

这场运动仍然有很长的路要走。每个月在bioRxiv或其他服务器上张贴的生物学预印本数量约为1 500份,仅仅占生物学摘要数据库PubMed每月新添加的大约10万篇论文的1.5%左右。(相比之下,大约有70%的粒子物理学论文首先以预印本形式出现。)许多生命科学家对于分享尚未接受过同行评议的论文感到不舒服,然而,“这很让人惊奇,事情竟然能如此迅速地改变,”加州大学旧金山分校的细胞生物学家罗纳德·韦尔(Ronald Vale)是一位预印本拥护者,他说,“这是学术交流文化的一次重大变革。”
一款横扫千军的癌症药物
这是一款姗姗来迟的癌症药物:这种癌症药物对付疾病时不是依据癌症初发的器官,而是依据它的DNA。2017年5月,美国食品药品管理局(FDA)给第一种这样的治疗药物派姆单抗开了绿灯。该药由默克公司生产,商品名叫齐内达(Keytruda),早已被批准用来治疗黑色素瘤和一些其他类型的肿瘤。现在医生可以把这款药开给任何晚期实体肿瘤患者,包括儿童和成年人,只要满足一个条件即可:癌细胞必须包含一项缺陷,这项缺陷有着一个别扭的名称“错配修复缺陷”。这意味着,无论细胞在胰脏、结肠、甲状腺还是其他任何组织中癌变,细胞中负责修复DNA的那段基因都有突变。
FDA的批准标志着该领域的巨大变动。因为在不同器官出现的肿瘤和那些在同个地方生长的肿瘤相比,前者也许有更多共同点——然而,将这条知识转化成具体疗法并不容易。突破发生于2015年,当时约翰·霍普金斯大学的医生在路易斯·迪亚兹(Luis Diaz)的领导下(迪亚兹如今在纽约市的纪念斯隆-凯特琳癌症中心工作),研究了派姆单抗对结肠癌病人的疗效。他们注意到一些引人注目的现象:13位有着错配修复缺陷的病人之中,有8人的肿瘤缩小了,另外4名患者的肿瘤在服药下保持稳定。药物相当于“免疫检查点抑制剂”,使得免疫系统加速对抗癌症。其他25名没有错配修复缺陷的结肠癌病人对于治疗没有反应。医生们的推论是,携带了错配修复缺陷的细胞聚积了数百个突变,于是免疫系统更加容易识别出患病细胞是“异样细胞”,随之消灭掉它们。
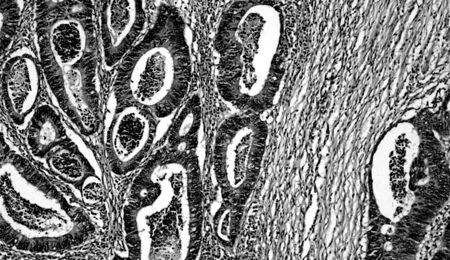
结肠癌细胞;现在,任何一种具有某个特定突变的实体癌都能用派姆单抗来治疗
2017年6月发表的一份由约翰·霍普金斯大学的迪亚兹与黎蓉氏(Dung Le)所做的研究以及许多其他研究将试验扩展至86名重病患者,涵盖了12种不同癌症,所有患者都有错配修复缺陷。有53%的病人对药物有反应。部分基于这份研究工作,FDA对这款药物给予批准,肿瘤学家希望这款药会是这场抗击癌症战斗中的先行者。
发现人科新物种
欢迎回家,打巴奴里猩猩。自从科学家上一次发现新的人科现生种,已经过去了将近90年,所以当研究人员在2017年11月推出猩猩属的第3个物种时,这是值得庆祝的喜事。只有一小群打巴奴里猩猩存活于印度尼西亚的一片受到威胁的森林中,这给欢迎增添了一些担忧。
在2017年之前,倭黑猩猩、黑猩猩——大猩猩属的两个物种——两种猩猩以及人类构成了人科的全部物种。新发现的猩猩栖息在印度尼西亚的苏门答腊岛上此前已知的猩猩分布范围的南部。其他的猩猩生活在婆罗洲上。新的猩猩物种的鉴定依据了DNA、解剖学和生态学线索,以地区名打巴奴里命名,因为它们就生活在打巴奴里的巴丹托鲁森林中。
对猩猩属的3个物种的基因组进行比较后,就能一窥猩猩的进化史。当前的猩猩的祖先大概是在几百万年前从马来西亚扩散至印尼的岛屿,那时的海洋还低得足以暴露出陆桥。根据最新的研究,大约在340万年前,苏门答腊岛北部的猩猩与婆罗洲和苏门答腊岛南部的猩猩发生分化,但是直到67.4万年前,苏门答腊岛南部的猩猩才与婆罗门岛上的猩猩分化,变成了打巴奴里猩猩。驱动这些物种形成的因素尚不清楚,但是73 000年前的一场大型火山喷发很可能提高了苏门答腊岛上两个猩猩的分化程度,最终,所有异血缘交配都停止了。
严重的危险等待着这个种族。仅有800只左右的打巴奴里猩猩存活在一片偏僻的森林里。一条公路分隔开这片1 100平方公里的栖息地,尽管有政府的保护,非法砍伐仍然在蚕食这片森林。计划中的一座水电大坝是最近的威胁。保育人士希望,认识到这群受到围困的打巴奴里猩猩是个新物种,让更多的人关注到它们的生存困境。

打巴奴里猩猩(Pongotapanuliensis)是自1929年发现倭黑猩猩以来发现的第一个人科新物种
270万年前的地球大气层
在世界之底,冻结于冰块中的是通向另一时间的入口:小小的气泡中藏着地球远古时的大气层。2017年8月,普林斯顿大学和缅因大学研究人员带领的一支研究团队宣布说,他们已经发现了被冻结于270万年前的南极冰块。这比之前的任何一份冰样本更加悠久,早了170万年,而且它将大气记录向前推进到地球气候史中的关键时间。
这份冰芯来自南极的阿伦山,那儿是一片荒芜的区域,大风吹走白雪和幼冰,暴露出致密又富有光泽的远古冰层。最古老的冰芯是该团队在2015年钻得的,来自第一冰河期进行时,那时的间冰期有4万年之久,而不是像现代纪元的间冰期是1万年。

从南极阿伦山钻出的远古冰芯中含有被困气体
研究者在寻找线索,想知道是什么因素触发了气候转变。他们测量了冰芯中被困住的气体。解读气体记录是个挑战:传统的南极冰芯有着千层蛋糕一样的层状结构,而这份冰芯与此不同,混乱得多。早期的分析表明,在冰河期开始时,二氧化碳水平保持在300 ppm以下——低于如今的400 ppm水平。这与一些从那段时期获得的替代记录不一致,那些记录示意了更高的二氧化碳水平,但它证实了一些气候模型。那些模型预测说,要让地球进入冰河期周期的话,必须要有那么低的二氧化碳浓度。
有些科学家已经提议,要去再次造访阿伦山,钻出更多冰芯,他们希望那片区域最终会产出500万年前的冰芯,那时地球上的温室状况酷似如今人类在地球上创造的局面。
基因疗法大获胜利
2017年,一次小型临床试验取得极大成功,激励了基因疗法领域。研究者报告说,他们将一个缺失的基因添加到天生患有致命的遗传性神经肌肉疾病的婴儿的脊椎神经元中,拯救了他们的性命。如果不治疗的话,那些婴儿会在大约2岁时病故。该治疗也标志着更宽阔的里程碑,因为研究者传递新基因时,跨越了一层生物膜,正是那层膜保护大脑和脊髓免受血液携带的病原体和毒素的侵害。该成果能够为使用基因疗法治疗其他神经退行性疾病开启大门。
关键在于一种名叫“腺相关病毒”(AAV)的无害病毒,基因疗法中广泛使用这种病毒将基因运送到目标细胞。2009年,法国和位于俄亥俄州哥伦布的国家儿童医院的研究团队发现,给刚出生的小鼠静脉注射一种名叫AAV9的病毒,病毒能够扩散进入大脑和脊髓。
现在,美国各地的研究者已经证实,静脉注射AAV9病毒的基因疗法能够阻止Ⅰ型脊髓性肌肉萎缩症(SMA1)——婴儿中最常见的会导致死亡的基因疾病。患有SMA1的新生儿缺乏一种脊髓中运动神经元需要的蛋白质;婴儿的肌肉越来越弱,最终会无法呼吸。11月,美国各地的研究队伍和AveXis公司报告说,接受了高剂量的AAV9病毒(携带了缺失蛋白质的基因)注射的12个婴儿中,除了1例,其他婴儿都至少能短暂地自主说话、进食和坐着。一名女婴能快步走路,一名男婴能跑步。另有一款新药已经取得相似的结果,但它必须每隔数月就注射药物进入脊椎。
现在,研究者在使用AAV9病毒携带其他基因,再注射进入患有严重遗传性脑机能障碍的儿童体内。过去,研究者得要在颅骨上钻孔后,才能对这些儿童运用基因疗法,而且没有起到多大作用。
2017年,除了治疗SMA1的成果,还有其他基因疗法的进展。两种癌症治疗方法成为第一批进入美国市场的基因疗法,病人的免疫细胞在体外进行基因改造后,再重新注射进入病人体内。而在2017年12月19日,美国食品药品管理局还批准了第一种用于治疗一种会导致失明的罕见遗传病的基因疗法。

伊夫琳·维拉里尔(Evelyn Villarreal)接受一种全新的基因疗法治疗1型脊髓性肌肉萎缩症之后
