2017 EMA对MR增强扫描钆对比剂使用限制的观点及解读
2018-01-24赵凯王霄英
赵凯, 王霄英
自从1988年美国食品药品管理局(Food and Drug Administration,FDA)批准钆对比剂(gadolinium-based contrast agents,GBCAs)上市,全世界已经有超过3亿患者使用GBCAs进行MR增强检查,在影像诊断中发挥了重要作用,成为常规临床检查手段。各种GBCAs分子结构的共同特点是通过化学手段把钆离子与有机配位体螯合在一起,增加其稳定性,避免钆在体内游离,确保安全。最初医务工作者对GBCAs的安全性关注于全身不良反应。大量的临床观察数据表明[1-3],注射GBCAs后发生急性重度全身性不良反应的概率极低,认为MR增强扫描是非常安全的。后续的临床研究中,陆续发现了肾源性系统性纤维化(nephrogenic systemic fibrosis,NSF)和身体组织中的钆沉积,研究证明上述情况与GBCAs的结构相关。各个国家和地区的药监部门对此做出了不同的反应。
2017年7月欧洲药品管理局(European Medicines Agency,EMA)发布了关于GBCAs的决定,基于使用GBCAs后发现脑内钆沉积的证据,限制在体部MR检查中使用某些线型GBCAs[4]。
2017 EMA对GBCAs使用限制的部分内容
2016年3月,欧盟委员会要求EMA启动对钆对比剂的调查,最初由负责人类药物安全事物的药物安全风险评估委员会(Pharmacovigilance Risk Assessment Committee,PRAC)执行,于2017年3月发布了初步建议,之后又对初步建议进行了再次审查。PRAC的最终建议递交给人类医药产品委员会(Committee for Medicinal Products for Human Use,CHMP)后,由EMA最终确认并发布。该观点适用于所有欧盟成员国,具有法律约束效力。
在2017年7月21日发布的文件中[4],对于静脉注射,EMA建议暂停使用三种线型GBCAs(钆喷酸、钆双胺、钆弗塞胺);推荐继续使用三种大环型GBCAs(钆特酸、钆布醇和钆特醇)。另有两类特例:①钆贝酸仅限于肝脏MR检查;②钆特酸和钆喷酸仅限于关节内注射MR检查(表1)。
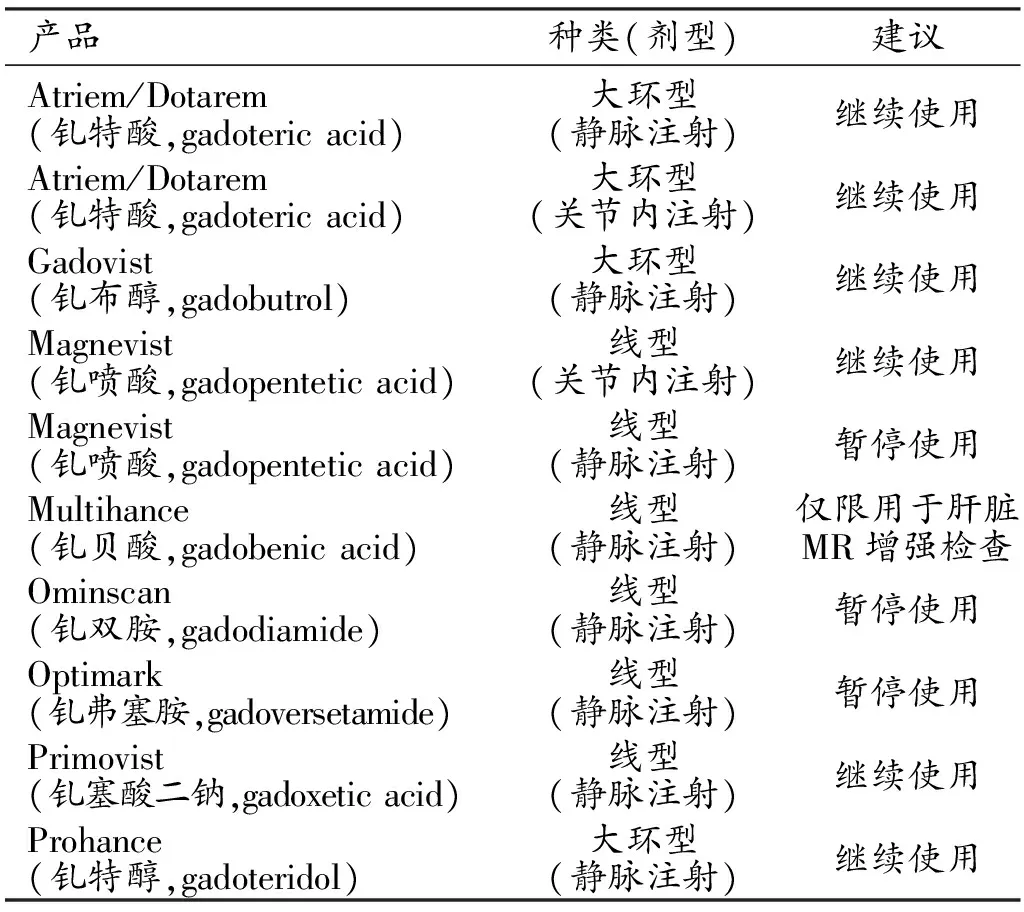
表1 2017 EMA发布GBCAs的使用建议
关于钆塞酸二钠(线型对比剂),EMA文件的描述与表格中的推荐表述不完全一致。在描述性文字中,指出钆贝酸与钆塞酸二钠可用于肝脏MR检查,但在表格中仅限定了钆贝酸为肝脏检查所使用,未对钆塞酸二钠做出限定。
脑内钆沉积的研究证据
目前有公认的证据支持钆对比剂在脑内沉积,但没有发现钆沉积造成实质性健康受损的确切证据。
关于钆对剂脑沉积,2014年首次报道了齿状核和苍白球的T1WI高信号与反复多次使用GBCAs的相关性[5],其后很多文献都证实了这个结论。以下是目前关于钆对比剂脑沉积的主要研究结果:①钆沉积的确切证据。尸检发现钆沉积在内皮细胞壁和神经组织的间质内[6];②钆沉积的常见部位。钆可以沉积在大脑和小脑的灰白质各个区域,沉积量有差别[5]。除了脑组织,动物实验证实钆在骨皮质的沉积量明显高于脑组织,且两者之间的沉积量有相关性[7]。鉴于脑活检的危险性和复杂性,可以把骨内钆的检测结果作为脑内钆沉积的一个间接指标[8];③钆沉积与肾功能的关系。肾功能正常人群中反复多次使用GBCAs也会引起齿状核的T1WI高信号[9];④钆沉积与对比剂的关系。线型GBCAs更易于发生脑内钆沉积[10,11]。动物实验证实了线型和大环型GBCAs之间的差别,且不同的线型GBCAs之间也存在差异[12]。
关于钆对比剂脑沉积的损害,尚有许多疑问没有得到解决。首先,即使在患者肾功能正常和血脑屏障完整的情况下也可发生钆沉积,钆如何通过血脑屏障、以何种状态沉积的,均尚未明确。由于大部分研究倾向于线型GBCAs发生沉积的概率远超过大环型GBCAs,推测可能与大环型GBCAs钆离子螯合得更为牢固、不易去螯合有关。更重要的是,目前尚不了解钆沉积对人体的不良影响,至今还没有发现足够的直接证据表明脑部钆沉积会对患者造成伤害。这些未知问题需要严谨设计的、长期研究数据才有可能得到解答。
其他卫生监管机构或学术团体发布的观点
FDA认为,因缺乏证据,脑部钆沉积对健康的影响未知[13]。且所有GBCAs均可能出现少量钆沉积现象,所以暂时不限制GBCAs的使用。加拿大、澳大利亚相关药监机构的观点与FDA类似。虽然没有限制特定GBCAs的使用,但均提示应在适应证明确的情况下谨慎地行增强MR检查,且使用最小剂量的GBCAs。
国际医学磁共振学会年会(International Society for Magnetic Resonance in Medicine,ISMRM)发布的声明中强调当前的对钆沉积现象的理解仍不清晰,提示业内专家谨慎使用所有GBCAs,对用药情况做详细记录,包括给药时间、选择特定钆对比剂的原因等[14]。 对于是否应停止使用某些GBCAs,ISMRM与美国放射学会(American College of Radiology,ACR)相同,均持“等待-观察”的态度[15]。美国神经影像学会的钆沉积学组还发布了在线的患者教育材料,对MR增强检查的目的、安全性及GBCAs的潜在风险进行说明[16]。美国国立卫生研究院(National Institutes of Health,NIH)的专家则认为MR增强检查应首选大环型GBCAs,但对于大环型GBCAs过敏的患者,可选择使用线型GBCAs[12]。
所有指南性文件中,均提及MRI增强检查具有重要临床作用,基于当前知识,认为在合理适应证下使用MRI增强检查,其收益明显大于风险,均认为不应因潜在的风险而减少合理的MR增强检查。从EMA的文件中,可以看出其对当前发布的决定也持开放态度。针对已经被限制使用的GBCAs,如果有新的安全性证据、并获得认可,也不除外会解除或改变当前的限制。虽然各个监管机构和学术团体的观点不完全一致,但临床工作中的用药情况正在逐渐变化,近年来在儿童MR增强检查中,线型GBCAs的使用已明显减少了[17]。
学习GBCAs安全知识,在临床实践中提高对比剂使用安全性
学习对比剂安全的最新知识,将其用于优化本单位的临床工作,使患者得到最大程度的保护,是对医学影像工作者的职业要求。以NSF为例,2006年后大量研究结果证明NSF与钆对剂有确定性关系后,欧洲泌尿生殖放射学会(European Society of Urogenital Radiology,ESUR)、FDA等发布了相关指南,提示对高危人群禁用或慎用钆对比剂,且将钆对比剂进行了风险分类。业界普遍认识到这个问题,对MRI增强检查患者进行严格筛选,合理用药后,全世界范围内NSF的发病率持续下降[18]。
由于中国各地发展不均衡,医疗机构可获得的对比剂受多种因素影响,应按照具体情况制定本单位的安全规范,合理地使用对比剂[19]。我们有如下倡议:①应认识到GBCAs与其他所有药物相同,都是有潜在副作用的。在已知的副作用中,应强调急性重度全身性不良反应是可能发生的,医学影像科应具备应急处理能力;②使用高危GBCAs时应常规测量血肌酐水平,并计算肾小球滤过率估计值(estimated glomerular filtration rate,eGFR)。对重度肾功能不全的患者,不使用高危GBCAs;③由于不清楚钆沉积的长期影响,儿童行MR增强检查时应尽可能使用大环型GBCAs;④在满足临床需要的前提下,使用最小剂量的GBCAs,并尽可能减少重复MR增强检查的次数;⑤对MR增强检查的患者要知情同意,并准确记录其检查注射的GBCAs种类及剂量。
GBCAs在临床使用了近三十年,对其安全性的认识不断提高,得益于大量研究结果。GBCAs脑沉积的现象刚刚被认识,对于当前的一系列疑问,需要医疗机构的研究者进行大量的多中心数据分析。相关药品生产厂家在更新产品信息的同时,也应考虑开展上市后研究。国际研究合作正在建立过程中[20],拟将“大数据”理念和方法应用于多中心数据挖掘中,以更高效率获得可靠结果[21]。为了更好地进行数据挖掘,收集的数据要准确、全面,需包括GBCA种类和用量、人口学信息、MR检查方案、临床症状、神经心学检查结果等,也应包括生化检查,进行组织检测和基因检测等。有条件的医疗机构应在临床工作基础上建立长期随访的生物样本库[22],开展前瞻性队列研究,同时可进行动物实验探索钆沉积的机制及潜在危害。
总之,在临床实践中认识科学规律是一个永远持续的过程,认识具有反复性和无限性。对于近年来刚发现的钆对比剂脑沉积现象,临床医生、影像医生、生产厂家和药监部门的立场应当是一致的,都是以保护患者安全、提高检查效果为最根本的出发点,从各自的角度了解事实,研究机制,明确预后,提升患者服务质量。
[1] 孙艳,郭小超,黄勇,等.MR钆对比剂全身性不良反应的研究:18540例连续病例分析[J].放射学实践,2016,31(12):1159-1162.
[2] 吴静云,王霄英.磁共振钆对比剂的不良反应[J].放射学实践,2016,31(6):543-545.
[3] 罗健,刘婧,王霄英,等.静脉注射对比剂钆喷替酸葡甲胺对肾功能正常及轻、中度异常者近期血清肌酐值的影响[J].中华放射学杂志,2010,44(12):1253-1257.
[4] EMA.EMA's final opinion confirms restrictions on use of linear gadolinium agents in body scans:recommendations conclude EMA's scientific review of gadolinium deposition in brain and other tissues[EB/OL].http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2017/07/news_detail_002780.jsp&mid=WC0b01ac058004d5c1. (accessed Aug 10,2017).
[5] Kanda T,Ishii K,Kawaguchi H,et al.High signal intensity in the dentate nucleus and globus pallidus on unenhanced T1-weighted MR images:relationship with increasing cumulative dose of a gadolinium-based contrast material[J].Radiology,2014,270(3):834-841.
[6] McDonald RJ,McDonald JS,Kallmes DF,et al.Intracranial gadolinium deposition after contrast-enhanced MR imaging[J].Radiology,2015,275(3):772-782.
[7] Lancelot E.Revisiting the pharmacokinetic profiles of gadolinium-based contrast agents:differences in long-term biodistribution and excretion[J].Invest Radiol,2016,51(11):691-700.
[8] Murata N,Gonzalez-Cuyar LF,Murata K,et al.Macrocyclic and other non-group 1 gadolinium contrast agents deposit low levels of gadolinium in brain and bone tissue:preliminary results from 9 patients with normal renal function[J].Invest Radiol,2016,51(7):447-453.
[9] Errante Y,Cirimele V,Mallio CA,et al.Progressive increase of T1signal intensity of the dentate nucleus on unenhanced magnetic resonance images is associated with cumulative doses of intravenously administered gadodiamide in patients with normal renal function,suggesting dechelation[J].Invest Radiol,2014,49(10):685-690.
[10] Kanda T,Osawa M,Oba H,et al.High signal intensity in dentate nucleus on unenhanced T1-weighted MR images:association with linear versus macrocyclic gadolinium chelate administration[J].Radiology,2015,275(3):803-809.
[11] Radbruch A,Weberling LD,Kieslich PJ,et al.Gadolinium retention in the dentate nucleus and globus pallidus is dependent on the class of contrast agent[J].Radiology,2015,275(3):783-791.
[12] Malayeri AA,Brooks KM,Bryant LH,et al.National institutes of health perspective on reports of gadolinium deposition in the brain[J].Am Coll Radiol,2016,13(3):237-241.
[13] FDA.FDA drug safety communication:FDA identifies no harmful effects to date with brain retention of gadolinium-based contrast agents for MRIs;review to continue.2017[EB/OL].https://www.fda.gov/Drugs/DrugSafety/ ucm559007.htm. (accessed Aug 08, 2017).
[14] Gulani V,Calamante F,Shellock FG,et al.Gadolinium deposition in the brain: summary of evidence and recommendations[J].Lancet Neurol,2017,16(7):564-570.
[15] ACR.ACR response to the European PRAC recommendations.2017.[EB/OL].https://www.acr.org/About-Us/Media-Center/Press-Releases/2017-Press-Releases/20170404-ACR-Response-to-the-European-PRAC-Recommendations.(accessed Aug 10, 2017).
[16] ASNR.Article on safety of gadolinium contrast agents.2017[EB/OL].www.asnr.org/ patientinfo/procedures/contrast-agents.shtml (accessed Aug 11, 2017).
[17] Blumfield E,Moore MM,Drake MK,et al.Survey of gadolinium-based contrast agent utilization among the members of the Society for Pediatric Radiology:a quality and safety committee report[J].Pediatr Radiol,2017,47(6):665-673.
[18] Semelka RC,Ramalho M,AlObaidy M,et al.Gadolinium in humans:a family of disorders[J].AJR,2016,207(2):229-233.
[19] Terashima KH,Reich DS.Gadolinium deposition: practical guidelines in the face of uncertainty[J].Lancet Neurol,2017,16(7):495-497.
[20] Quattrocchi CC,van der Molen AJ.Gadolinium retention in the body and brain:is it time for an international joint research effort?[J].Radiology,2017,282(1):12-16.
[21] 刘义,王霄英.大数据概念在医学影像中的应用探索[J].放射学实践,2016,31(12):1124-1126.
[22] 吴静云,张晓东,王蕊,等.前列腺MRI影像生物样本库的建设探索[J].肿瘤影像学,2016,25(2):123-126.
