BMSC移植治疗对慢性心衰大鼠心肌结构与功能的影响
2018-01-24朱向情熊云兰朱姿英卢国良潘兴华
王 欢,朱向情,刘 茜,熊云兰,朱姿英,卢国良,潘兴华,魏 玲
有研究显示,骨髓间充质干细胞(BMSC)移植可以抑制心肌梗死后心肌纤维化,改善心功能[1-2]。但移植的BMSC是否对慢性心衰心肌纤维具有抑制作用,目前尚无定论。本研究利用慢性心衰大鼠模型,观察了BMSC对慢性心衰大鼠心肌纤维化、心肌细胞凋亡及心肌胶原Ⅰ和胶原ⅢmRNA表达水平的调节作用,探讨BMSC对大鼠慢性心衰进程及心肌重构的影响及其机制。
1 材料与方法
1.1 实验材料 DMEM-F12培养基(HyClone公司),胎牛血清(BI公司),胰蛋白酶-EDTA消化液(Solarbio公司),慢病毒载体LV-EGFP(上海吉凯生物有限公司),大鼠成骨诱导完全培养基、SD大鼠成脂诱导完全培养基(广州赛业生物科技有限公司),盐酸异丙肾上腺素注射液(上海禾丰制药有限公司),Masson染色试剂盒(武汉谷歌生物科技有限公司),TUNEL试剂盒(Roche公司)。
1.2 BMSC的制备 取6只1月龄SD大鼠颈椎脱臼处死,无菌取大鼠股骨、胫骨骨髓,接种于T75细胞培养瓶中,37℃、5%CO2饱和湿度培养箱中培养,48 h后首次全量换液,以后每2~3 d换液1次。当细胞贴壁达80%~90%时,用0.25%胰蛋白酶消化,按1∶3进行传代。按试剂盒操作指南进行BMSC成骨、成脂诱导分化鉴定。取第3代的BMSC重悬后计数,铺板于48孔板中,细胞数为5×105个/孔,以按感染复数(MOI)150计算并加入慢病毒LV-EGFP,病毒转染滴度为1.8×1010U/ml,继续培养、观察BMSC生长及GFP表达情况。
1.3 慢性心衰大鼠模型建立及BMSC移植 SPF级雄性 SD 大鼠 30 只,3 月龄,体重(300±30)g,由昆明医科大学动物实验中心提供[许可证号:SCXK(滇)2011-0005],随机分为移植组、模型组和正常对照组,每组10只。移植组和模型组大鼠连续腹腔注射异丙肾上腺素,3 mg/(kg·d),共 14 d,经超声心动图测定,左心室射血分数(LVEF)<50%。移植组大鼠于尾静脉注射 EGFP 标记的 BMSC(5×106个/ml,1 ml/只),模型组同步注入同体积生理盐水,对照不做处理。各组大鼠在造模后2 w及BMSC移植4 w后,用探头频率为12 MHz的彩色多普勒超声心动仪(Philip公司,美国)检测LVEF。实验结束后称取各组大鼠体重后,麻醉大鼠,取心脏称重并计算心重/体重指数。
1.4 各组心肌组织CollagenⅠ、CollagenⅢ mRNA的表达检测 采用荧光定量PCR法,用RNAiso Plus试剂盒提取总 RNA, 取 2 μg总 RNA,用GoScriptTMReverse Transcription System Kit制备cDNA并置于-20℃冰箱保存。采用荧光定量PCR仪扩增CollagenⅠ和CollagenⅢ,CollagenⅠPCR引物:上游 5'AGAGGCATAAAGGGTCATCGTG3',下游5'CAGGTTGCAGCCTTGGTTAGG3'。 CollagenⅢPCR引物:上游5'GTCGGAGGAATGGG TGGCT AT3',下游 5'CATTGCGTCCATCAAA GCCTC3'。内参 GAPDH引物:上游 5'TTCCTACCCCCAATG TATCCG3',下游5'CATGAGGTCCACCACCCTGTT3'。PCR结束后获取 Ct值并计算 2-△△Ct,分析表达差异。
1.5 心肌病理组织学观察 取心脏称重后的大鼠心肌组织,常规石蜡包埋、切片,层厚5 μm,进HE染色、Massons染色及Tunel染色。另取心肌组织,采用OCT法包埋并进行冰冻切片(15 μm),于倒置荧光显微镜下观察植入BMSC的存活及分布情况并采图。
1.6 统计学方法 应用SPSS18.0统计学软件进行数据分析,计量资料以±s表示,重指数用单因素方差分析,多个样本均数间两两比较采用LSD检验,两变量相关性采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 BMSC制备及GFP基因标记结果 大鼠BMSC原代培养48 h后,可见少量细胞贴壁,成短小梭形或三角形(图1A)。贴壁生长后体积增大,多呈梭形,培养10~14 d左右,融合度达80%~90%(图1B)。传代后的BMSC呈均一放射状排列,成纤维样细胞外观(图1C)。BMSC成骨诱导21 d后,可见明显的茜素红染色阳性钙结节(图1D)。成脂诱导14 d后,细胞内可见油红O染色阳性脂滴(图1E)。加入LV-EGF培养4 d后,EGFP表达率达90%(图1F)。
2.2 BMSC在心脏中的定植 注射EGFP标记的BMSC的大鼠的心肌组织经冰冻切片后,在荧光显微镜下观察,可见心肌组织出现表达EGFP的绿色荧光细胞(图2A、2B),模型组及正常对照组则未见绿色荧光细胞(图 2C、2D)。
2.3 各组心功能、心重/体重指数及行为学观察模型组、移植组 HW/BW 分别为(6.01±0.30)%、(5.33±0.23)%,均明显高于正常组(4.12±0.25)%(P< 0.01),但BMSC移植组低于模型组(P<0.01)。模型组LVEF 为(33.66±2.51)%,低于正常组的(75.67±4.04)%(P<0.01)。BMSC移植治疗4 w后,移植组LVEF为(44.0±3.6)%,高于模型组(P< 0.01)。正常组大鼠未见死亡,表现为活泼好动,饮水、摄食正常,体重增加;心衰组大鼠出现体重减轻、摄食饮水减少、呼吸急促、心率增快、精神萎靡等;BMSC移植后,活动能力增强、摄食饮水增加、精神状态改善、体重增加、呼吸及心率减慢。
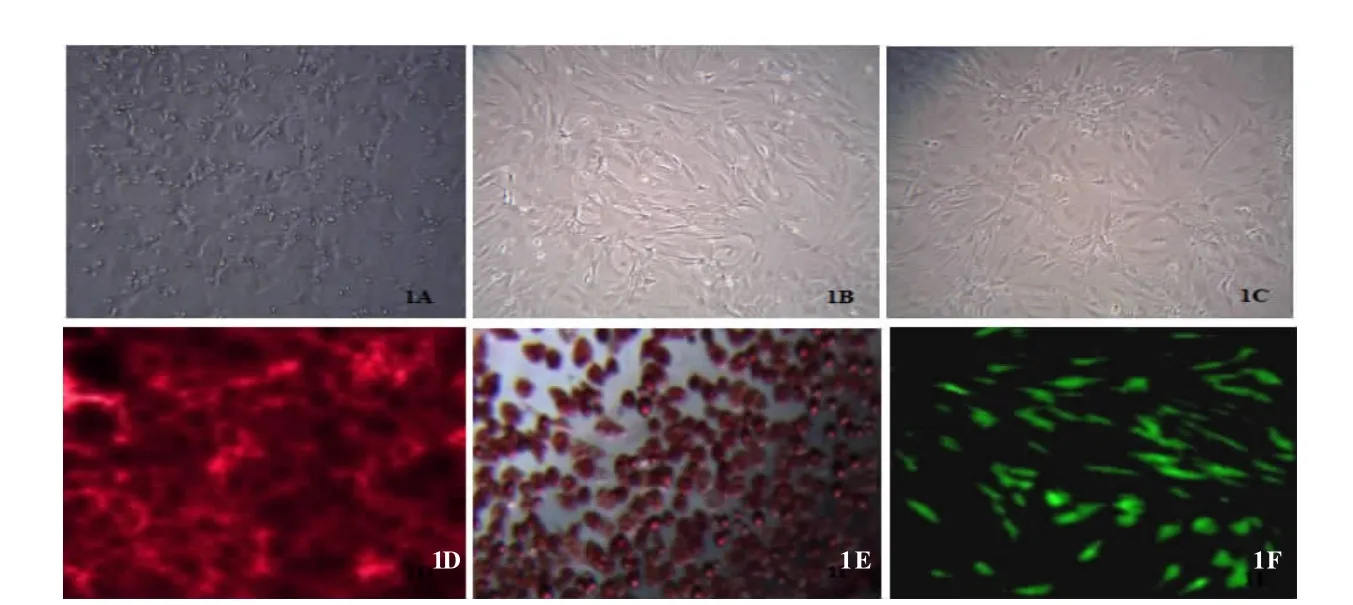
图1 BMSC生长形态及EGFP基因标记结果
2.4 心肌组织病理变化 HE染色显示,模型组(图3C)、移植组(图3B)可见心肌细胞肥大及凋亡、心肌纤维排列紊乱、心肌间质炎性细胞浸润伴纤维瘢痕组织增生,而正常组(图3C)未见上述病理改变。BMSC治疗4 w后,移植组心肌纤维化、心肌细胞肥大及重构程度较模型组轻。模型组(图3F)胶原容积分数为55.60±3.65,心肌组织间质内可见大量的胶原纤维,无心肌细胞再生。移植组(图3E)心肌间质中胶原纤维明显减少,心肌细胞在瘢痕组织中少量再生,胶原容积分数为35.71±4.88,低于模型组(P<0.01)。而正常组心肌纤维排列整齐,心肌纤维化少见,胶原容积分数仅为0.31±0.09(图3D)。正常组大鼠(图3G)心肌细胞凋亡率为(1.53±0.69)%。模型组大鼠 (图3I)心肌组织心肌细胞凋亡率为(43.61±4.88)%,高于正常组(P< 0.01)。 移植组(图3H) 凋亡率为 (23.55±3.62)%, 低于模型组 (P<0.01)。
2.5 各组心肌CollagenⅠ和CollagenⅢmRNA表达水平比较 正常组、移植组、模型组心肌CollagenⅠ基因的mRNA相对表达量分别为0.03±0.01、0.52±0.31、2.12±0.98,CollagenⅢ基因的 mRNA 相对表达量分别为 0.08±0.05、0.80±0.45、2.69±2.38。模型组心肌CollagenⅠ和CollagenⅢ的mRNA表达水平高于正常组及移植组(P<0.05),而正常组与移植组比较无统计学差异(P>0.05)。见图 4。
3 讨论
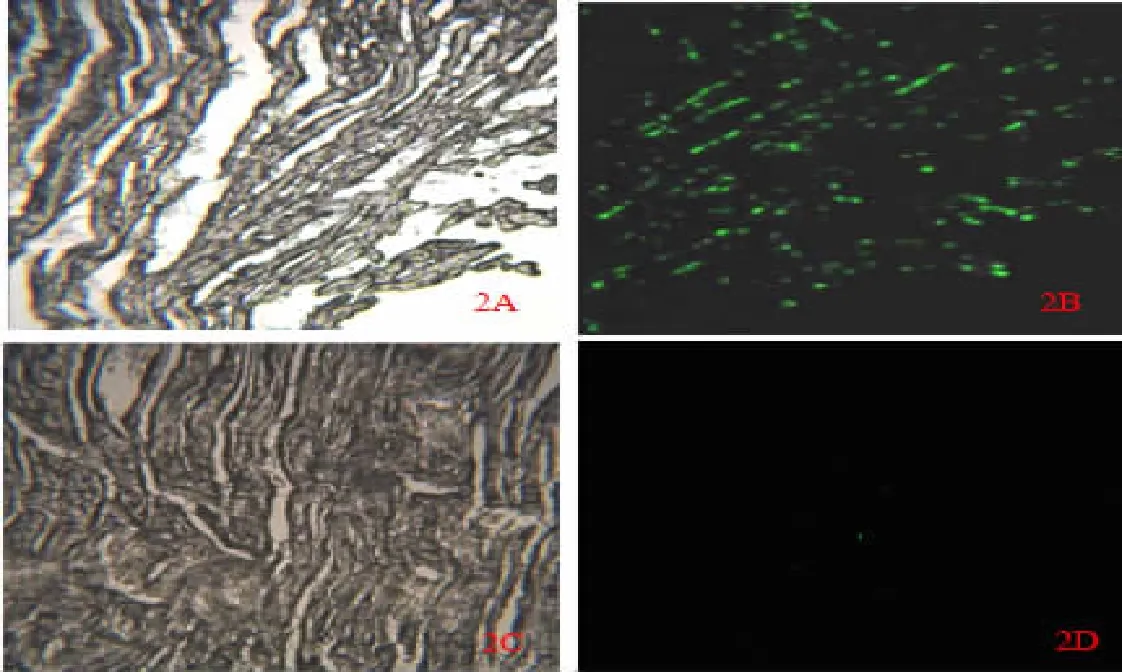
图2 EGFP标记BMSC在心肌内的分布
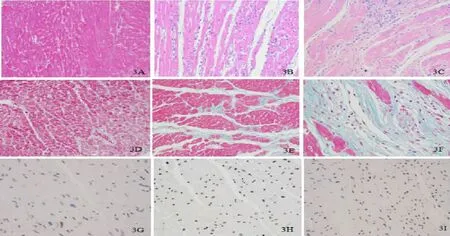
图3 各组大鼠心肌组织病理染色结果
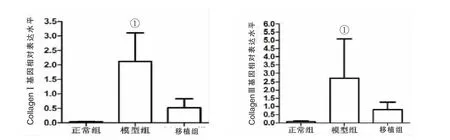
注:与正常组、移植组比较,①P<0.05
心肌纤维化是心肌修复的主要病理表现,可以导致心脏僵硬度增加,心脏顺应性降低,心脏传导阻滞,心肌收缩及舒张功能障碍,最终导致心力衰竭的发生[2-3]。MSC移植后可在心肌缺血微环境下分化为心肌细胞,分泌促细胞及血管生成因子,抑制心肌细胞凋亡,增加心肌灌注,减少心肌细胞外基质沉积,改善心肌重构,提高心功能[4-5],但其机制目前尚不明了。
本研究采用BMSC移植治疗慢性心衰大鼠4 w后,大鼠心肌Collagen I和CollagenⅢ mRNA的表达量明显减少,提示BMSC移植后显著抑制心肌纤维化的作用,这可能是抑制心肌纤维化的机制之一。超声心动图结果显示,BMSC治疗后4 w,大鼠心脏LEVF有显著增加,收缩功能明显改善,心功能改善,而模型对照大鼠的收缩功能进一步下降。病理组织学检测显示,BMSC治疗后4 w,大鼠心肌细胞肥大及心肌细胞凋亡率明显降低,心肌细胞数量增加,心肌间质胶原沉积减少。这些结果表明,BMSC治疗能明显改善心衰大鼠心衰症状,使大鼠心重/体重指数减小,呼吸及心率减慢,体重增加。
综上所述,BMSC移植治疗可改善慢性心衰大鼠心肌重构,使心肌细胞凋亡减少,瘢痕组织形成减少,间质胶原沉积减轻,这可能是其抑制心肌纤维化的机制之一。
[1] Favreau AJ,Ryzhov S,Sawyer DB.Novel biological therapies targeting heart failure:myocardial rejuvenation[J].Heart Fail Clin,2016,12(3):461-471.
[2] Davide Lazzeroni,Ornella Rimoldi,Paolo G Camici.From left ventricular hypertrophy to dysfunction and failure[J].Circulation Journal,2016,80(3):555-564.
[3] 雷川云,柯亭羽,徐勉.干细胞移植治疗2型糖尿病急性心肌梗死的研究进展[J].中国医药科学,2013,3(19):36-38.
[4] Silva GV,Litovsky S,Assad JA,et al.Msesnchymal stemcells differentiate into an endothelial phenotype,enhance vascular density,and improve heart function in a canine chronic ischemia mode[J].Circulation,2005,111(2):150-156.
[5] Li L,Zhang Y,Li Y,et al.Mesenchymal stem cell transplantation attenuates cardiac fibrosis associated with isoproterenol induced global heart failure[J].European Society for Organ Transplantation,2008,21(12):1181-1189.
