基于磁共振成像的膀胱肿瘤自动检测系统的开发*
2018-01-24石宇强徐肖攀
邵 希 石宇强△ 刘 岩 徐肖攀 刘 洋 张 曦*
膀胱肿瘤是泌尿系统最常见的肿瘤之一,根据美国癌症协会发布的“Cancer Facts and Figures 2016”[1]数据显示,美国男性中膀胱肿瘤的发病率位居第4位,致死率居第8位;而中国男性中,膀胱肿瘤的发病率居恶性肿瘤第7位,且近年来呈逐年上升趋势[2]。
膀胱肿瘤多发于老年男性且极易复发,对于非肌层浸润性膀胱肿瘤,其5年生存率可达到96%,但约有50%~70%的患者在术后18个月内会复发[3-4];对于肌层浸润性肿瘤,其5年生存率更低,且复发率更高[5]。随着社会人口老龄化加剧,膀胱肿瘤患者将逐年增多而需要定期筛查或复查,但费用巨大且严重影响患者的生存质量。
目前,光学膀胱镜(optical cystoscopy,OCy)与经尿道切除(transurethral resection,TUR)术相结合是膀胱癌检测和诊断的金标准[5]。然而,OCy检查不仅无法直接获得肿瘤的浸润深度(肿瘤分期),存在视野盲区且该手段为有创,可能引起患者不适,并伴有机械损伤风险[6]。因此,临床上迫切需要一种无创及高效的检测手段,对膀胱肿瘤进行检测和诊断。
近年来,基于磁共振(magnetic resonance,MR)的影像学检查是膀胱肿瘤的重要筛查手段,而且是一种非侵入式的检查方式,避免了CT成像中X射线辐射的缺陷,能提供清晰的人体软组织结构信息和丰富的人体功能信息。与医生通过OCy主观判断有无膀胱肿瘤相比,MR影像客观性较强,可挖掘各类定量的影像信息用于膀胱肿瘤检测。因此,本研究拟基于磁共振成像(magnetic resonance imaging,MRI),用自适应形状先验约束的水平集(adaptive shape prior constrained level sets,ASPCLS)方法,拉普拉斯偏微分方程(Laplace partial differential equation)计算三维(three dimensional,3D)膀胱壁厚度,基于空域信息的模糊C均值(fuzzy C-means with spatial information,sFCM)算法提取肿瘤疑似区等,初步建立基于MRI的膀胱肿瘤自动检测系统,从而实现膀胱肿瘤的自动提取,为膀胱肿瘤的进一步诊断和治疗提供依据。
1 材料与方法
1.1 影像数据采集
本研究采用MRI T2加权成像序列进行膀胱肿瘤患者的影像数据采集。
(1)T2加权序列中,尿液作为天然的内源性对比剂,使其与膀胱壁以及周边组织有更好的对比度,从而使膀胱内外壁分割得更为准确。
(2)肿瘤的信号强度通常比膀胱壁略高,这使得肿瘤区域在影像中对比显著[7]。采用虚拟膀胱镜检测时,为了准确判断病灶,膀胱需处于充盈状态。①在核磁共振扫描前,受试者需饮用>600 ml的水,在有尿感后10~15 min内,进行扫描;②为了尽量减少肠道蠕动造成的伪影和对膀胱壁的挤压而引起的形变,要求所有被试者提前做好肠道准备;③为了减少扫描中因人体呼吸而产生呼吸伪影,扫描时需在腹部捆绑腹带。整个扫描过程持续约6~8 min,所有MRI数据经GE Discorvery750 3.0T扫描仪采集完成,扫描参数见表1。
1.2 膀胱内外壁的分割
获取膀胱内外壁信息是提取膀胱肿瘤疑似区域的先决条件,对于拟建立的检测系统的功能实现至关重要。目前,医学影像领域常用的分割算法可分为基于区域和基于轮廓两类:基于区域的分割算法在分割MRI图像时,因较强的噪声,部分容积效应和灰度非均匀性等影响,分割效果往往不能满足要求;而基于轮廓的水平集方法[8-10]结果较为理想,目前已被广泛地使用。2014年Qin等[9]提出了一种基于T2WI序列的ASPCLS。为了增强模型的分割准确性和鲁棒性,该方法将初始约束,如梯度信息、区域性信息、最小壁厚等引入到模型中(该方法被用作本研究的分割方法)。
1.3 膀胱壁3D厚度的计算
膀胱壁厚度是区分膀胱壁是否存在病变的重要指标,因此在获取了膀胱内外壁信息后,需要计算膀胱壁3D厚度[11]。拉普拉斯方程以势函数的形式描述了电场、引力场和流场等物理对象的性质。拉普拉斯方程是一种二阶偏微分方程,其计算为公式1:

在等势面、场线与厚度关系中,中间的虚线表示由拉普拉斯场所形成的等势线,与虚线垂直的曲线表示场线。内壁上任意一点在外壁上必存在唯一点与之对应,而且对于内外边界间的任意一点,其对应的厚度值为所在场线的长度(如图1所示)。

图1 等势面、场线与厚度关系示意图

表1 T2加权影像序列具体扫描参数
1.4 疑似肿瘤区的提取
模糊C均值(fzuuy C-mrans,FCM)算法是一种无监督聚类算法,也是图像领域一种常用的分割算法,其具有计算简便,无需过多人工干预的优点,但对噪声较为敏感。而MRI图像常受图像噪声、部分容积效应、灰度非均匀性等的影响,导致传统的FCM算法无法有效地提取肿瘤区域。因此,本研究采用sFCM算法对疑似肿瘤区域进行分割,从而更准确地提取肿瘤区域。该方法基于传统的FCM算法,将邻域的统计信息作为权重项引入到隶属度函数中,使分割时体素的隶属度受周边体素的影响,从而令分割结果更为平滑,对噪声和灰度非均匀性更为鲁棒。
1.5 系统功能步骤与硬件环境
MRI膀胱肿瘤自动检测系统分为4个主要操作步骤:①读取T2W1的MRI影像;②进行膀胱内外壁的分割;③使用拉普拉斯偏微分方程进行膀胱壁3D厚度的计算;④利用改进的模糊C均值算法,提取整个疑似肿瘤区域。上述步骤的所有程序使用Matlab2012b编写,采用的计算机为八核CPU,主频为2.60 GHz,内存为4.00 GB。
1.6 系统准确性评价
本研究使用Dice重合比率(Dice’ similarity coefficient,DSC)作为指标来评价系统的准确性,其计算为公式2:
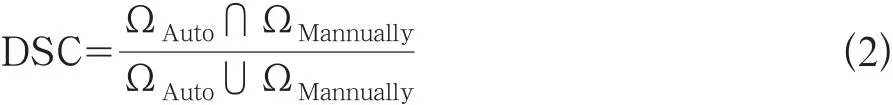
式中DSC表示重合比率,ΩAuto表示系统自动分割提取出的肿瘤区域,ΩMannually表示手动分割提取出的肿瘤区域。
2 结果
(1)利用已采集到的膀胱肿瘤患者T2加权影像数据,对已建立的疑似区域自动提取系统进行流程与性能测试。在读取T2序列的MRI影像后的界面显示效果中,内壁上的凸起部分为膀胱肿瘤(如图2所示)。

图2 读取T2序列MRI影像后的界面图
(2)在正确读取图像数据后,系统需完成内外壁的分割任务。进行内外壁手动和自动分割后的软件界面如图3和图4所示,其中图3显示了系统对中间层进行手动分割的效果图,图4则是对其余层进行自动分割的效果图,最终实现膀胱轴位像自顶向下的内外壁分割。

图3 对中间层进行手动分割的界面图

图4 对其余层进行自动分割的界面图
(3)系统自动分割出每例膀胱肿瘤患者的膀胱内外壁之后,还需对膀胱壁厚度进行自动计算。拉普拉斯方程计算某1例数据的膀胱壁厚度的结果,从中可以看到在肿瘤疑似区域像素对应的厚度明显变厚。由于壁内每一体素都对应于所在场线的厚度值,为通过厚度的聚类来获取肿瘤区域提供了依据(如图5所示)。
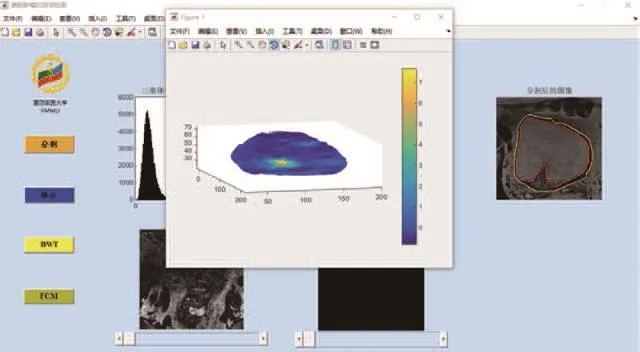
图5 3D膀胱壁厚度计算的界面图
在1例膀胱肿瘤患者的数据中,基于分割后的图像,使用sFCM算法进一步提取出肿瘤疑似区,如图6所示。
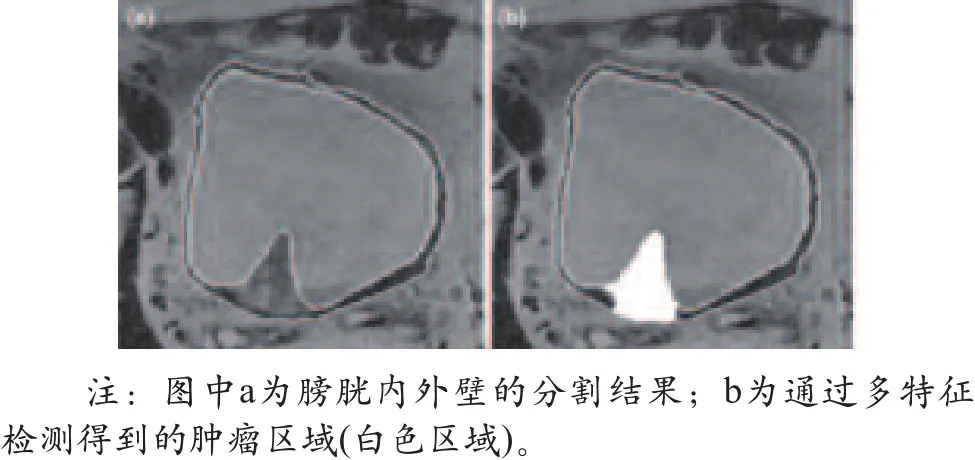
图6 膀胱肿瘤患者肿瘤疑似区提取结果影像
(4)通过sFCM方法提取出肿瘤疑似区之后的软件界面显示图,从右下角的图片中可以看出,白色区域即肿瘤疑似区(如图7所示)。
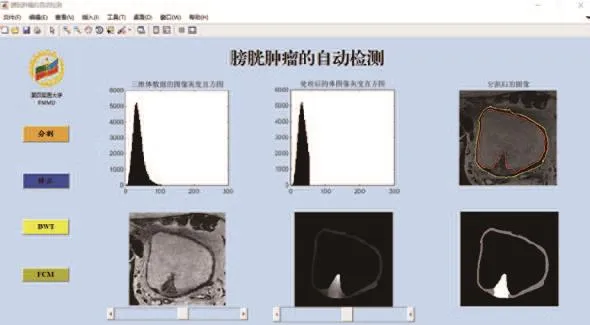
图7 提取肿瘤疑似区后的界面图
(5)根据建立的膀胱肿瘤自动检测方法,利用10套膀胱癌患者T2加权影像序列数据进行初步验证。将系统自动提取出的10套数据的膀胱肿瘤疑似区域与医生手工勾画的膀胱肿瘤疑似区域进行DSC系数比较,得到10套数据的平均DSC为86.7%,因而该系统对膀胱肿瘤疑似检测和提取的准确性较高。
3 讨论
为了克服OCy的有创性和无法判断浸润深度等缺点,以及更好对膀胱肿瘤进行无创筛查,本研究提出了一个基于MRI影像的膀胱肿瘤自动检测系统,该软件系统包含MRI数据的读取、膀胱内外壁的分割、3D膀胱壁厚度计算和肿瘤区域的进一步提取4个步骤,自动实现了膀胱肿瘤疑似区域检测,为疑似区和肿瘤性质的进一步分析和诊断提供了依据。本研究通过对多例膀胱肿瘤患者数据的测试与评估,保证了系统功能的可行性,且得到了较高的平均DSC,证实了该系统检测膀胱肿瘤和提取肿瘤疑似区的准确性。
目前,该系统是基于影像的膀胱肿瘤检测与分析研究领域的首个自动提取与检测系统,为课题组下一步更好的开展基于多模态MRI虚拟膀胱镜系统的研发奠定了良好的研究基础与软件基础。然而,本系统也存在一定的局限性,仅着眼于提取出肿瘤疑似区,并未进一步判断疑似区的性质、浸润深度以及分期等特点。今后,可以基于本系统进一步判断肿瘤疑似区的性质,判断肿瘤分级和分期等性质[12]。此外,本系统仅使用了单模态的T2加权影像序列数据,未使用各类能够提供更多反映病理生理及细胞层面信息的磁共振功能影像序列。
随着医学影像技术的不断发展,未来课题组将获得质量更好、模态更多的MR影像,通过自动检测系统可以更为准确的分割出膀胱的内外壁,从而更为准确地提取出肿瘤疑似区,为临床诊断和治疗提供一种新型的无创且可靠的膀胱肿瘤检测方法。
4 结语
本研究提出的基于T2加权MRI的膀胱肿瘤自动检测系统,能够初步实现膀胱肿瘤的检测和疑似肿瘤区的提取,与真实膀胱肿瘤区域相比达到了较高的准确性,为膀胱肿瘤的早期检测及术前诊断提供了无创新手段。
[1]American Cancer Society.Cancer Facts and Figures 2016[A].Atlanta:American Cancer Society,2016.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3]American Cancer Society.Cancer Facts & Figures 2014[A].Atlanta:American Cancer Society,2014.
[4]Grasso M.Bladder cancer:a major public health issue[J].European urology,2008,7(7):510-515.
[5]那彦群,叶章群,孙颖浩,等.中国泌尿外科疾病诊断治疗指南(2014版)[M].北京:人民卫生出版社,2014.
[6]杨金玲,刘照旭.膀胱镜检查疼痛控制的研究现状[J].解放军护理杂志,2008,25(1):34-36.
[7]Hafeez S,Huddart R.Advances in bladder cancer imaging[J].BMC medicine,2013,11(1):104.
[8]Duan C,Liang Z,Bao S,et al.A coupled level set framework for bladder wall segmentation with application to MR cystography[J].IEEE Trans Med Imaging,2010,29(3):903-915.
[9]Qin X,Li X,Liu Y,et al.Adaptive shape prior constrained level sets for bladder MR image segmentation[J].Biomedical Health Informatics,2014,18(5):1707-1716.
[10]Han H,Li L,Duan C,et al.A unified EM approach to bladder wall segmentation with coupled level-set constraints[J].Medical Image Analysis,2013,17(8):1192-1205.
[11]Zhang X,Liu Y,Yang Z,et al.Quantitative Analysis of Bladder Wall Thickness for Magnetic Resonance Cystoscopy[J].IEEE Trans Biomed Eng,2015,62(10):2402-2409.
[12]Zhang X,Xu X,Tian Q,et al.Radiomics assessment of bladder cancer grade using texture features from diffusion-weighted imaging[J].Journal of Magnetic Resonance Imaging,2017,46(5):1281-1288.
