不同评分系统对判断急性胰腺炎病情及预后的比较研究
2018-01-23张映媛路明亮康祚昌蒋明远林凡榆
张映媛,黄 华,路明亮,康祚昌,蒋明远,林凡榆
昆明医科大学第二附属医院消化内科,云南 昆明 650101
急性胰腺炎(acute pancreatitis,AP)是常见消化系统急重症之一。随着研究不断深入,根据2012年修订的新亚特兰大分类标准按照是否存在持续器官衰竭(即器官衰竭持续时间>48 h,器官衰竭定义为改良Marshall 评分≥2)可分为轻度胰腺炎(mild acute pancreatitis,MAP)、中度重症急性胰腺炎(moderate sereve acute pancreatitis,MSAP)和重度急性胰腺炎(severe acute pancreatitis,SAP)三类[1]。其中SAP会出现严重局部和全身病理生理改变、机体内环境紊乱、多器官功能障碍综合征,病情凶险、预后差、死亡率高[2-3]。早期对AP病情及预后作出较为准确的评估判断,指导临床采取积极合理的治疗措施,已受到临床越来越多的重视[4-5]。根据患者临床症状、体征、血生化、影像学等检查几个方面相结合形成的评分系统众多,其侧重点和优缺点也各不相同,但这些评分均基于1992年亚特兰大分类标准,在新分类标准下的应用价值研究较少。本研究比较分析PANC3、HAPS、SIRSS、Ranson’s、CTSI评分对判断AP病情及预后的诊断价值,为临床应用提供依据。
1 资料与方法
1.1一般资料收集2013年1月至2016年12月昆明医科大学第二附属医院消化内科收治的121例AP患者的临床资料。其中男67例、女54例,年龄(50.38±16.91)岁(16~85岁);根据不同病因分为:胆源性53例,高脂血症性40例,酒精性19例,其他病因(包括胰管阻塞、十二指肠降段疾病、手术与创伤、药物源性、感染、不明原因等)9例。根据病情严重程度分为MAP组42例,MSAP组39例,SAP组40例。三组间性别、年龄相比,差异无统计学意义(P>0.05),具有可比性。
1.2纳入与排除标准参考2012年美国亚特兰大急性胰腺炎分级[6],满足以下三个临床特点中的任何两个即可诊断为AP:(1)AP特征性急性、持续性腹痛(中上腹疼痛阵发性加重);(2)血淀粉酶和(或)脂肪酶≥正常值上限3 倍;(3)AP特征性B超或CT改变。其中严重程度的临床诊断标准:MAP不伴有器官功能衰竭及局部或全身并发症;MSAP伴有一过性(≤48 h)的器官功能障碍;SAP伴有持续(>48 h)的器官功能衰竭[7]。排除标准:(1)急性胆囊炎、急性胃肠穿孔、急性肠梗阻、检查肺栓塞、急性心肌梗塞、肿瘤、外周血管疾病、血液系统疾病、妊娠或宫外孕等其他持续腹痛疾病;(2)住院不满48 h;(3)资料不完整;(4)无法完成上述评分或其他原因而自动出院等不符合上述诊断标准者[8]。
1.3研究方法记录患者年龄、性别、身高、体质量、住院时间、生命体征、白细胞计数、红细胞压积、血尿素氮、血肌酐、ALT、LDH、血钙、血糖、动脉血气分析、液体丢失量、CT影像学等相关检查结果指标及转归情况。于入院24 h内计算PANC3、HAPS、SIRSS评分,48 h内计算 Ranson’s、CTSI评分。通过受试者工作特征曲线(receiver operator characteristic curve,ROC)比较不同评分系统对预测SAP及预后诊断价值。根据ROC曲线确定的最佳临界值分析比较不同评分对评估AP局部并发症、全身并发症、死亡的发生率。

2 结果
2.1不同评分系统对AP严重程度的比较PANC3、SIRSS、HAPS、Ranson’s、CTSI评分的均数差异均有统计学意义(P<0.05),其中SAP组患者的分值均显著高于MAP组及MSAP组(见表1)。
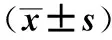
表1 一般资料比较Tab 1 Comparison of general data (±s)
2.2不同评分与SAP相关性PANC3、SIRSS、Ranson’s、CTSI评分与SAP有显著相关性(P<0.05),HAPS评分与SAP无相关性(P>0.05,见表2)。HAPS评分对预测MAP的准确度为90.5%(见表3)。
2.3不同评分预测SAPPANC3评分AUC值(0.909)、约登指数(0.703)、敏感度(97.5%)均高于其他评分(见表4、图1)。
2.4不同评分预测AP局部并发症CTSI评分AUC值(0.924)、约登指数(0.814)和敏感度(87.7%)和特异度(93.7%)高于其他评分(见表4、图2)。
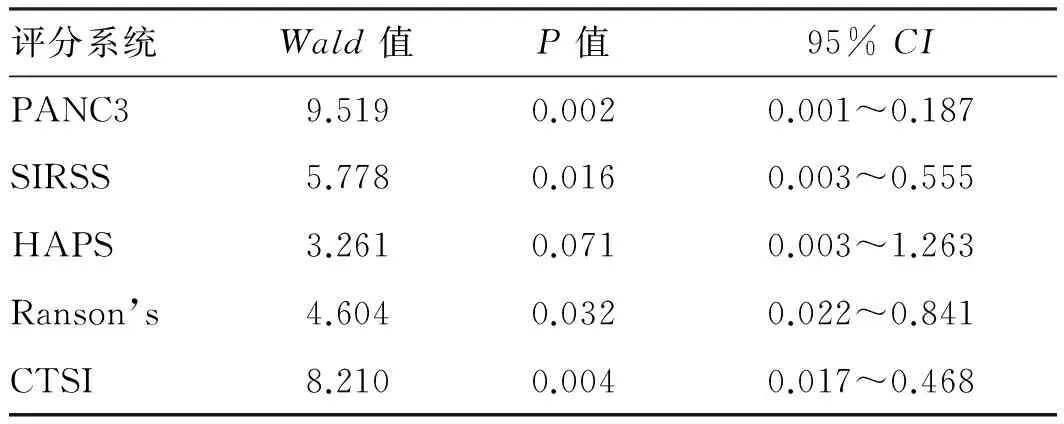
表2 五种评分与SAP相关性Tab 2 Correlation between the five scoring systems and SAP
2.5不同评分预测AP全身并发症和死亡Ranson’s评分AUC值分别为0.896、0.885,约登指数分别为0.660、0.693,高于其他评分(见表4,图3、图4)。
2.6不同评分对评估局部并发症、全身并发症、死亡的发生率PANC3≥2分、SIRSS≥2分、Ranson’s≥3分、CTSI≥4分组所占例数均显著高于PANC3<2分、SIRSS<2分、Ranson’s<3分、CTSI<4分组(见表5)。

表3 HAPS评分预测MAPTab 3 HAPS predicted MAP 比例/%
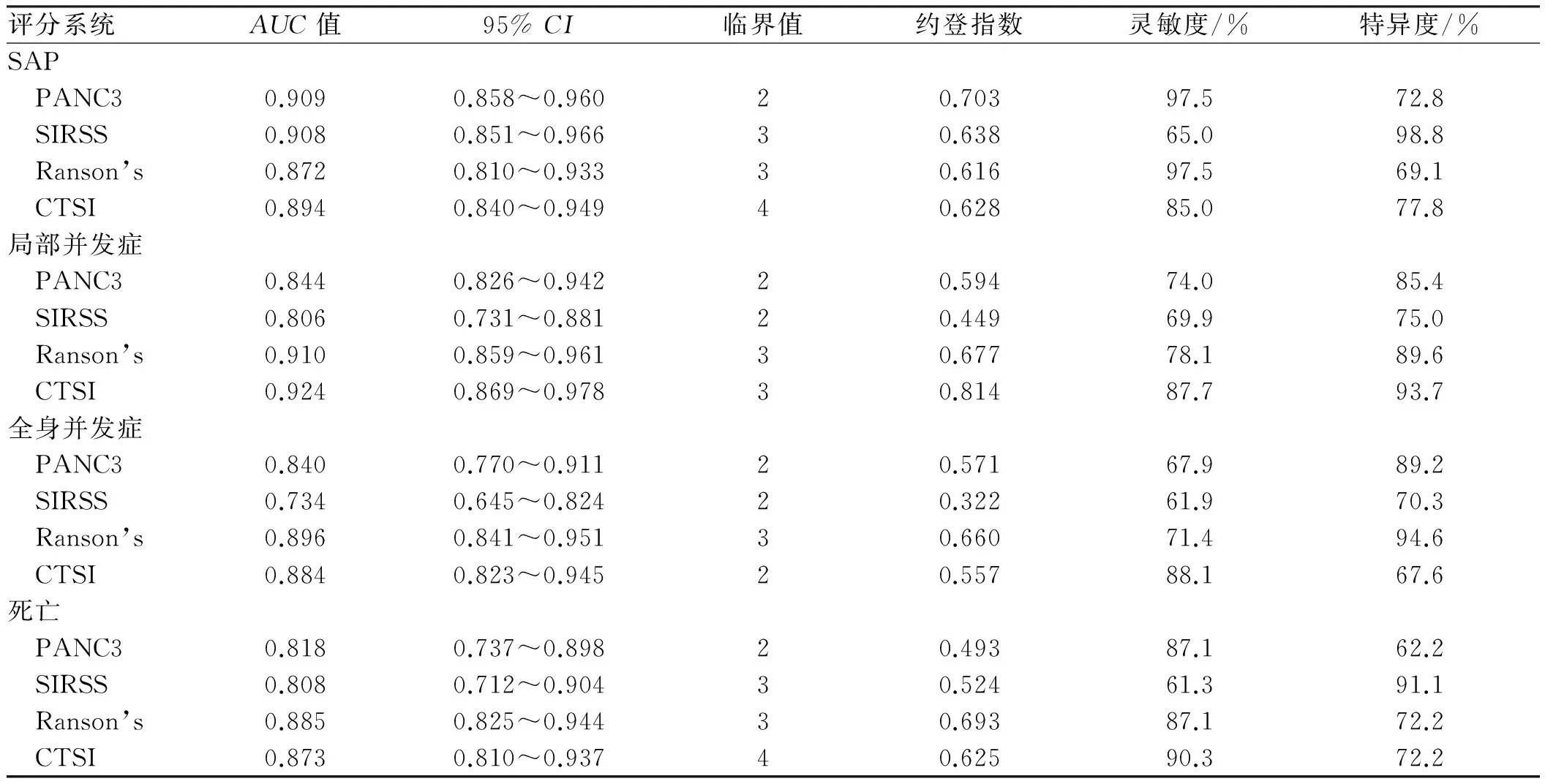
表4 不同评分对预测SAP及预后的比较Tab 4 Comparison of different scoring systems in predicting SAP and prognosis

图1 不同评分预测SAP的ROC曲线;图2 不同评分预测AP局部并发症ROC曲线;图3 不同评分预测AP全身并发症ROC曲线;图4 不同评分预测AP死亡的ROC曲线Fig 1 ROC curves of SAP with different scoring systems; Fig 2 ROC curves of local complications of AP with different scoringsystems; Fig 3 ROC curves of AP complications in different scoring systems; Fig 4 ROC curves of AP complications in differentscoring systems
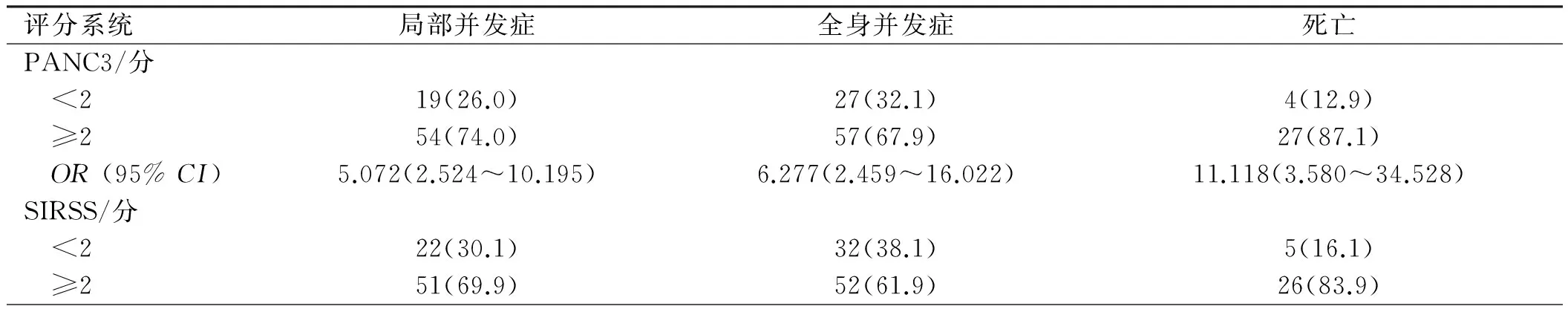
评分系统局部并发症全身并发症死亡PANC3/分 <219(26.0)27(32.1)4(12.9) ≥254(74.0)57(67.9)27(87.1) OR(95%CI)5.072(2.524~10.195)6.277(2.459~16.022)11.118(3.580~34.528)SIRSS/分 <222(30.1)32(38.1)5(16.1) ≥251(69.9)52(61.9)26(83.9)
续表5
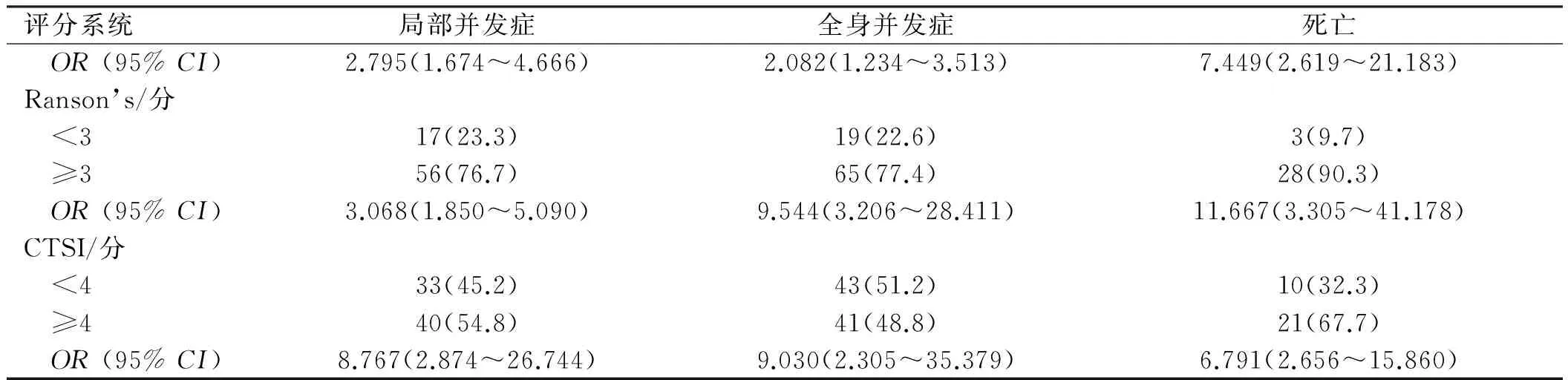
评分系统局部并发症全身并发症死亡 OR(95%CI)2.795(1.674~4.666)2.082(1.234~3.513)7.449(2.619~21.183)Ranson’s/分 <317(23.3)19(22.6)3(9.7) ≥356(76.7)65(77.4)28(90.3) OR(95%CI)3.068(1.850~5.090)9.544(3.206~28.411)11.667(3.305~41.178)CTSI/分 <433(45.2)43(51.2)10(32.3) ≥440(54.8)41(48.8)21(67.7) OR(95%CI)8.767(2.874~26.744)9.030(2.305~35.379)6.791(2.656~15.860)
3 讨论
Ranson’s评分于1974年由RANSON等[9]提出,评分≥3分提示SAP。VALVERDE-LPEZ等[10]发现,Ranson’s评分对判断SAP死亡率及入住ICU的敏感度为100%,在预测持续器官功能衰竭和死亡方面具有较高准确性。本研究也表明,当Ranson’s评分≥3分对预测AP全身并发症的准确度为77.4%、死亡率的准确度为90.3%,AUC值分别为0.896、0.885,约登指数分别为0.660、0.693,均高于其他评分。但该评分缺点为:所含指标过多,需48 h获得,不能在急诊科发挥时效性[11-12]。尽管如此,Ranson评分仍是国内外和大多数指南所推荐的经典评分。
CT严重程度指数评分(computed tomography severity index,CTSI)作为国际常用评分,由BALTHAZAR等[13]于1990年将Balthazar CT分级与胰腺自身坏死联系起来提出的,是诊断胰腺坏死和胰周渗出的金标准,属于无创检查,可动态观察。YANG等[14]研究发现,CTSI对预测AP局部并发症AUC值(0.791)、敏感度(68%)、特异度(90%)有显著优势,但对预测SAP及死亡率方面诊断价值较弱。本研究表明,该评分对判断局部并发症方面具有高敏感度(87.7%)和高特异度(93.7%),AUC值(0.924)和约登指数(0.814)高于其他评分,具有显著诊断价值,但对死亡率的预测不如Ranson’s评分。胰周坏死和假性囊肿形成多数不在AP发病初期,仍需48 h评估,且增强CT使用造影剂会加重肾损伤[15],不利于SAP早期识别。
PANC-3评分是2007年由BROWN等提出[16],评分包括:血清红细胞比容(HCT)>44 mg/dl;体质量指数(BMI)> 30 kg/m2;胸片提示胸腔积液。FUKUDA等[17]的前瞻性研究发现,PANC-3评分对评估SAP的灵敏度为31.25%,特异度为100%;阳性预测值为100%;阴性预测值为81.66%,准确度为83.07%。BEDUSCHI等[18]指出,胸腔积液为评分中最重要的预测因子,还提出该评分与住院时间也有一定相关性。本研究与先前学者的报道相一致,PANC3评分预测SAP的AUC值(0.909)、约登指数(0.703)、敏感度(97.5%),其诊断价值均优于其他评分,且指标构成简单,可24 h内快速作出预判。相比Ranson’s及CTSI评分无论在操作性及时效性上均有明显优势,但该评分运用较少,其临床价值还有待更大样本、多临床中心研究进一步验证。
无害性急性胰腺炎评分(harmless acute pancreatitis score,HAPS)指标包括:无反跳痛和肌紧张;血细胞比容正常(男性>43 mg/dl,女性>39. 6 mg/dl为异常);血肌酐正常(异常>177 mmol/L)3个指标,若3项均无异常视为无害。与其他评分最大的区别在于,HAPS评分能快速识别非SAP患者,及时分类干预治疗[19-20]。AL-QAHTANI等[21]研究发现,HAPS评分24 h内对预测MAP准确度为87%。本研究也表明,HAPS评分与SAP无相关性,它对预测MAP准确度为90.5%,与国外学者的结论相一致。在临床工作中还应具体结合患者体征变化和更多实验室检查综合判断。
SIRSS基于AP的基本病理变化,早期胰腺组织充血水肿、损伤、坏死释放的生物活性物质导致SIRS[22],当超过机体抗炎能力,不能被及时清除,又被吸收入血,触发瀑布效应(Cascade Effect),炎症逐级扩大,最终出现多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[23-24]。KUMAR等[25]提出,SIRSS评分在AP发病第3天预测持续新器官衰竭的准确度为80%。本研究发现,SIRSS评分对预测SAP的AUC值(0.908)诊断价值高于Ranson’s评分AUC值(0.872)、CTSI评分AUC值(0.894),且指标构成简单,可为临床推广。
本次研究为回顾性研究,因病例样本有限,来源仅局限于本院;数据分析中采用先确定约登指数,再确定最佳截止点的方法;在统计上可能存在偏倚,得出的结论仍需临床大规模多中心实验来验证其准确性、可行性[26-27]。目前尚无任何单一评分系统能够覆盖AP诊治的全过程,临床上除了参考生化、影像学结果,应与患者症状体征密切结合。我们只有熟知各评分系统特点,才能早期做出预判,指导AP治疗。
[1] LEE K J, KIM H M, CHOI J S, et al. Comparison of predictive systems in severe acute pancreatitis according to the Revised Atlanta Classification [J]. Pancreas, 2016, 45(1): 46-50.
[2] HADDAD J D. Acute pancreatitis [J]. N Engl J Med, 2017, 376(6): 597. DOI: 10.1056/NEJMc1616177.
[3] 杜奕奇. 2013年中国急性胰腺炎诊治指南解读[J]. 中国实用内科杂志, 2014, 34(9): 859-861. DOI: 10.7504/nk2014080201.
DU Y Q. The interpretation of the new China guideline on acute pancreatitis [J]. Chinese Journal of Practical Internal Medicine, 2014, 34(9): 859-861. DOI: 10.7504/nk2014080201.
[4] THOMSON A. Call for subcategory of severe acute pancreatitis:“Fulminant Acute Pancreatitis”[J]. Crit Care Med, 2017, 45(2): e241-e242. DOI: 10.1097/CCM.0000000000002161.
[5] 杨荣萍, 廖旭, 胡元佳, 等. 新亚特兰大分类下生化指标预测急性胰腺炎严重度的价值[J]. 胃肠病学和肝病学杂志, 2016, 25(8): 899-902. DOI: 10.3969/j.issn: 1006-5709.2016.08.017.
YANG R P, LIAO X, HU Y J, et al. Biochemical factors in evaluating the severity of acute pancreatitis based on revised Atlanta classification [J]. Chin J Gastroenterol Hepatol, 2016, 25(8): 899-902. DOI: 10.3969/j.issn: 1006-5709.2016.08.017.
[6] ZUBIA-OLASKOAGA F, MARAVI-POMA E, URRETA-BARALLOBRE I, et al. Comparison between Revised Atlanta Classification and determinant-based classification for acute pancreatitis in Intensive Care Medicine. Why do not use a mdified determinant-based classification? [J]. Crit Care Med, 2016, 44(5): 910-917. DOI:10.1097/CCM.0000000000001565.
[7] ZHU Y, PAN X, ZENG H, et al. A study on the etiology, severity, and mortality of 3260 patients with acute pancreatitis according to the Revised Atlanta Classification in Jiangxi, China over an 8-year period [J]. Pancreas, 2017, 46(4): 504-509. DOI: 10.1097/MPA.0000000000000776.
[8] 刘玉珍, 吕志武. 重症急性胰腺炎临床治疗的研究进展[J]. 胃肠病学和肝病学杂志, 2017, 26(5): 589-593. DOI: 10.3969/j.issn: 1006-5709.2017.05.030.
LIU Y Z, LYU Z W. The progress of clinical treatment of severe acute pancreatitis [J]. Chin J Gastroenterol Hepatol, 2017, 26(5): 589-593. DOI: 10.3969/j.issn: 1006-5709.2017.05.030.
[9] RANSON J H, RIFKIND K M, ROSES D F, et al. Objective early identification of severe acute pancreatitis [J]. Am J Gastroenterol, 1974, 61(6): 443-451.
[10] VALVERDE-LPEZ F, MATAS-COBOS A M, ALEGRIA-MOTTE C, et al. BISAP, RANSON, lactate and others biomarkers in prediction of severe acute pancreatitis in a European cohort [J]. J Gastroenterol Hepatol, 2017, 32(9): 1649-1656.DOI:10.111yjgh.13763.
[11] 张映媛, 黄华. 急性胰腺炎评分系统的应用及研究进展[J]. 胃肠病学和肝病学杂志, 2017, 26(5): 594-597. DOI: 10.3969/j.issn: 1006-5709. 2017. 05. 031.
ZHANG Y Y, HUANG H. Application and research progress of scoring systems of acute pancreatitis [J]. Chin J Gastroenterol Hepatol, 2017, 26(5): 594-597. DOI: 10.3969/j.issn: 1006-5709. 2017. 05. 031.
[12] TSUJI Y, TAKAHASHI N, ISODA H, et al. Early diagnosis of pancreatic necrosis based on perfusion CT to predict the severity of acute pancreatitis [J]. J Gastroenterol, 2017, 52(10): 1130-1139. DOI: 10.1007/s00535-017-1330-5.
[13] BALTHAZAR E J, ROBINSON D L, MEGLBOW A J, et al. Acute pancreatitis: value of CT in establishing prognosis [J]. Radiology, 1990, 174(2): 331-336. DOI: 10.1148/radiology.174.2.2296641.
[14] YANG L, LIU J, XING Y, et al. Comparison of BISAP, Ranson, MCTSI, and APACHE II in predicting severity and prognoses of hyperlipidemic acute pancreatitis in Chinese patients [J]. Gastroenterol Res Pract, 2016, 2016:1834256. DOI: 10.1155/2016/1834256.
[15] KARAGOZ A, UNLUER E E, OYAR O, et al. The ability of emergency physicians to diagnose and score acute pancreatitis on computed tomography [J]. Eur J Trauma Emerg Surg, 2016, 43(3):287-292. DOI: 10.1007/s00068-016-0743-9.
[16] BROWN A, JAMES-STEVENSON T, DYSON T, et al. The panc 3 score: a rapid and accurate test for predicting severity on presentation in acute pancreatitis [J]. J Clin Gastroenterol, 2007, 41(9): 855-858. DOI: 10.1097/01.mcg.0000248005.73075. e4.
[17] FUKUDA J K, FRANZON O, RESENDE FILHO FDE O, et al. Prognosis of acute pancreatitis by PANC 3 score [J]. Arq Bras Cir Dig, 2013, 26(2): 133-135.
[18] BEDUSCHI M G, MELLO A L, VON-MUHLEN B, et al. The panc 3 score predicting severity of acute pancreatitis [J]. Arq Bras Cir Dig, 2016, 29(1): 5-8. DOI: 10.1590/0102-6720201600010002.
[19] ANKISCH P G, WEBER-DANY B, HEBEL K, et al. The harmless acute pancreatitis score: a clinical algorithm for rapid initial stratification of nonsevere disease [J]. Clin Gastroenterol Hepatol, 2009, 7(6): 702-705. DOI: 10.1016/j.cgh.2009.02.020.
[20] JIN Z, XU L, WANG X, et al. Risk factors for worsening of acute pancreatitis in patients admitted with mild acute pancreatitis [J]. Med Sci Monit, 2017, 23: 1026-1032.
[21] AL-QAHTANI H H, ALAM M K H, WAHEED M. Comparison of harmless acute pancreatitis score with Ranson’s score in predicting the severity of acute pancreatitis [J]. Coll Physicians Surg Pak, 2017, 27(2): 75-79.
[22] 李敏利, 吕莉慧, 张晓华, 等. 降钙素原及炎症指标在急性胰腺炎早期的临床价值研究[J]. 胃肠病学和肝病学杂志, 2016, 25(8): 896-898. DOI: 10.3969/j.issn: 1006-5709.2016.08.016.
LI M L, LV L H, ZHANG X H, et al. The clinical value of procalcitonin and inflammatory cytokines in acute pancreatitis [J]. Chin J Gastroenterol Hepatol, 2016, 25(8): 896-898. DOI: 10.3969/j.issn: 1006-5709.2016.08.016.
[23] DUMNIKA P, MADUZIA D, CERANOWICZ P, et al. The interplay between inflammation, coagulation and endothelial injury in the early phase of acute pancreatitis: clinical implications [J]. Int J Mol Sci, 2017, 18(2): E354. DOI: 10.3390/ijms18020354.
[24] LI Y, ZHAO Y, FENG L, et al. Comparison of the prognostic values of inflammation markers in patients with acute pancreatitis: a retrospective cohort study [J]. BMJ Open, 2017, 7(3): e013206. DOI: 10.1136/bmjopen-2016-013206.
[25] KUMAR A, CHARI S T, VEGE S S. Can the time course of systemic inflammatory response syndrome score predict future organ failure in acute pancreatitis? [J]. Pancreas, 2014, 43(7): 1101-1105. DOI: 10.1097/MPA.0000000000000170.
[26] KOKSAL A S, EMINLER A T, PARLAK E. How to predict the severity of acute pancreatitis? An ongoing debate [J]. Turk J Gastroenterol, 2017, 28(3): 229. DOI: 10.5152/tjg.2017.17027.
[27] STIGLIANO S, STERNBY H, DE MADAEIA E, et al. Early management of acute pancreatitis: a review of the best evidence [J]. Dig Liver Dis, 2017, 49(6): 585-594. DOI: 10.1016/j.dld.2017.01.168.
