利用TCGA数据库分析miR-196b在结直肠癌患者中的临床表达特征并探索miR-196b的体外抗5-FU作用*
2018-01-19黄兰兰杨湘玲刘焕亮
车 佳, 黄兰兰, 娄 琼, 杨湘玲△, 刘焕亮△
(中山大学附属第六医院 1广东省胃肠病学研究所, 2检验科, 广东 广州 510655)
结直肠癌(clolrectal cancer,CRC)是常见的恶性肿瘤之一[1-2]。2016年的中国癌症报告表明,2012年结直肠癌患者新增人数达33万,占恶性肿瘤发病人数的9.24%,居第4位,死亡人数达16万[3]。微小RNA(microRNA,miRNA,miR)是一类长度约为21~25个核苷酸的内源性非编码小分子单链RNA,具有高度保守的特性,不直接参与编码蛋白质,但却可以与靶mRNA的3’端非翻译区(3’-untranslated region,3’UTR)结合,通过调节其靶基因的表达进而发挥重要作用[4]。miR-196家族包括miR-196a-1、miR-196a-2和miR-196b,其中, miR-196a-1和miR-196a-2参与多种实体瘤的发生和进展,如乳腺癌[5]、骨肉瘤[6]、结直肠癌[7]、口腔癌[8]、恶性胶质瘤[9]及胃癌[10]; miR-196b位于第7号染色体上(7p15.2),处于HOXA9和HOXA10基因之间进化高度保守的区域内[11]。为探索miR-196b在结直肠癌患者中的表达水平和临床意义以及其与CRC临床一线用药5-氟尿嘧啶(5-fluorouracil,5-FU)敏感性的关系,我们在癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中下载结直肠癌miRNA测序数据及其对应的临床病理资料,运用SPSS 17.0分析miR-196b在结直肠癌患者中的表达水平及相对应的临床特征。 同时采用瞬时转染的方法在结直肠癌细胞株HCT116中过表达miR-196b,探索过表达miR-196b的HCT116细胞对5-FU敏感性的变化,为下一步研究miR-196b在结直肠癌中的调控机制奠定基础。
材 料 和 方 法
1 实验材料
人源结直肠癌细胞株HCT116来自美国模式培养物集存库(American Type Culture Collection, ATCC)。RPMI-1640培养基和胎牛血清 (Gibco);Lipofectamine 3000(Thermo Fisher Scientific);Mir-X miRNA First-Strand Synthesis Kit、Mir-X miRNA qRT-PCR SYBR®Kit和SYBR®Premix Ex TaqTMII (TaKaRa);miR-196b mimics和miRNA NC(上海吉玛制药技术有限公司);5-FU(Sigma)。 Bio-Rad T100TMPCR仪(Thermal Cycler);System Light Cycler®96荧光定量PCR 仪(Roche);全波长多功能酶标仪(Thermo)。
2 方法
2.1采用瞬时转染的方法建立过表达miR-196b的HCT116细胞并测定转染效率 取对数生长期的细胞,按照常规方法对细胞进行消化、传代和计数,按每孔2.5×105细胞接种至6孔板,加入2 mL完全培养基,细胞培养箱内培养过夜。第2天取出6孔板,在显微镜下确认细胞贴壁生长后,弃去培养基,先更换成1.5 mL没有加入抗生素的培养基,分别取20 mmol/L的miR-196b mimics和miRNA NC 5 ~10 μL,加入到125 μL无血清Opti-MEM培养基中;同时,另取125 μL的Opti-MEM培养基加入一只新的离心管,稀释3.75 μL Lipofectamine 3000,轻吹混匀。将以上配好的2种试剂混合,轻吹混匀,在室温条件下静置5~10 min, 把上面形成的脂质体混合物加入6孔板,轻轻摇晃并置于培养箱内培养。关于转染效率的测定,我们采用以上方法把带有荧光基团FAM标记的miR-196b mimics和 miRNA NC转染至HCT116细胞中,在转染后的6 h和12 h,取出培养皿至荧光显微镜下用高倍镜观察,随机选取视野进行拍照计数,计算转染效率。
2.2过表达 miR-196b的细胞总RNA的提取 将培养皿取出置于超净台,弃去培养基,再用PBS洗1次,加入1 mL TRIzol试剂, 于室温放置3~5 min后转移到1.5 mL的离心管中。每支离心管加入200 μL氯仿,充分振荡混合后,室温放置10 min。4 ℃、12 000 r/min离心15 min,将约400 μL上层清液转移入新的离心管中,加入等量的异丙醇,轻柔混匀,室温放置10 min,4 ℃、12 000 r/min 离心10 min。小心去上清,保留离心管底部的白色团块,用DEPC处理水配制的75%乙醇洗涤。4 ℃、7 500 r/min离心5 min,弃上清。室温自然风干,待白色团块变为无色透明后,用DEPC处理水溶解, NanoDrop测RNA浓度。
2.3采用real-time PCR检测miR-196b的表达 本实验使用加尾法检测 miR-196b的表达水平,其中5’ 端引物为5’-AGGTAGTTTCCTGTTGTTGGG-3’,mRQ 3’ 端引物及U6引物为该公司商业引物。按照Mir-X miRNA First-Strand Synthesis Kit的说明配制10 μL逆转录反应体系:mRQ Buffer(2×) 5 μL、RNA sample (0.25~8 μg) 3.75 μL和mRQ Enzyme 1.25 μL,逆转录反应条件为37 ℃ 1 h, 85 ℃ 5 min。逆转录得到的cDNA用ddH2O按照1∶10稀释。miR-196b的荧光定量PCR反应体系为: ddH2O 9.5 μL、SYBR Advantage Premix (2×) 12.5 μL、miRNA-specific primer (10 μmol/L) 0.5 μL、mRQ 3’ primer 0.5 μL和cDNA 2.0 μL;反应条件为 95 ℃ 预变性30 s,95 ℃ 变性5 s, 60 ℃ 退火30 s。U6反应体系为ddH2O 9.5 μL、SYBR Advantage Premix (2×) 12.5 μL、U6 forward primer (10 μmol/L) 0.5 μL、U6 reverse primer (10 μmol/L) 0.5 μL和cDNA 2.0 μL,反应条件同miR-196b。以U6为内参照,NC组为对照组,miR-196b组为实验组,计算基因差异表达的倍数,计算公式为2-ΔΔCt,其中ΔCt = Ct目的基因-Ct内参照基因, ΔΔCt = ΔCt实验组-ΔCt对照组。
2.4采用MTS法检测细胞对5-FU的敏感性 分别取转染miR-196b mimics和miRNA NC的细胞,按照常规方法对细胞进行消化、传代和计数,调整细胞密度,每孔2×103接种到96孔板中,培养细胞过夜。次日,按照需要把5-FU用培养基稀释成不同的浓度梯度,每个浓度做3个复孔,滴加于接种有细胞的96孔板里。在培养箱里放置72 h后,每孔加入10 μL WST-1,37 ℃静置10~30 min,待完全溶解后,用全波长多功能酶标仪在波长为450nm处测定样品的吸光度(A)值,进一步计算细胞存活率。
3 统计学处理
数据处理统一使用SPSS 17.0统计软件。计量资料以均数±标准差(mean±SD)表示。运用 Shapiro-Wilk法检测miR-196b表达水平的分布情况,如果符合正态分布,采用参数检验方法分析miR-196b表达水平和结直肠癌临床病理参数的关系;如果不符合正态分布,则运用Wilcoxon秩和检验(二分类变量)。使用中位数作为miR-196b表达水平高低的分界值。采用Kaplan-Meier法建立miR-196b的生存曲线,Log-rank检验比较miR-196b表达水平不同的患者生存曲线的差异及意义;采用COX回归法分析miR-196b与其它临床参数对结直肠癌患者预后的影响;采用卡方检验分析miR-196b的表达水平和其它临床参数的相互关系;采用单因素方差分析过表达miR-196b的HCT116细胞在不同5-FU浓度下细胞存活率的统计学差异。以P<0.05为差异有统计学意义。
结 果
1 miR-196b在结直肠癌患者中的表达与临床特征的相关性
利用统计软件SPSS 17.0对miR-196b在结直肠癌患者中的表达情况进行分析,结果显示, miR-196b的表达水平与直肠癌的淋巴结转移(P=0.045)、 TNM分期(P=0.043)及结肠癌的局部浸润相关(P=0.028),见表1、 2。
用Shapiro-Wilk法检测直肠癌患者中有淋巴结转移(N1+N2)和无淋巴结转移(N0)两组患者miR-196b表达水平的分布情况,结果显示不符合正态分布,故采用Wilcoxon秩和检验对两个独立样本进行分析,发现miR-196b的表达水平与淋巴结转移相关(P=0.020),N1+N2期miR-196b的表达水平高于N0期,即miR-196b在有淋巴结转移的组织中表达量升高,见图1。在直肠癌患者的TNM分期中,我们发现I+II期和III+IV期患者间miR-196b表达水平的差异也有统计学意义,III+IV期的直肠癌患者miR-196b的表达水平高于I+II期患者(P=0.018),见图2。
表1miR-196b在直肠癌中的临床表达特征
Table 1. Clinical characteristics of miR-196b in 158 rectal cancer patients
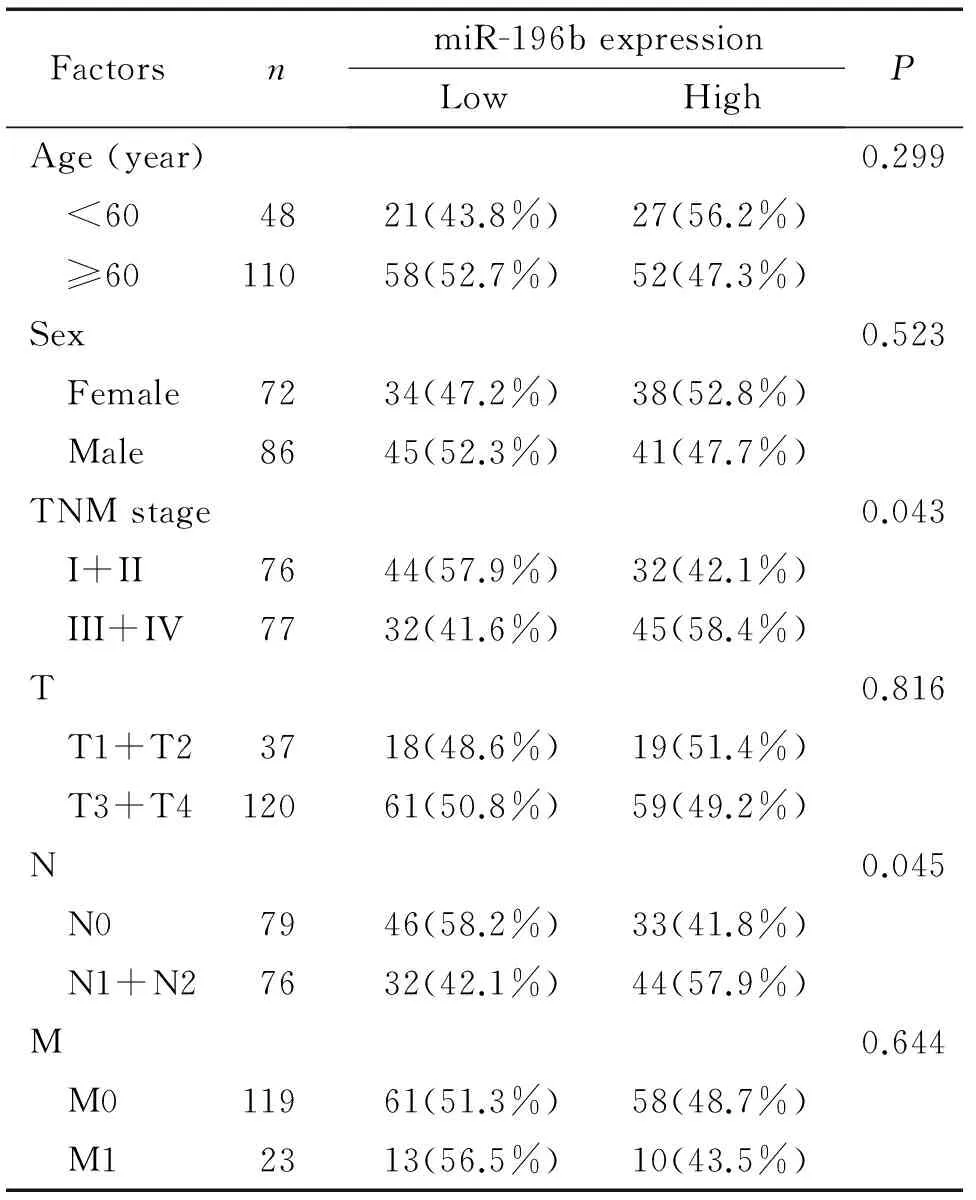
FactorsnmiR-196bexpressionLowHighPAge(year)0.299 <604821(43.8%)27(56.2%) ≥6011058(52.7%)52(47.3%)Sex0.523 Female7234(47.2%)38(52.8%) Male8645(52.3%)41(47.7%)TNMstage0.043 I+II7644(57.9%)32(42.1%) III+IV7732(41.6%)45(58.4%)T0.816 T1+T23718(48.6%)19(51.4%) T3+T412061(50.8%)59(49.2%)N0.045 N07946(58.2%)33(41.8%) N1+N27632(42.1%)44(57.9%)M0.644 M011961(51.3%)58(48.7%) M12313(56.5%)10(43.5%)
表2miR-196b在结肠癌中的临床表达特征
Table 2. Clinical characteristics of miR-196b in 407 colon cancer patients
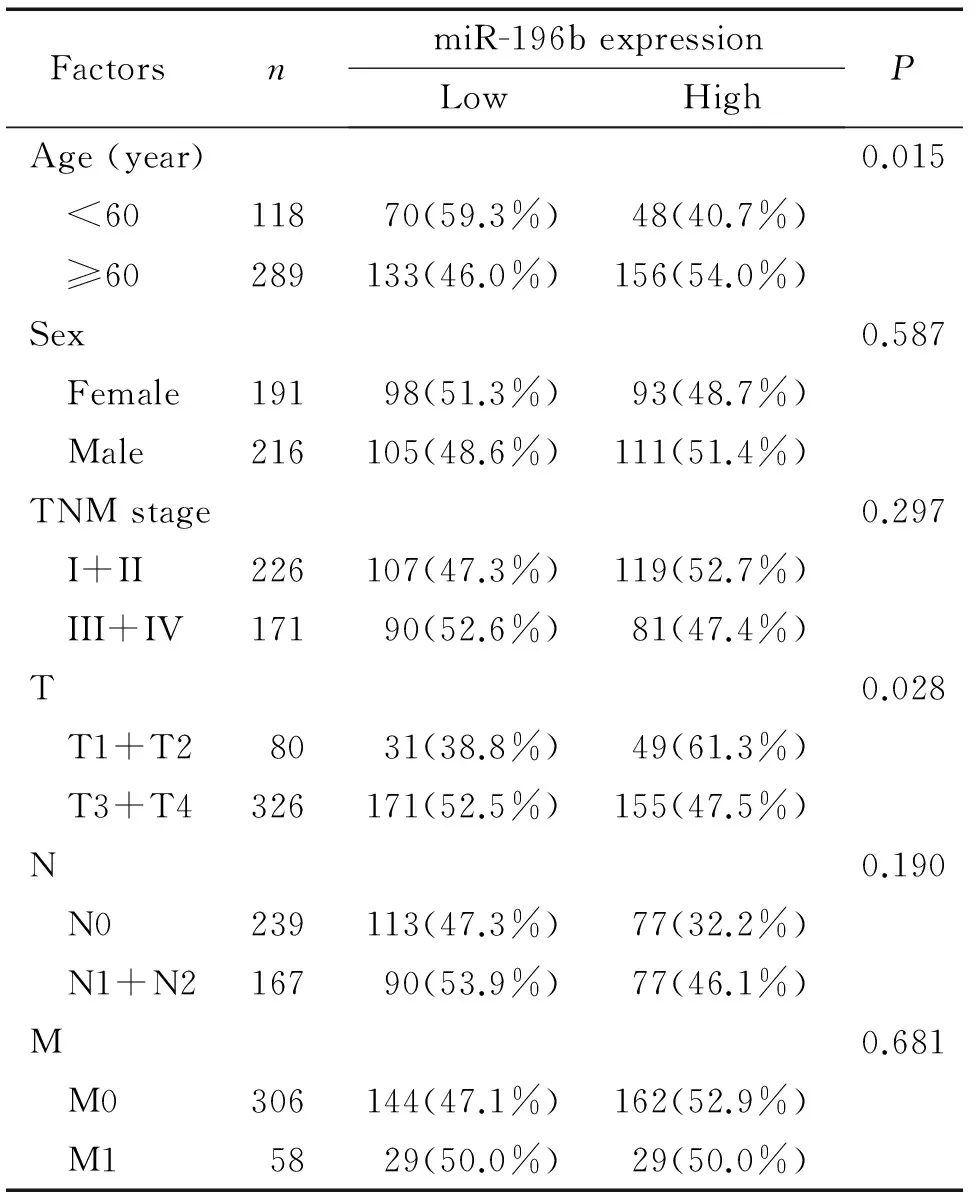
FactorsnmiR-196bexpressionLowHighPAge(year)0.015 <6011870(59.3%)48(40.7%) ≥60289133(46.0%)156(54.0%)Sex0.587 Female19198(51.3%)93(48.7%) Male216105(48.6%)111(51.4%)TNMstage0.297 I+II226107(47.3%)119(52.7%) III+IV17190(52.6%)81(47.4%)T0.028 T1+T28031(38.8%)49(61.3%) T3+T4326171(52.5%)155(47.5%)N0.190 N0239113(47.3%)77(32.2%) N1+N216790(53.9%)77(46.1%)M0.681 M0306144(47.1%)162(52.9%) M15829(50.0%)29(50.0%)
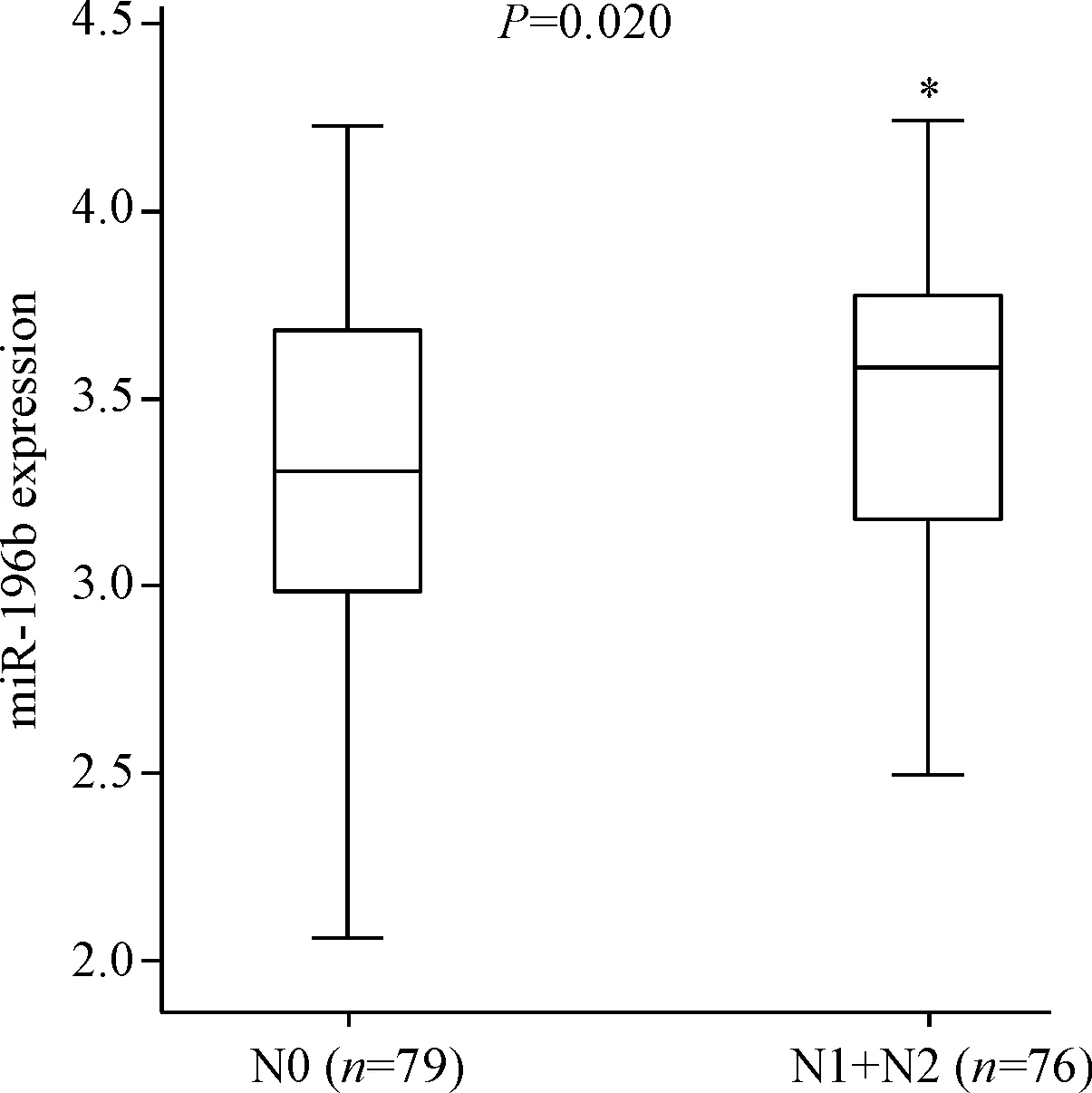
Figure 1. The correlation between miR-196b expression and lymph node metastasis. Median (interquartile range).*P<0.05vsN0 group.
图1miR-196b在结直肠癌组织中的表达水平与淋巴结转移的关系
2 miR-196b在结直肠癌患者中的表达与生存状况的关系
在SPSS 17.0中运用COX 回归法分析患者的临床信息即年龄、性别、TNM分期以及miR-196b的表达水平是否是患者生存状况的影响因素。对于直肠癌患者,TNM分期中的淋巴结转移(P=0.010)和远处转移(P=0.017)是患者生存状况的影响因素,而miR-196b的表达与患者生存无关,见表3。对miR-196b的表达水平以中位值进行高低分组后,运用Kaplan-Meier法对2组直肠癌患者的生存曲线进行比较,发现高表达组和低表达组的生存曲线差异无统计学意义(P=0.966),见图3。
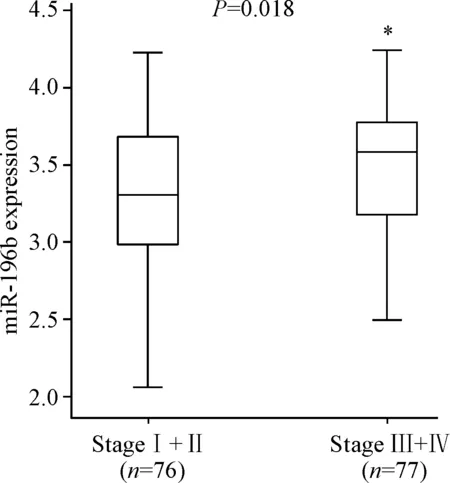
Figure 2. The correlation between miR-196b expression and TNM stage.Median (interquartile range).*P<0.05vsstage I+II group.
图2miR-196b在结直肠癌组织中的表达水平与TNM分期的关系
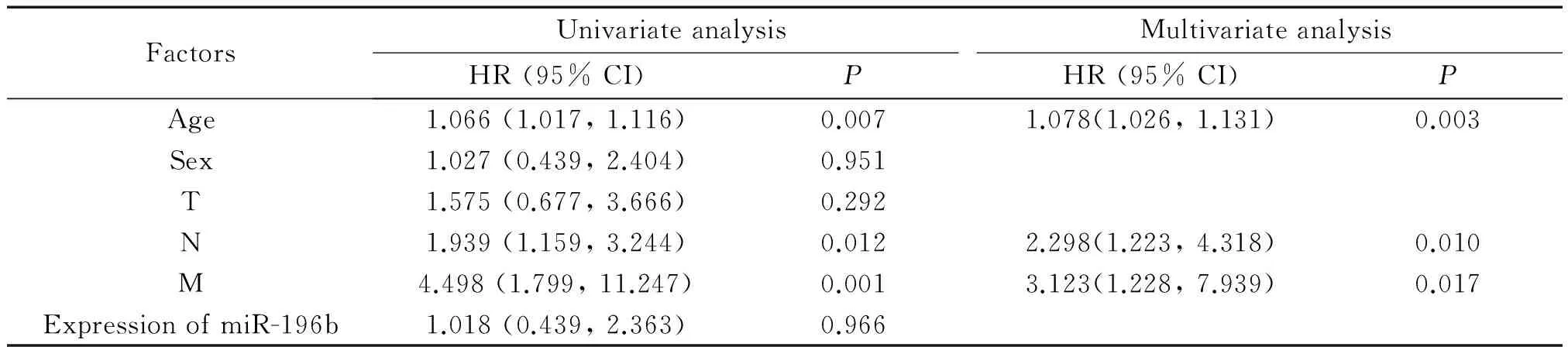
表3 影响158例直肠癌患者生存状况的危险因素分析
HR: hazard ratio; CI: confidence interval.
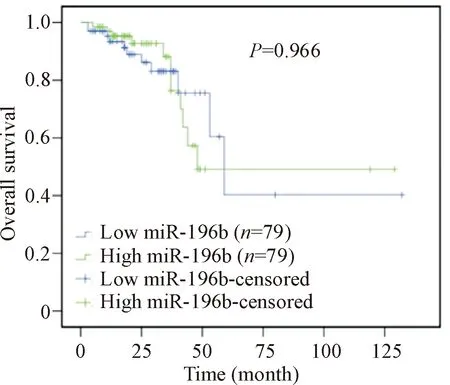
Figure 3. Kaplan-Meier survival analysis in 158 CRC patients.
图3miR-196b的表达水平与结直肠癌患者的生存关系
3 过表达miR-196b
为研究miR-196b在结直肠癌细胞中的生物学功能,我们在结直肠癌细胞株HCT116中分别瞬时转染miR-196b mimics和miRNA NC,和对照组相比,过表达组的miR-196b表达水平明显升高,表明过表达成功,见图4。
4 miR-196b促进结直肠癌细胞对5-FU的抗药性
为了检测miR-196b在结直肠癌细胞中对5-FU作用的影响,我们进行了药物敏感性实验。对转染了miR-196b mimics和miRNA NC的HCT 116细胞进行梯度浓度5-FU处理,培养72 h后,利用MTS检测细胞的存活率,可见过表达miR-196b的细胞存活率明显高于对照组(P<0.05),表明过表达miR-196b的细胞具有更强的抗药性,见图5。
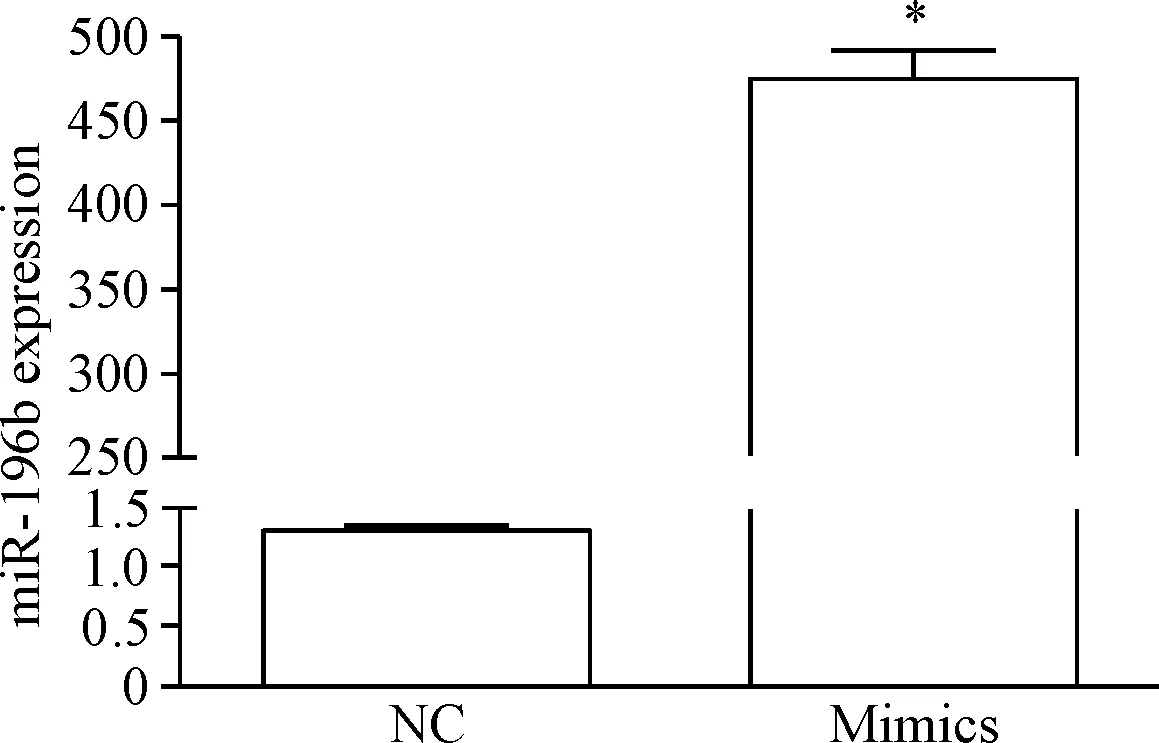
Figure 4. Overexpression of miR-196b in HCT116 cells. Mean±SD.n=6.*P<0.05vsNC group.
图4在HCT116细胞中过表达miR-196b
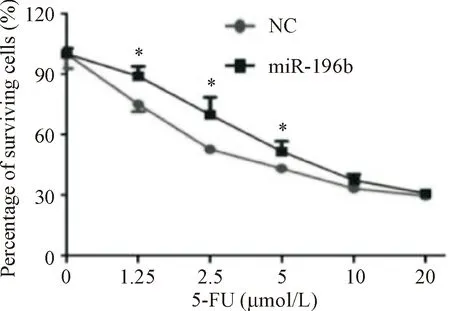
Figure 5. Overexpression of miR-196b increased 5-FU resistance of CRC cells. Mean±SD.n=3.*P<0.05vsNC group.
图5过表达miR-196b促进结直肠癌细胞对5-FU的耐药性
讨 论
miRNA广泛参与调节各种生理或病理过程,其在肿瘤中异常表达,可参与肿瘤发生、发展和转移的各个阶段,如凋亡、增殖、细胞分化及转移等[12]。已有研究发现, miR-21、miR-19a、miR-422a和miR-499等是结直肠癌复发与转移的潜在标志物[13-14]。为探索miR-196b是否可以作为结直肠癌新的分子生物标志物,我们在TCGA数据库中下载结直肠癌miRNA测序数据及其对应的临床病理资料,研究miR-196b在结直肠癌患者中的表达水平和临床意义以及其与临床一线用药5-FU的敏感性的关系。
TCGA计划是由美国国立卫生研究院组织美国国立癌症研究所和国立人类基因组研究所于2006年启动的大型研究,旨在全面系统性地了解恶性肿瘤的形成、生长和转移的生物学基础和病理机制相关的基因组变化,以促进癌症的早期诊断,加快治疗癌症的步伐,并进一步预防癌症。TCGA 计划的大部分数据和研究结果都公开在其网站上,可以免费下载。迄今为止,已有多篇论文在国际知名期刊上发表[15-16]。我们在TCGA数据库中下载结直肠癌的miRNA测序数据及其对应的临床病理资料后分析发现,158例直肠癌患者miR-196b的表达水平与TNM分期有显著的相关性,再进一步细化分期时,即对T、N和M三个分期分别来讨论分析时发现, miR-196b与淋巴结转移密切相关,有淋巴结转移的患者miR-196b的表达水平显著高于无淋巴结转移患者。2013年, 兰鸿波等[17]收集了30例结直肠癌患者手术后结直肠癌组织及其对应的正常黏膜组织,运用荧光定量 PCR 技术检测 miR-196b 的表达水平,结果显示miR-196b的表达与结直肠癌的淋巴结转移、肿瘤分期及远处转移均有关,而与肿瘤部位、大小、大体类型、浸润深度、组织分化程度、患者的年龄及性别无关, 与我们的分析结果相一致。综上所述,我们推测miR-196b与结直肠癌的侵袭和迁移能力相关,然而其具体的作用机制还需要进一步探索。
在生存分析中, miR-196b不是结直肠癌患者的独立预后因子,这一点与已有的研究相似,有研究发现, miR-196b与miR-196a共同作为消化道肿瘤发生发展的分子标记物,两者表达水平呈正相关关系,预测生存结局的特异性和灵敏度都比任何单独一个要高得多[5, 7]。这种多个基因协同发挥致癌或抑癌作用的机制并不罕见,很多功能有相似性的基因相辅相成,Li等[18]报道在肺癌的研究中建立一个由8种miRNAs(含有miR-196b)联合预测模型,该预测模型能够很好地预测肺腺癌患者的预后。据此,我们推测miR-196b可能与多个miRNA协同参与结直肠癌的进展。
研究显示, miRNA可参与影响结直肠癌患者对化疗药物的敏感性,与患者的化疗应答密切相关[19]。 因此我们也探讨了miR-196b对结直肠癌的5-FU敏感性的影响。 结果显示, 过表达miR-196b可降低结直肠癌细胞对5-FU的敏感性,表明miR-196b可能与结直肠癌的化疗耐药相关。Svoboda等[19]在2012年的研究中发现miR-196b的表达与胸苷合成酶(thymidylate synthetase,TS)抑制剂的化疗抵抗性之间存在着潜在的联系。TS是胸腺嘧啶在合成过程中非常重要的酶,又是5-FU作为抗肿瘤代谢药物在发挥作用时的关键酶,这说明miR-196b可能与5-FU代谢相关的酶之间存在着潜在的关系,而miR-196b是如何参与到5-FU的代谢途径中、miR-196b的表达跟5-FU相关的代谢酶之间存在着什么样的关系还需要我们进一步探索。
本研究运用现有的 TCGA 数据库,通过分析肿瘤基因组信息了解肿瘤的发生发展机理,进一步发现肿瘤标志物和药物作用基因靶点,可为癌症的精准诊断和治疗提供支撑。在miRNA水平对结直肠癌相关的测序数据和临床病理数据进行了挖掘,发现miR-196b可能和结直肠癌的侵袭和迁移有关,并与5-FU的化疗敏感性相关,对今后miR-196b参与结直肠癌的分子机制及预后研究有一定的理论指导意义。
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1):7-30.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[3] Chen W, Zheng R, Zuo T, et al. National cancer incidence and mortality in China, 2012[J]. Chin J Cancer Res, 2016, 28(1):1-11.
[4] Yong SL, Dutta A. MicroRNAs in cancer[J]. Annu Rev Pathol, 2009, 4(4):199-227.
[5] Li Y, Zhang M, Chen H, et al. Ratio of miR-196s to HOXC8 messenger RNA correlates with breast cancer cell migration and metastasis[J]. Cancer Res, 2010, 70(20):7894-7904.
[6] Zhang C, Yao C, Li H, et al. Combined elevation of microRNA-196a and microRNA-196b in sera predicts unfavorable prognosis in patients with osteosarcomas[J]. Int J Mol Sci, 2014, 15(4):6544-6555.
[7] Ge J, Chen Z, Li R, et al. Upregulation of microRNA-196a and microRNA-196b cooperatively correlate with aggressive progression and unfavorable prognosis in patients with colorectal cancer[J]. Cancer Cell Int, 2014, 14(1):128.
[8] Lu YC, Chang JT, Huang YC, et al. Combined determination of circulating miR-196a and miR-196b levels produces high sensitivity and specificity for early detection of oral cancer[J]. Clin Biochem, 2015, 48(3):115-121.
[9] Guan Y, Mizoguchi M, Yoshimoto K, et al. MiRNA-196 is upregulated in glioblastoma but not in anaplastic astrocytoma and has prognostic significance[J]. Clin Cancer Res, 2010, 16(16):4289-4297.
[10] Tsai MM, Wang CS, Tsai CY, et al. MicroRNA-196a/-196b promote cell metastasis via negative regulation of radixin in human gastric cancer[J]. Cancer Lett, 2014, 351(2):222-231.
[11] Popovic R, Riesbeck LE, Velu CS, et al. Regulation of miR-196b by MLL and its overexpression by MLL fusions contributes to immortalization[J]. Blood, 2009, 113(14):3314-3322.
[12] Ambros V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006):350-355.
[13] Menéndez P, Padilla D, Villarejo P, et al. Prognostic implications of serum microRNA-21 in colorectal cancer[J]. J Surg Oncol, 2013, 108(6):369-373.
[14] Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer[J]. Nature, 2012, 487(7407):330-337.
[15] Cope L, Wu RC, Shih IeM, et al. High level of chromosomal aberration in ovarian cancer genome correlates with poor clinical outcome[J]. Gynecol Oncol, 2013, 128(3):500-505.
[16] Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours[J]. Nature, 2012, 490(7418):61-70.
[17] 兰鸿波, 潘 志, 卢星榕, 等. miR-196b mRNA和HoxB8 mRNA在结直肠癌组织中的表达及临床意义[J].中国普外基础与临床杂志, 2013, 20(4):400-405.
[18] Li X, Shi Y, Yin Z, et al. An eight-miRNA signature as a potential biomarker for predicting survival in lung adenocarcinoma[J]. J Transl Med, 2014, 12:159.
[19] Svoboda M, Sana J, Fabian P, et al. MicroRNA expression profile associated with response to neoadjuvant chemoradiotherapy in locally advanced rectal cancer patients[J]. Radiat Oncol, 2012, 7:195.
