DIZE对糖尿病心肌病大鼠心功能的保护作用*
2018-01-19曹新冉王园园王晓琼于诗然
杨 旻, 曹新冉, 王园园, 王晓琼, 于诗然, 董 波△, 高 靖
(1山东中医药大学, 山东 济南 250014; 2山东省立医院心内科, 山东 济南 250021; 3山东中医药大学第二附属医院病理科, 山东 济南 250001)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病的重要并发症之一,其主要病变是心肌纤维化、左室重构及心功能不全,最终进展为心力衰竭,严重者危及生命。多项研究发现, 在糖尿病心肌病的发展过程中,心肌组织中伴有炎症细胞浸润及炎症因子的异常表达。慢性炎症的存在可能通过诱导心肌纤维化和左心室僵硬进一步加剧心功能受损[1-3]。目前认为肾素-血管紧张素系统(renin-angiotesin system,RAS)在糖尿病心肌病的形成和发展中起着重要作用[4]。血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)作为RAS的最新成员,通过水解血管紧张素(angiotensin, Ang)Ⅱ生成Ang-(1-7)对心肌起保护作用[5-6]。本课题组前期研究表明,ACE2过表达能够改善糖尿病性心肌病大鼠的左室重塑和心功能[7]。 最近美国食品药物管理局列出抗锥虫毒素的小分子重氮氨苯脒乙酰甘氨酸盐(diminazene aceturate,DIZE)具有内源性激活ACE2的作用。DIZE作为ACE2的内源性激动剂,提高了ACE2的活性,通过ACE2—Ang-(1-7)—Mas轴对机体起到保护作用[8]。目前,DIZE已被用于多种疾病的研究,但对于糖尿病心肌病的研究相对较少。本研究将探讨DIZE对DCM心功能及炎症反应的影响,从而为临床防治DCM提供新的思路。
材 料 和 方 法
1 动物
健康成年雄性Wistar 大鼠30只,体重200~220 g,由山东大学实验动物中心提供,许可证号为SCXK(鲁)2014-0007。
2 主要试剂与设备
2.1主要药品与试剂 DIZE 购自Fluka; 链脲佐菌素(streptozotocin,STZ)购自Sigma; 抗ACE2抗体购自Abcam;大鼠AngⅡ和Ang-(1-7) 检测试剂盒购自北京冬歌伟业科技有限公司;免疫组化试剂盒和DAB 显色试剂盒购自北京中杉金桥生物技术有限公司;RIPA 裂解液和苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)购自北京索莱宝科技有限公司;Tween-20 和SDS-PAGE凝胶配制试剂盒购自碧云天公司;血糖仪及试纸购自三诺生物传感股份有限公司。
2.2仪器设备 石蜡包埋机(EG1150C)、烘片机(H11220)、石蜡切片机(RM2245)和自动脱水机(TP1020)为Leica产品;光学显微镜(BX-41,OLYMPUS);彩色多普勒超声仪(Sonos 7500,Philips);化学发光仪(Amersham Imager 600,GE);酶标仪(Thermo)。
3 主要方法
3.1DCM模型的建立 将Wistar大鼠随机分为正常对照(normal control,N)组10只和糖尿病组20只。动物适应性喂养1 周后,禁食12 h,糖尿病组大鼠腹腔一次性注射STZ(65 mg/kg),正常对照组注射相同剂量的柠檬酸盐缓冲液。72 h 后监测大鼠血糖,以血糖>16.6 mmol/L 为糖尿病模型动物。普通饲料喂养12 周后,正常组死亡1只,糖尿病组死亡2只。经超声检测在糖尿病组中选出符合糖尿病心肌病的模型,共18只。将18只符合糖尿病心肌病的大鼠随机分成DCM组和DIZE组, 各9只, DIZE组通过渗透性微泵皮下输注DIZE (15 mg·kg-1·d-1),DCM组予以皮下输注等量生理盐水,共4周。干预过程中因并发症或其它原因DCM组与DIZE组各死亡1只大鼠。
3.2动物一般情况的观察 16周末称量各组大鼠体重(body weight,BW)并采用尾尖采血法检测血糖,应用10% 水合氯醛(3 mL/kg)腹腔注射麻醉大鼠后称量体重。心脏采血处死后使用0.9%生理盐水心脏灌注,取心脏并称心重(heart weight, HW),计算心重与体重比(HW/BW, %)。
3.3心功能的测定和心脏形态学观察 16周末检测各组大鼠心脏功能。通过多普勒超声检测左室舒张早期最大血流/二尖瓣心房收缩期最大血流(E/A)、 左室收缩末期内径(left ventricular end-systolic diameter, LVESD)、 左室舒张末期内径(left ventricular end-diastolic diameter, LVEDD)、心脏射血分数(ejection fraction,EF)和左室短轴缩短率(fractional shortening,FS)。将取材完毕后的心肌组织置入4% 多聚甲醛溶液中固定, 48 h 后进行脱水浸蜡、石蜡包埋并制作厚4.5 μm切片,做常规HE 染色和Masson 染色。采用Image-Pro Plus 6.0 软件分析。
3.4免疫组化观察心脏白细胞介素(interleukin,IL)-1、IL-6和结缔组织生长因子(connective tissue growth factor, CTGF)的表达 心脏组织切片经脱蜡至水后经10% EDTA 液微波加热至96 ℃,维持温度20 min进行抗原修复,自然复温后使用3%过氧化氢去除内源性过氧化物酶,并用山羊血清37 ℃封闭0.5 h。封闭后分别加入抗IL-1、IL-6和CTGF抗体(1∶200) 4 ℃ 孵育过夜,滴加Ⅱ抗,37 ℃ 孵育20 min,DAB 显色。显色后呈棕黄色颗粒为阳性反应。苏木素染核,脱水封片。图像采用Image-Pro Plus 6.0 软件分析。
3.5Western blot测定大鼠心肌组织中ACE2蛋白的表达 取大鼠新鲜心肌组织30 mg左右,称重、加入液氮研碎后,每100 mg 加入预冷的裂解缓冲液(RIPA∶PMSF=100∶1)1.0 mL置于冰上放置30 min,使其裂解充分;4 ℃、14 000 r/min 离心15 min, 吸取上清。并用BCA 法测定蛋白浓度。上清充分混合5× 蛋白上样缓冲液后,于100 ℃煮沸变性10 min,用8% SDS-PAGE、80~120 V电压分离蛋白质,电泳后将凝胶中的蛋白转移到经甲醇处理过的PVDF上,经5%脱脂奶粉封闭后加 I 抗(ACE2 及GAPDH 抗体分别用Ⅰ抗稀释液1∶1 000 稀释)及 II抗孵育,最后经化学发光仪发光,采用ImageJ 软件处理图像。
3.6大鼠血浆AngⅡ和Ang-(1-7) 含量的测定 心脏取血约7~10 mL,存放于EDTA 抗凝管中,3 000 r/min,离心15 min 后取上清。采用ELISA 测定血浆中AngⅡ和Ang-(1-7)的水平,具体步骤按试剂盒说明书操作,包括加样、孵育、洗涤、显色并终止反应。终止后使用酶标仪在450 nm 波长上读出各孔吸光度(A)值,并根据试剂盒提供的标准品制作标准曲线,计算各组大鼠血浆AngⅡ和Ang-(1-7)的含量。
4 统计学处理
采用SPSS 17.0 软件分析实验数据。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间两两比较采用Satterthwaite矫正后t检验。以P<0.05 为差异有统计学意义。
结 果
1 DIZE对动物一般情况的影响
正常对照组大鼠体重和饮食、饮水状况正常,精神状态好,毛皮有光泽,反应灵敏;DCM组和DIZE组大鼠较正常对照组体重明显下降(P<0.05),血糖明显升高(P<0.05),HW/BW也明显升高。与DCM 组相比,DIZE 组大鼠精神状态较好,体重及HW/BW明显降低(P<0.05),但血糖的差异无统计学显著性,见表1。
表1各组大鼠一般情况变化
Table 1. The changes of general situation of the rats in each group (Mean±SD.n=8)

GroupBW(g)HW/BW(%)Glu(mmol/L)N452.5±8.60.03±0.025.14±0.10DIZE335.7±8.7*#0.04±0.01*#25.76±0.51*DCM290.1±5.9*0.04±0.01*24.21±0.50*
BW: body weight; HW: heart weight; Glu: blood glucose.*P<0. 05vsN group;#P<0. 05vsDCM group.
2 DIZE对心功能的影响
与正常组比较,DCM组LVEDD和LVESD明显升高,E/A、EF和FS 明显下降(P<0.05);DIZE治疗组较DCM组LVEDD、LVESD、E/A、EF和FS均明显改善(P<0.05),见图1。
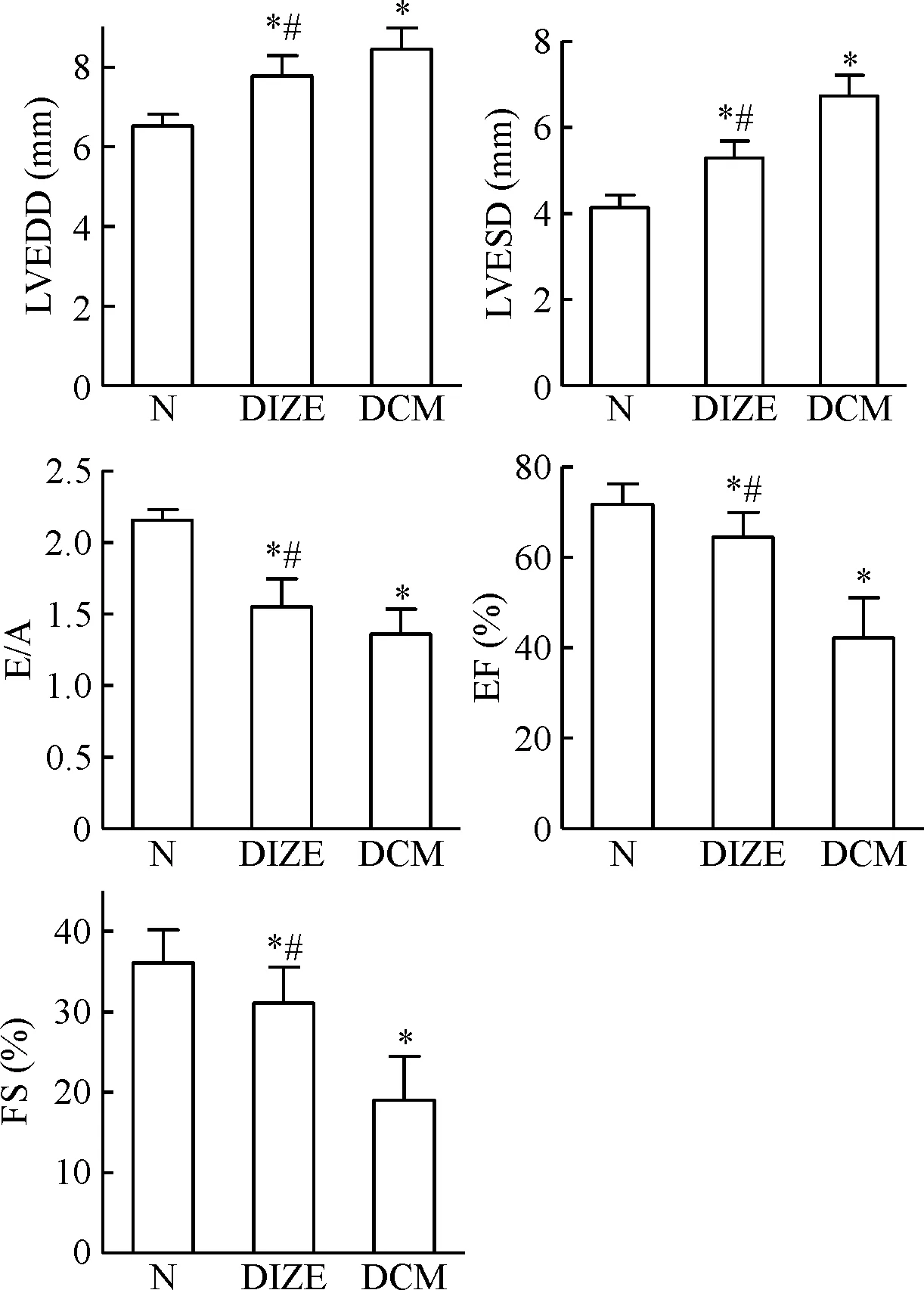
Figure 1. Comparison of echocardiographic findings at 16 weeks in each group. Mean±SD.n=8.*P<0.05vsN group;#P<0.05vsDCM group.
图1各组大鼠16周末超声心动图检测结果
3 DIZE对心肌纤维化的影响
3.1HE染色的结果 HE染色观测各组大鼠心肌大体形态,正常组大鼠心肌细胞排列整齐、致密,染色均匀,未见肌纤维溶解;糖尿病心肌病组大鼠心肌细胞肥大,有较明显心肌纤维损伤和断裂;DIZE治疗组与糖尿病心肌病组相比,心肌细胞肥大和坏死程度减轻,细胞形态大体完整,见图2A。
3.2Masson染色的结果 正常组大鼠胶原纤维呈蓝色,少量均匀分布,胞浆呈红色;糖尿病心肌病组心肌间质及血管周围胶原纤维表达明显增加;与DCM组相比,DIZE治疗组胶原明显减少,见图2B。
4 各组大鼠心肌组织中CTGF、IL-1和IL-6免疫组织化学染色的结果
与对照组比较,DCM组大鼠心肌组织中CTGF阳性表达强度显著增加,图像分析CTGF 蛋白表达水平显著升高;与DCM组比较,DIZE组大鼠心肌组织中CTGF蛋白表达水平明显降低。与对照组比较,糖尿病组大鼠心肌组织中IL-1和IL-6阳性表达强度显著增加,图像分析IL-1和IL-6蛋白表达水平显著升高;与DCM组比较,DIZE组大鼠心肌组织中IL-1和IL-6蛋白表达水平明显降低,见图3。

Figure 2. The representative images of HE staining (A) and Masson staining (B) in each group under light microscope (×400).
图2各组大鼠心肌组织HE染色和Masson染色结果
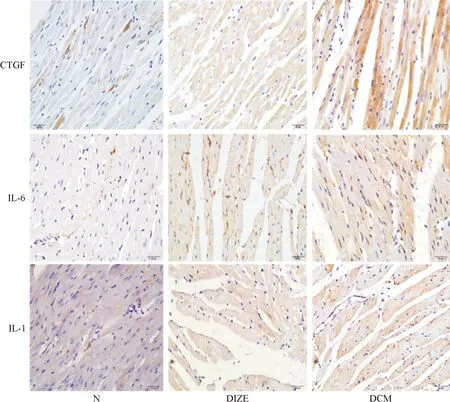
Figure 3. The representative images of immunohistochemical staining for CTGF, IL-6 and IL-1 in each group under light microscope (×400).
图3各组大鼠心肌组织CTGF、IL-1和IL-6的免疫组化观察结果
5 Western blot测定DIZE 对DCM大鼠心肌中ACE2蛋白表达量的影响
与对照组比较,DCM组大鼠心肌组织中ACE2蛋白表达量明显降低;DIZE组大鼠心肌中ACE2蛋白的表达量明显高于DCM组(P<0.05),见图4。
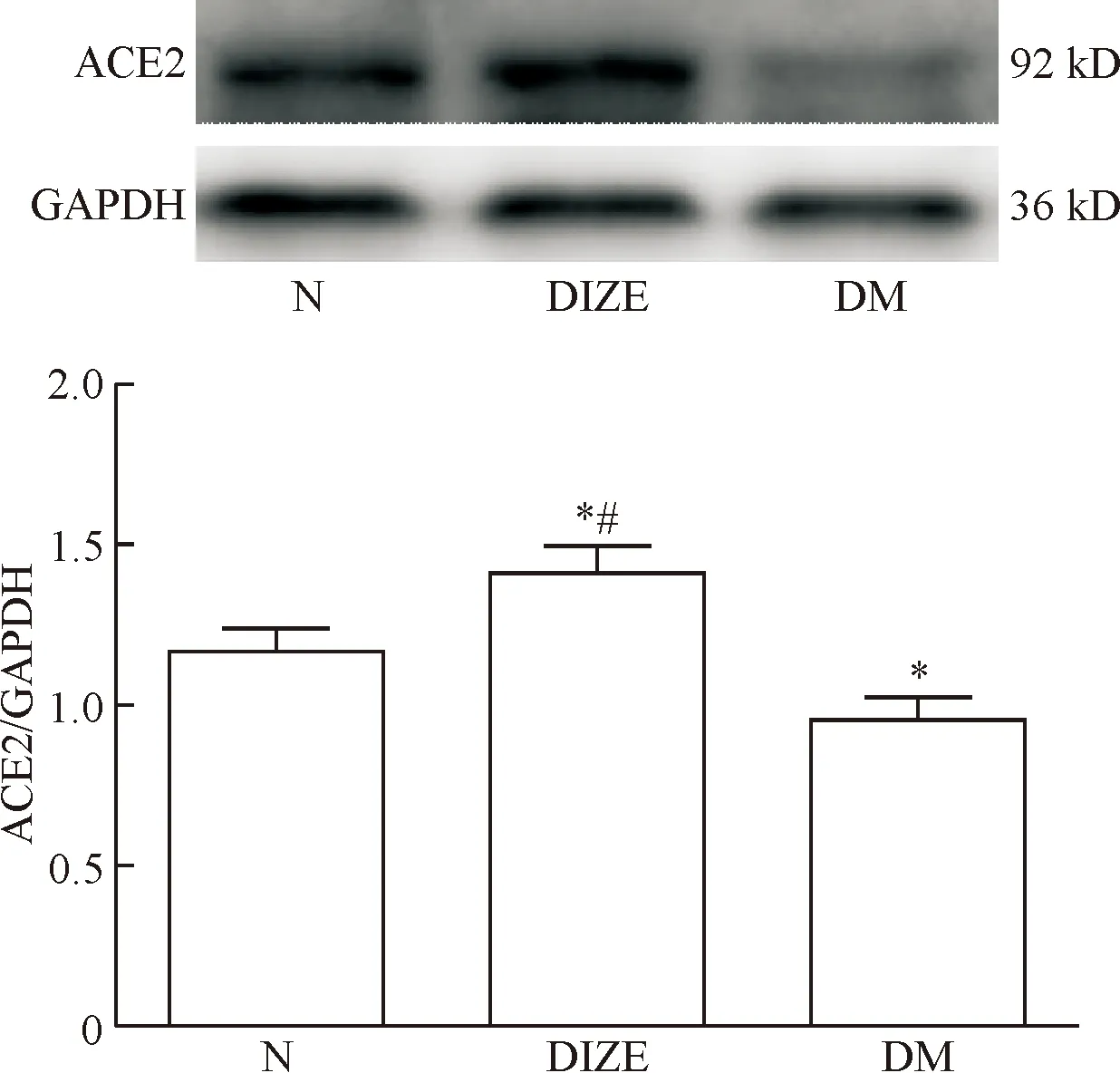
Figure 4. The protein expression of ACE2 in each group detected by Western blot. Mean±SD.n=4.*P<0.05vsN group;#P<0.05vsDCM group.
图4各组大鼠心肌中ACE2蛋白表达
6 大鼠血浆AngⅡ和Ang-(1-7)含量的变化
与正常组大鼠相比,DCM 组大鼠血浆AngⅡ水平明显上升,Ang-(1-7) 水平明显下降(P<0.05); 而经DIZE 干预治疗后,DIZE组大鼠血浆AngⅡ水平下降,Ang-(1-7)水平上升(P<0.05),见图5。
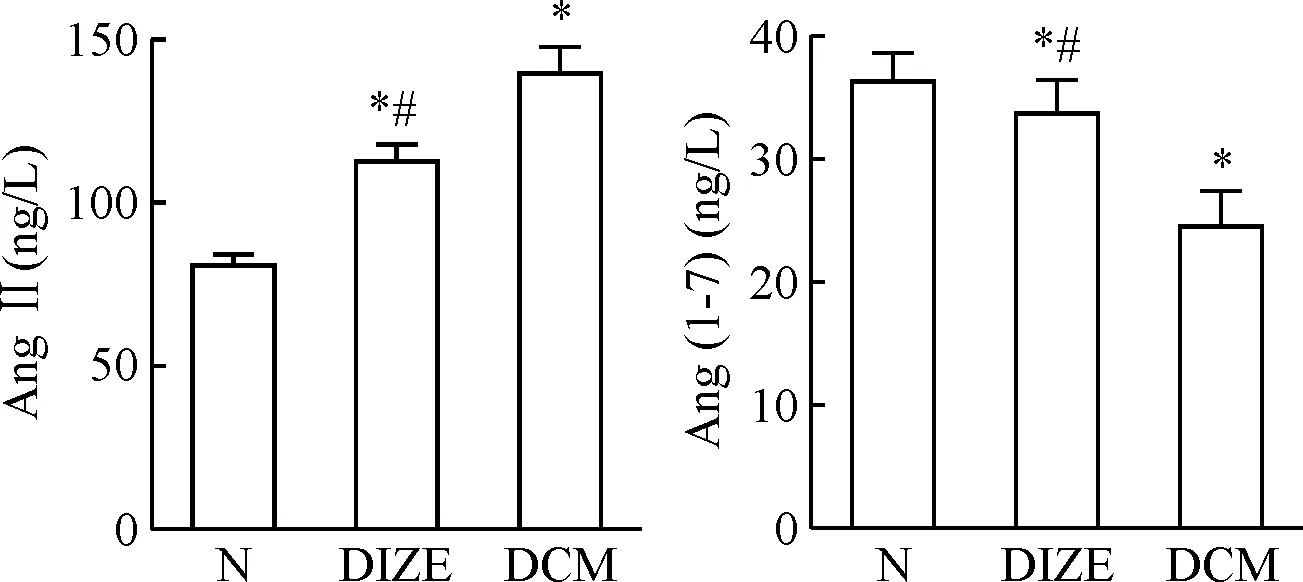
Figure 5. The plasma concentrations of AngⅡ and Ang-(1-7) in different groups. Mean±SD.n=8.*P<0.05vsN group;#P<0.05vsDCM group.
图5各组大鼠血清中AngⅡ和Ang-(1-7)含量的比较
讨 论
糖尿病心肌病的发病机理复杂,主要涉及肾素-血管紧张素系统的激活。RAS系统是生物体内维持内环境稳定性的复杂的调节系统,它不仅存在于循环系统中,还存在于肾脏、肾上腺、血管壁及心脏等组织中,从而参与对靶器官的调节。在糖尿病心肌病的发展过程中,心肌局部的RAS系统被激活,心肌中AngⅡ水平升高直接作用于心肌,促进心肌纤维化及心肌炎症反应,从而影响心功能[9]。Ang-(1-7)是RAS中的另一成员,具有拮抗Ang II的作用[10-11]。Hao等[12]研究表明,Ang-(1-7)有效减轻了糖尿病发生时左右心室的纤维化及氧化应激。Ebermann等[13]发现,Ang-(1-7)可以降低与肥胖相关的2型糖尿病小鼠的身体脂肪量和炎症,并增强了全身胰岛素敏感性从而改善心脏能量代谢及心脏脂毒性,证明了Ang-(1-7)在糖尿病性心肌病中的保护作用。
血管紧张素转换酶2作为新近发现的血管紧张素转换酶的同源物,可直接水解AngⅡ。相比其它底物,ACE2和Ang Ⅱ的亲和力最高,所以催化AngⅡ 转化为Ang-(1-7)又被认为是ACE2最重要的功能。ACE2通过ACE2—Ang-(1-7)—Mas轴调节RAS。本课题组已有动物实验显示ACE2过表达可抑制DCM心肌中胶原蛋白的积累和改善左室重建,改善心功能。Lai等[14]发现ACE2可以减少阿霉素诱导的心脏功能障碍。Basu等[15]的临床实验证明重组人ACE2分别有效地将Ang-(1-10)和Ang II代谢成Ang-(1-9)和Ang-(1-7)。治疗组中扩张型心肌病心肌AngⅡ通过ACE2有效转化为Ang(1-7),从而改善心脏衰竭[15]。大量实验均证明ACE2对心肌具有保护作用。DIZE作为最近发现的ACE2内源性激动剂,可以增强ACE2活性。本课题组已有研究发现DIZE可以减少纤维化和炎症改善糖尿病导致的肾脏纤维化,提示DIZE可能通过负向调节RAS在糖尿病心肌病中也存在保护作用。
在糖尿病心肌病的发生发展过程中伴随着炎症细胞因子,巨噬细胞以及胶原含量的显著增加[1]。因此改善心肌炎症及纤维化是改善糖尿病心肌病的重要指标。本实验结果显示,DIZE治疗后较DCM组心肌中Ang-(1-7)水平升高,Ang II水平降低;DIZE治疗组大鼠心肌中Ang-(1-7)下游的炎症因子及胶原的含量较DCM明显下降;并通过超声检测发现DIZE在一定程度上改善了糖尿病心肌病大鼠的心功能。说明DIZE内源性地激活了ACE2,明显提高了心肌中ACE2的活性,从而抑制了心肌纤维化,减轻了炎症并在一定程度上改善了心功能。
综上所述,DIZE作为ACE2激动剂,对糖尿病心肌病大鼠起到了保护作用,为临床中糖尿病心肌病的治疗提供了新的思路。但DIZE作为一种新的治疗糖尿病心肌病的药物,其具体机制值得我们进一步研究。
[1] Westermann D, Van Linthout S, Dhayat S, et al. Cardioprotective and anti-inflammatory effects of interleukin converting enzyme inhibition in experimental diabetic cardiomyopathy[J]. Diabetes, 2007, 56(7):1834-1841.
[2] Mitchell MD, Laird RE, Brown RD, et al. IL-1β stimulates rat cardiac fibroblast migration via MAP kinase pathways[J]. Am J Physiol Heart Circ Physiol, 2007, 292(2):H1139-H1147.
[3] Lorenzo O, Picatoste B, Ares-Carrasco S, et al. Potential role of nuclear factor κB in diabetic cardiomyopathy[J]. Mediators Inflamm, 2011, 2011:652097.
[4] Nicoletti A, Michel JB. Cardiac fibrosis and inflammationinteraction with hemodynamic and hormonal factors[J]. Cardiovasc Res, 1999, 41(3):532-543.
[5] Papinska AM, Mordwinkin NM, Meeks CJ, et al. Angiotensin-(1-7) administration benefits cardiac, renal, and progenitor cell function in db/db mice[J]. Br J Pharmacol, 2015, 172(18):4443-4453.
[6] Takai S, Miyazaki M. The role of chymase in vascular proliferation[J]. Drug News Perspect, 2002, 15(5):278-282.
[7] Dong B, Yu QT, Dai HY, et al. Angiotensin-converting enzyme-2 overexpression improves left ventricular remodeling and function in a rat model of diabetic cardiomyopathy[J]. J Am Coll Cardiol, 2012, 59(8):739-747.
[8] Qi YF, Zhang J, Cole-Jeffrey CT, et al. Diminazene aceturate enhances angiotensin-converting enzyme 2 activity and attenuates ischemia-induced cardiac pathophysiology[J]. Hypertension, 2013, 62(4):746-752.
[9] Vickers C, Hales P, Kaushik V, et al. Hydrolysis of biological peptides by human angiotensin-converting enzyme-related carboxypeptidase[J]. J Biol Chem, 2002, 277(17):14838-14843.
[10] Kajstura J, Fiordaliso F, Andreoli AM, et al. IGF-1 overexpression inhibits the development of diabetic cardio-myopathy and angiotensin II-mediated oxidative stress[J]. Diabetes, 2001, 50(6):1414-1424.
[11] Mori J, Patel VB, Abo AO, et al. Angiotensin 1-7 ame-liorates diabetic cardiomyopathy and diastolic dysfunction indb/dbmice by reducing lipotoxicity and inflammation[J]. Circ Heart Fail, 2014, 7(2):327-339.
[12] Hao P, Yang J, Liu Y, et al. Combination of angiotensin-(1-7) with perindopril is better than single therapy in ameliorating diabetic cardiomyopathy[J]. Sci Rep, 2015, 5:8794.
[13] Ebermann L, Spillmann F, Sidiropoulos M, et al. The angiotensin-(1-7) receptor agonist AVE0991 is cardioprotective in diabetic rats[J]. Eur J Pharmacol, 2008, 590(1-3):276-280.
[14] Lai L, Chen J, Wang N, et al. MiRNA-30e mediated cardioprotection of ACE2 in rats with doxorubicin-induced heart failure through inhibiting cardiomyocytes autophagy[J]. Life Sci, 2017,169:69-75.
[15] Basu R, Poglitsch M, Yogasundaram H, et al. Roles of angiotensin peptides and recombinant human ACE2 in heart failure[J]. J Am Coll Cardiol, 2017, 69(7):805-819.
