多器官功能障碍综合征大鼠肺组织MMP-9、TIMP-1和Ⅳ型胶原的表达*
2018-01-19易梦秋
易梦秋, 余 旻, 王 鹏
(宜昌市第一人民医院ICU, 湖北 宜昌 443000)
目前认为,多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的本质是机体炎症反应失控所导致的多器官功能序贯损伤,血管内皮衬托于血管表面,最先感应各种理化因素的刺激,是启动和放大炎症反应的关键。血管内皮包括内皮细胞及细胞外基质(extracellular matrix,ECM)。基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)作为靶向ECM主要成分IV型胶原(collagen type IV,IV-C)的水解酶,在调节细胞外基质的动态平衡中发挥极其重要的作用[1];金属蛋白酶组织抑制物1(tissue inhibitor of metalloproteinase-1,TIMP-1)为MMP-9的内源性抑制剂,可特异性结合MMP-9催化活性中心的锌离子,抑制MMP-9水解蛋白的活性,进而促进ECM的沉积并抑制其降解[2]。在全身炎症反应失控而导致MODS发生的病理生理过程中,肺脏是最容易受损的靶器官,本实验通过观察MODS大鼠模型肺组织中MMP-9、TIMP-1及IV-C的表达变化,研究它们与细胞外基质损伤之间的关系,探讨MODS肺损伤的发生机制。
材 料 和 方 法
1 实验动物
40只健康成年SD大鼠(SPF级,雄性,180~200 g,No. 42010200000481),由三峡大学实验动物中心提供,符合国家实验动物使用标准,许可证号为SCXK(鄂)2011-0012。所有大鼠于代谢笼中在湿度(60±5)%、温度(20±2)℃和12 h光照/ 12 h黑暗周期的标准条件下自由摄食和饮水,喂养1周后进行实验,实验前禁食12 h,禁水4 h。
2 材料
ELISA 试剂盒购自武汉博士德试剂公司;RNA提取试剂(Trizol)购自Invitrogen;PrimeScript RT Reagent Kit with gDNA Erase购自TaKaRa;DNA Ladder购自北京索莱宝科技有限公司;抗MMP-9、TIMP-1和IV-C抗体购自Abcam; II 抗、BSA、DAB试剂盒、DAPI染色试剂和蛋白裂解液购自谷歌生物;BCA蛋白浓度测定试剂盒和蛋白marker购自Thermo。引物由上海生物工程有限公司合成,MMP-9的上游引物序列为5’-CCACCGAGCTATCCACTCAT-3’,下游引物序列为5’-GTCCGGTTTCAGCATGTTTT-3’;TIMP-1的上游引物序列为5’-TCCCCAGAAATCATCGAGAC-3’,下游引物序列为5’-ATGGCTGAACAGGGAAACAC-3’;β-actin的上游引物序列为5’-GCCATGTACGTAGCCATCCA-3’,下游引物序列为5’-GAACCGCTCATTGCCGATAG-3’。
3 主要方法
3.1动物分组与模型制备 实验动物称重后按随机数字表达法将大鼠分为假手术(sham)对照组和盲肠结扎穿孔(cecal ligation and puncture,CLP)模型组,其中,CLP组又根据造模后不同时相分为 MODS 6 h组、 MODS 12 h组、 MODS 24 h组和MODS 48 h组,每组各8只。采用改良的CLP法[3]构建MODS大鼠模型:用3%戊巴比妥钠以30 mg/kg腹腔注射麻醉后,大鼠常规备皮消毒,沿腹中线作长约1.0 cm的手术切口,轻轻分离出盲肠,避免损伤肠系膜血管,轻轻挤压盲肠上端的粪便,使盲肠末端充盈,分离肠系膜血管,用无菌4号丝线在距盲肠游离端约1.5 cm处结扎,并用21号无菌针头在结扎部位与盲肠顶端的中点处贯通刺穿肠壁,形成盲肠漏,并挤少许粪便至腹腔,后将盲肠还纳,关闭腹腔逐层缝合切口并消毒,待麻醉苏醒后自由饮水和摄食。Sham组大鼠仅做剖腹探查术。
3.2标本采集 取腹主动脉血1 mL,用血气分析仪进行血气分析,计算氧合指数(oxigenation index,OI), OI=PaO2/FiO2(FiO2=0.21),其中PaO2为动脉氧分压,FiO2为吸入氧浓度百分比;另取腹主动脉血5 mL,室温静置4 h后,3 000 r/min离心15 min,取上清用于血液生化及ELISA检测相关指标含量。采血后迅速取肺组织,分成3份:(1)按肺组织制片要求取厚5~7 mm组织,置于4 %多聚甲醛溶液中固定24 h后,脱水、包埋、切片,用于HE染色和免疫组织化学(immunohistochemistry,IHC)分析;(2)切取厚2 cm的组织块迅速用锡箔纸轻轻包住并标记,放入液氮中保存,制备冰冻切片,用于免疫荧光(immunofluorescence,IF)分析;(3)将组织切成小块,用1.5 mL离心管分装并标记,-80 ℃保存,尽早提取总RNA和蛋白质。制片的组织尽量取材于相同部位。
3.3肝、肾和肺功能检测 采用全自动生化分析仪检测血清中丙氨酸转氨酶(alanine aminotransferase,ALT)、 天冬氨酸转氨酶(aspartate aminotransferase,AST)、胆红素(bilirubin,BIL)、血清肌酐(serum creatinine,SCr)和血尿素氮(blood urea nitrogen,BUN)的水平。同时,采用血气分析仪进行血气分析,并计算分析氧合指数。
3.4病理学检查 将肺组织浸泡在4 %多聚甲醛溶液中固定24 h后,梯度乙醇脱水,石蜡包埋,做厚度4 μm的连续切片,贴于防脱载玻片,再经60 ℃烤箱烘烤4 h后,4 ℃保存。取出行HE染色。光镜下观察并取图。
3.5ELISA检测血清中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、MMP-9及TIMP-1的水平 按照ELISA试剂盒说明书进行操作。
3.6RT-PCR检测肺组织MMP-9及TIMP-1的mRNA表达 采用Trizol试剂提取肺组织总RNA,微量核酸蛋白检测仪测定RNA的纯度和浓度。取1 μg RNA按照说明书合成cDNA,然后以25 μL反应体系进行扩增。MMP-9的扩增条件为: 94 ℃预变性5 min; 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸30 s,循环35次; 72 ℃ 再延伸10 min,扩增产物片段为161 bp。TIMP-1的扩增条件为: 94 ℃预变性5 min; 94 ℃变性45 s, 58 ℃退火35 s, 72 ℃延伸45 s,循环35次; 72 ℃再延伸10 min,扩增产物片段为329 bp。β-actin的扩增条件为: 94 ℃预变性5 min; 94 ℃变性35 s, 59 ℃退火35 s, 72 ℃延伸35 s,循环35次; 72 ℃再延伸10 min,扩增产物片段为375 bp。取20 μL扩增产物行2%琼脂糖凝胶电泳,最后在凝胶成像系统下观察取图并分析结果。
3.7免疫组织化学法检测肺组织MMP-9及TIMP-1的蛋白表达 取上述制备的切片脱蜡,柠檬酸钠高压锅修复抗原,PBS冲洗,3%双氧水消除过氧化物酶,PBS冲洗,5% BSA室温封闭30 min,按适当比例加入 I 抗(MMP-9 1∶100,TIMP-1 1∶200),4 ℃孵育过夜,PBS冲洗,加入II 抗(1∶100),室温孵育1 h,DAB显色,流水冲洗,苏木精染核,中性树脂封片,显微镜下观察出现棕黄色颗粒为阳性表达分布,随机选取5个视野用Image-Pro Plus软件进行平均吸光度分析。
3.8免疫荧光检测肺组织IV-C的表达 从液氮中取出肺组织,置于恒冷箱式冰冻切片机内平衡20 min,作厚度6 μm的冰冻切片,贴于防脱载玻片上,室温放置30 min,丙酮固定10 min,室温晾干。0.3 % Triton X-100溶液处理切片20 min,PBS冲洗,5 % BSA室温封闭30 min,甩干,按适当比例加入 I 抗(1∶500),4 ℃孵育过夜,PBS冲洗,加入荧光 II 抗(1∶1 000)避光孵育1 h,PBS冲洗,DAPI避光染核10 min,PBS冲洗,抗荧光猝灭剂封片,荧光显微镜下观察取图并用Image-Pro Plus软件分析平均吸光度。
3.9Western blot检测肺组织IV-C蛋白的表达 采用蛋白裂解液提取肺组织总蛋白,参照BCA试剂盒说明书测定蛋白浓度,计算50 μg蛋白的上样体积,制样,经SDS-PAGE转移至PVDF膜上,5 %脱脂奶粉室温封闭1 h,加适当比例 I抗[MMP-9 (1∶1 000)、TIMP-1 (1∶500)和β-actin (1∶3 000)],4 ℃过夜,TBST洗3次,每次10 min,加适当比例 II 抗(1∶3 000)室温孵育1 h,然后TBST洗3次,每次10 min。用吸水纸吸净PVDF膜上的液体,滴加等比例混合的A、B显影液,在凝胶成像系统下取图并分析实验结果。
4 统计学处理
用SPSS 23.0软件进行数据处理和统计分析。所有实验数据用均数±标准差(mean±SD)表示,计量资料采用完全随机设计的方差分析,并用LSD法做多样本均数间的两两比较,方差不齐时先进行变量转换,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠的一般情况
麻醉苏醒后,sham组大鼠的精神、活动、饮水及摄食量较假手术前稍减弱,6 h后逐渐恢复至术前状态,全程无死亡。与sham组大鼠比较,各模型组大鼠复苏延迟,精神差,反应迟钝,毛竖、色黄无光泽,眼鼻分泌物增多,缩背少动,饮水及摄食量明显减少,体重减轻,其中,12 h组和24 h组各死亡1只,48 h组死亡2只。
2 肝、肾和肺功能的改变
与sham组比较,各模型组均出现不同程度的肝、肾和肺功能损伤,血清中ALT、AST、BIL、SCr和BUN的水平呈进行性升高,OI呈明显下降趋势(P<0.05或P<0.01),见表1。
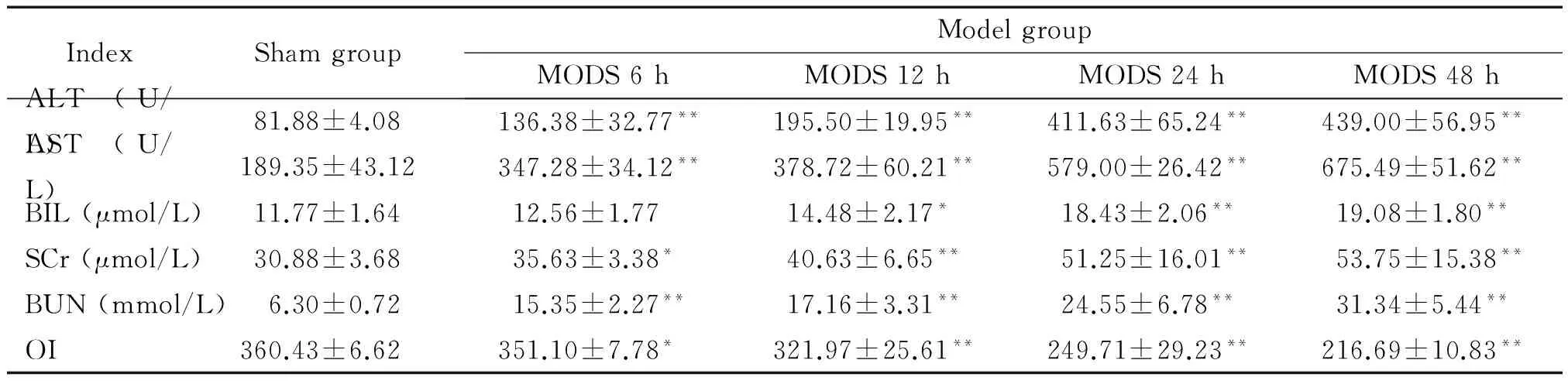
表1 生化及血气分析结果
*P<0.05,**P<0.01vssham group.
3 肺组织形态学的改变
Sham组大鼠肺组织结构正常,肺泡腔及间质内无渗出;各模型组大鼠肺组织损伤严重,造模后6 h可见肺泡壁毛细血管充血,肺泡腔内有大量浆液及少量红细胞和中性粒细胞浸润,造模后12~24 h血管显著扩张伴出血,肺间质增厚,肺泡腔内充满大量红细胞和中性粒细胞,48 h渗出减少,间质增厚,部分肺泡腔闭陷,见图1。
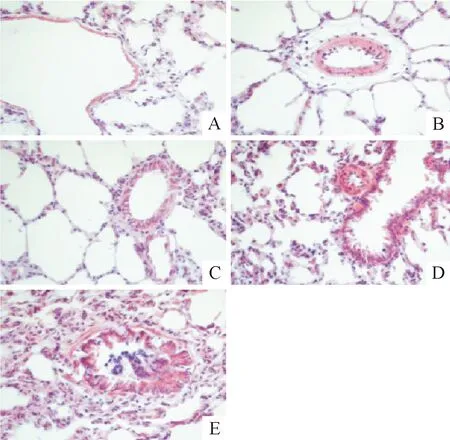
Figure 1. The pathologic changes of the lung tissues in control group and MODS model groups (×400). A: sham group; B: MODS 6 h group; C: MODS 12 h group; D: MODS 24 h group; E: MODS 48 h group.
图1各组大鼠肺组织形态学的变化
4 ELISA检测血清中TNF-α、IL-1β、MMP-9及TIMP-1的水平
与sham组比较,各模型组血清中TNF-α、IL-1β、MMP-9及TIMP-1的含量均明显升高,于造模后12~24 h达高峰(P<0.01),48 h有所降低,但仍高于sham组(P<0.05或P<0.01);MODS 6 h和12 h组MMP-9/TIMP-1比值明显高于sham组(P<0.05或P<0.01),而24 h和48 h组MMP-9/TIMP-1比值明显低于sham组(P<0.05或P<0.01),见图2、表2。
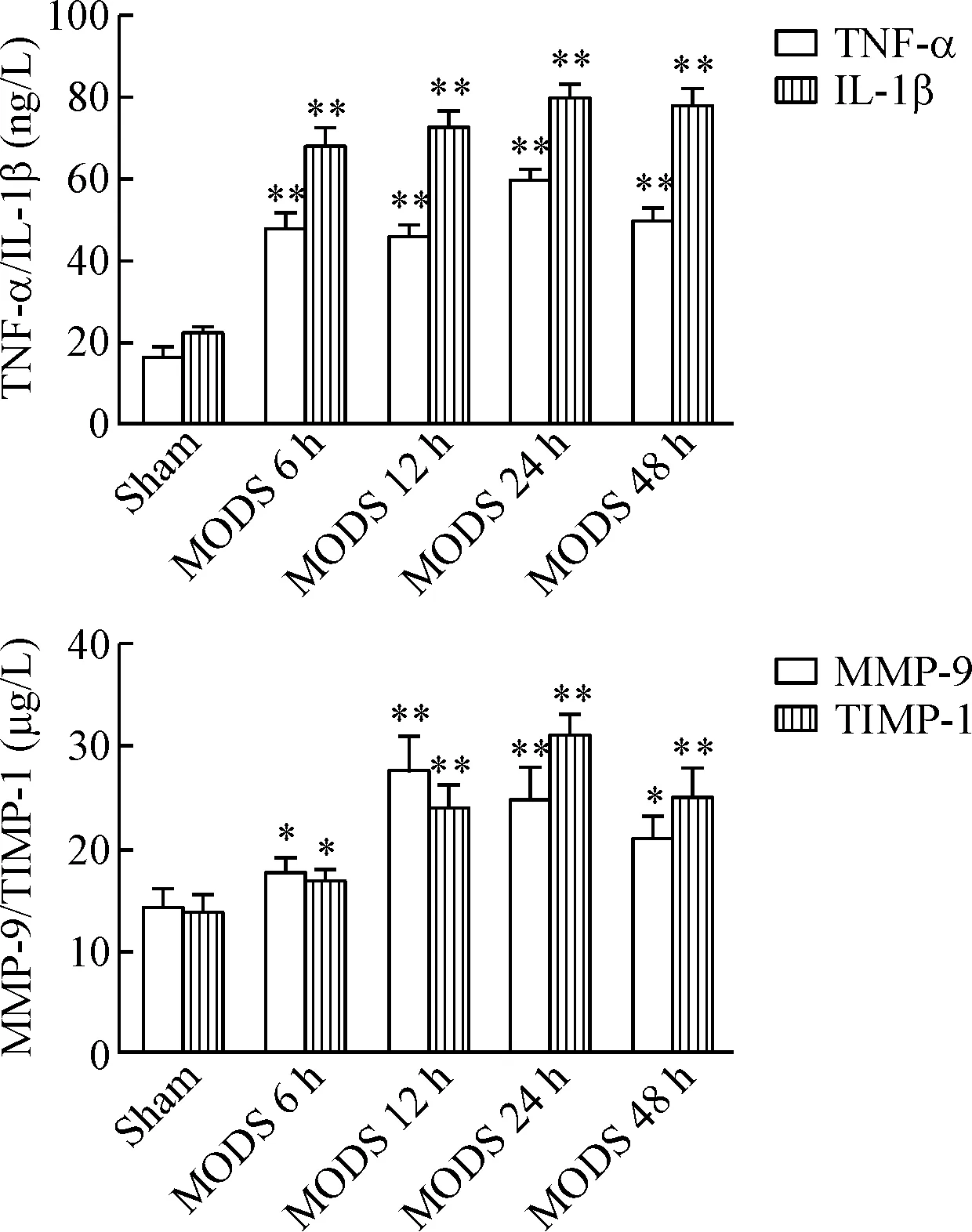
Figure 2. The serum levels of TNF-α, IL-1β, MMP-9 and TIMP-1 in control group and MODS model groups. Mean±SD.n=3.*P<0.05,**P<0.01vssham group.
图2各组大鼠血清中TNF-α、IL-1β、MMP-9及TIMP-1水平的变化
5 RT-PCR检测肺组织MMP-9及TIMP-1的mRNA表达
与sham组比较,各模型组肺组织MMP-9及TIMP-1的mRNA表达量明显升高(P<0.05或P<0.01),于造模后12~24 h达高峰(P<0.01),48 h有所下降,但仍高于sham组(P<0.05或P<0.01),见图3、表3。
6 IHC检测肺组织MMP-9及TIMP-1蛋白的表达
与sham组比较,各模型组肺组织MMP-9和TIMP-1蛋白表达量明显升高(P<0.01),于造模后12~24 h达高峰(P<0.01),48 h有所下降,但仍高于sham组(P<0.01),见图4、5及表3。
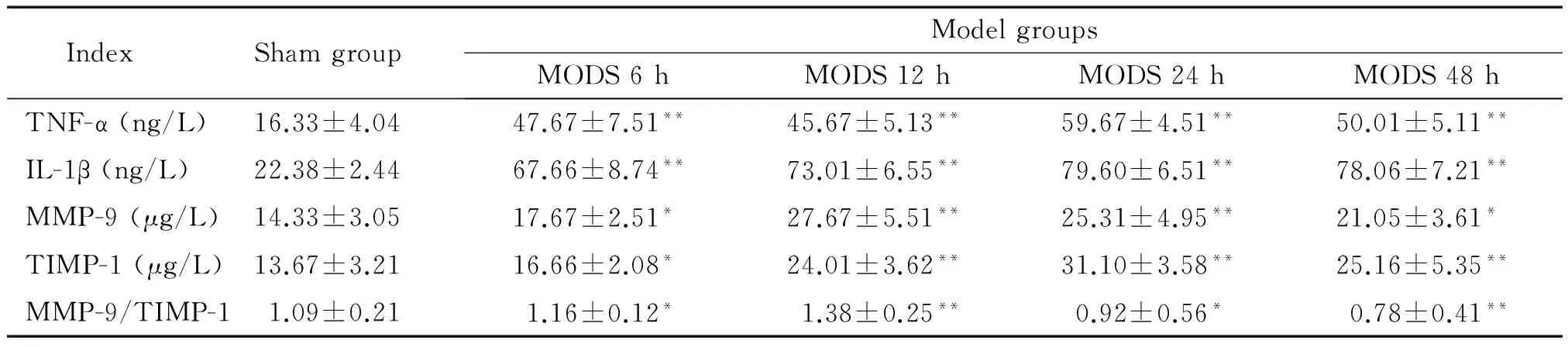
表2 各组大鼠血清TNF-ɑ、IL-1β、MMP-9和TIMP-1含量及MMP-9/TIMP-1比值
*P<0.05,**P<0.01vssham group.
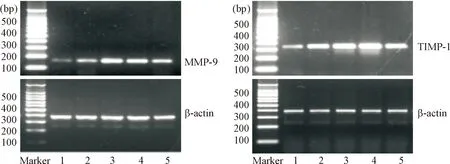
Figure 3. The results of RT-PCR for detecting the mRNA expression of MMP-9 and TIMP-1 in control group and MODS model groups. 1: sham group; 2: MODS 6 h group; 3: MODS 12 h group; 4: MODS 24 h group; 5: MODS 48 h group.
图3各组大鼠肺组织MMP-9和TIMP-1的mRNA表达

表3 各组大鼠肺组织MMP-9及TIMP-1的mRNA和蛋白表达的变化
*P<0.05,**P<0.01vssham group.
7 IF检测肺组织IV-C的阳性表达
与sham组比较,造模后6 h肺组织IV-C降低不明显,12~48 h肺组织IV-C表达量下降(P<0.05),于造模后24 h降至最低(P<0.01),48 h有所升高,但仍低于sham组(P<0.05),见图6、表4。
8 Western blot检测肺组织IV-C蛋白的表达
与sham组比较,造模后6 h肺组织IV-C降低不明显,12~48 h肺组织IV-C蛋白表达量明显降低(P<0.05或P<0.01),于造模后24 h降至最低(P<0.01),48 h有所升高,但仍低于sham组(P<0.01),见图7、表4。
讨 论
MODS是一种由多种病因引起的临床表现复杂、治疗难度大且死亡率极高的临床综合征,常并发于重症感染、胰腺炎及心肺复苏等重大打击后,是危重病医学研究的热点及难点。MODS发病机制复杂,确切机制至今尚未完全阐明,主要有缺血再灌注损伤假说、内毒素假说、胃肠道假说、炎症失控假说、二次打击学说和炎症失衡学说等等[4-5]。然而,无论是何种机制导致的MODS发生,持续失控的炎症反应导致内皮功能障碍是MODS的“必经之路”。目前国内外学者对内皮细胞损伤学说研究较多,认为内皮细胞的激活和损伤可启动并放大炎症反应,促进凝血过程,强化免疫细胞的相互作用,最终导致微循环闭塞,引起组织低灌注及缺氧,进而导致器官功能的损害[6-8]。血管内皮包括内皮细胞及细胞外基质,而ECM作为血管内皮的重要组成部分是炎症反应的靶器官之一,如能证明ECM的损伤也参与MODS的发生与发展,将完善MODS的发病机制,为临床上MODS的防治提供新的思路。
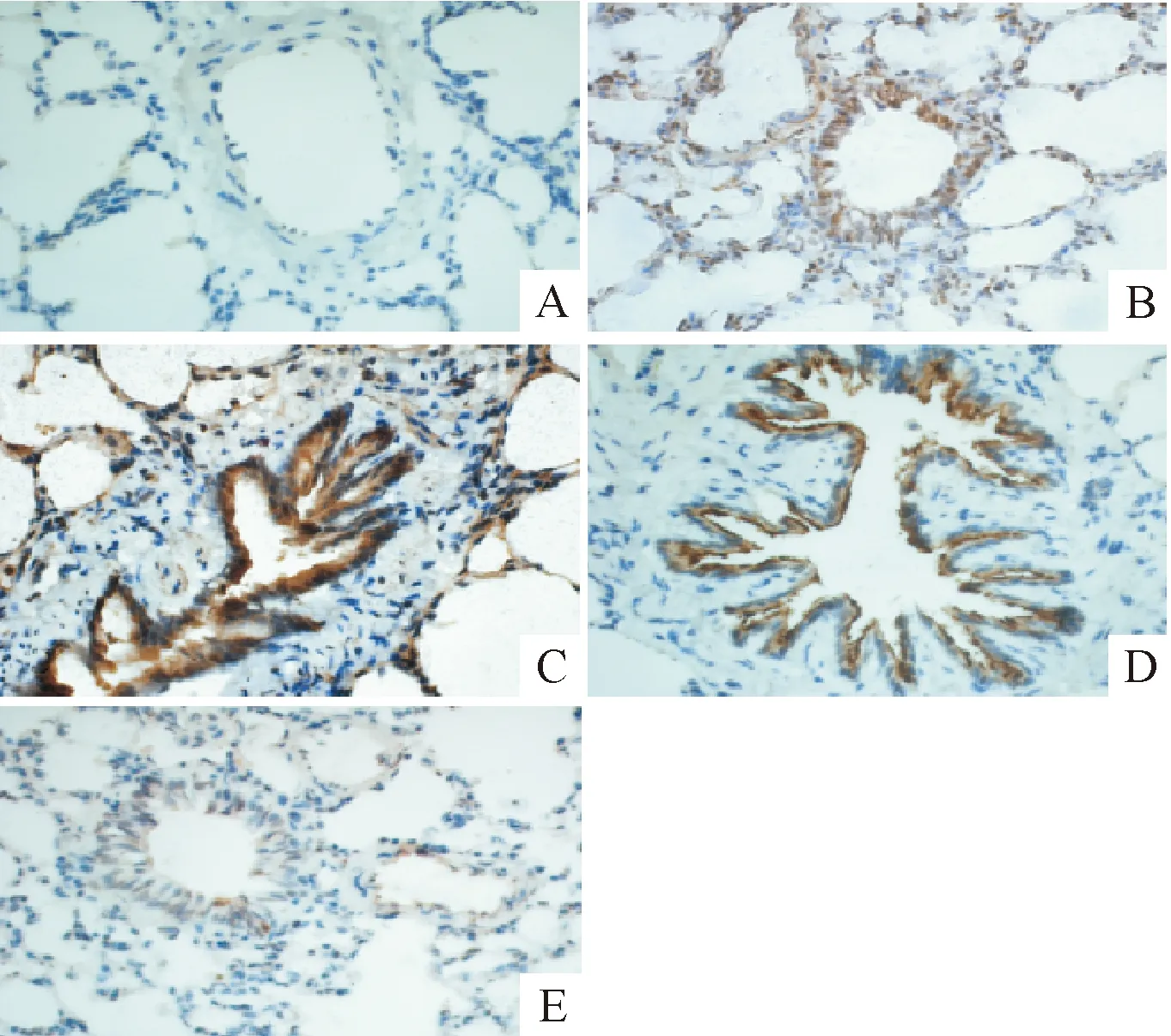
Figure 4. Comparison of lung tissue MMP-9 positive staining in control group and MODS model groups (×400). A: sham group; B: MODS 6 h group; C: MODS 12 h group; D: MODS 24 h group; E: MODS 48 h group.
图4各组大鼠肺组织MMP-9阳性表达的变化
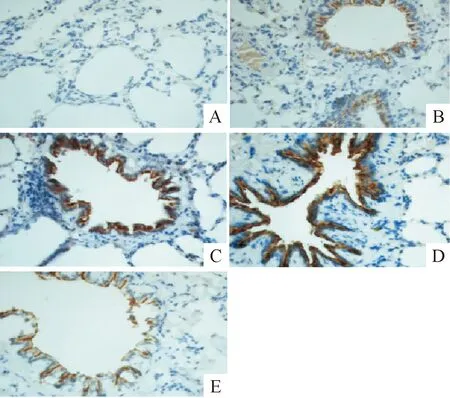
Figure 5. Comparison of lung tissue TIMP-1 positive staining in control group and MODS model groups (×400). A: sham group; B: MODS 6 h group; C: MODS 12 h group; D: MODS 24 h group; E: MODS 48 h group.
图5各组大鼠肺组织TIMP-1阳性表达变化
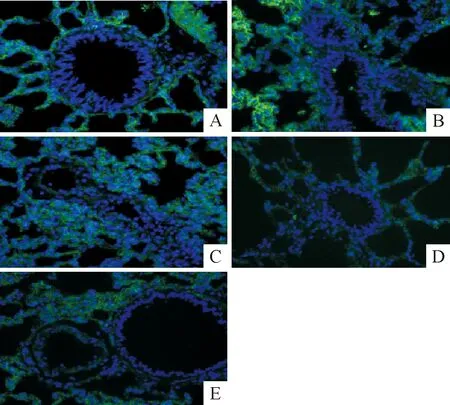
Figure 6. Comparison of lung tissue IV-C positive staining in control group and MODS model groups (×400). A: sham group; B: MODS 6 h group; C: MODS 12 h group; D: MODS 24 h group; E: MODS 48 h group.
图6各组大鼠肺组织IV-C阳性表达变化

Figure 7. The protein expression of IV-C in the lung tissues of the rats with MODS for different times determined by Western blot.
图7各组大鼠肺组织IV-C蛋白表达的变化
表4各组大鼠肺组织IV-C的蛋白表达水平比较
Table 4. The protein expression of IV-C in the lung tissues of each group determined by immunofluorescence and Western blot (Mean±SD.n=3)

GroupIFWestesrnblotSham0.28±0.072.25±0.13MODS6h0.25±0.061.93±0.11MODS12h0.17±0.05*1.22±0.19*MODS24h0.14±0.05**0.53±0.13**MODS48h0.17±0.03*0.80±0.18**
*P<0.05,**P<0.01vssham group.
MMPs家族是自然界中高度保守的一类酶,几乎能降解ECM的所有成分,现已发现26种,它们由酶原激活,主要受基因转录、酶原活化和抑制剂抑制3个水平上的调控,参与组织损伤、炎症反应和细胞凋亡等[9]。MMP-9与MMPs家族的其它成员一样,是锌离子依赖性蛋白水解酶,具有广泛的底物特异性,它主要以明胶和IV-C为底物,因此又称明胶酶或IV-C酶。MMP-9在正常组织中极少表达,当机体遭受严重感染等打击后,细菌释放的内毒素结合细胞表面的特异性蛋白形成复合物,激活单核/巨噬细胞、淋巴细胞、中性粒细胞等炎症细胞,合成并释放大量的炎症介质如TNF-ɑ、IL-1β和IL-6等,从而上调MMP-9的表达[10-11]。本实验采用CLP法建立MODS大鼠模型,造模后各项生化、血气及炎症指标的改变都提示模型组大鼠发生明显的多器官功能损害。本实验着重研究MODS时的肺损伤情况,肺组织形态学改变也显示模型组大鼠肺损伤较重。MMP-9的水平可以反映肺基底膜胶原蛋白尤其是IV-C的代谢情况,随着胶原蛋白合成增加和降解减少,血清中MMP-9的水平会相应升高或降低。在本研究中,模型组血清及肺组织中MMP-9的表达均明显高于对照组,提示在MODS肺损伤早期存在IV-C代谢异常。肺是炎症介质的靶器官之一,在各种炎症介质损伤血管内皮的过程中,伴随着细胞外骨架蛋白IV-C的破坏,从而影响肺组织的结构及功能[12]。本实验中各模型组肺组织IV-C的含量随着病情进展呈下降趋势,造模后6 h IV-C的改变不显著,12~48 h可见其明显下降,且于24 h降至最低,48 h有所升高,但仍低于对照组。我们考虑,在肺损伤早期基质破坏而机体来不及代偿,随着病情加重机体防御性修复机制使细胞合成IV-C增加,降解减少,这可能是48 h组肺组织IV-C回升的因素之一。
TIMP-1为MMP-9的内源性抑制剂,常由分泌MMP-9的同一细胞合成。研究发现,TIMP-1不仅可抑制MMP-9酶原活化并使已活化的MMP-9失活,它还作为一种转录抑制剂通过抑制MMPs基因的转录,导致基质成分合成和降解失衡,引起组织结构重塑[13]。本实验中,各模型组血清及肺组织中TIMP-1的表达均明显升高,在造模后24 h达高峰,48 h有所下降,但仍高于对照组。提示在MODS肺损伤早期,不仅存在MMP-9的高表达,TIMP-1的升高也可能在MODS发生与发展过程中发挥重要作用,TIMP-1与MMP-9可共同作为MODS早期诊断和预测预后的良好指标。
综上所述,我们推测炎症反应可通过诱导血管内皮细胞外基质中MMP-9的过表达而放大血管内皮中的炎症反应,加重血管内皮损伤,造成组织低灌注和缺血缺氧,进而导致MODS发生;MODS条件下TIMP-1应激性表达上调可能通过抑制MMP-9的活性而减轻MODS的严重程度。靶向抑制血管内皮中MMP-9活性或上调TIMP-1水平可能成为新的MODS有效治疗途径。
[1] Vandooren J, Van den Steen PE, Opdenakker G. Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9 (MMP-9): the next decade[J]. Crit Rev Biochem Mol Biol, 2013, 48(3):222-272.
[2] Ries C. Cytokine functions of TIMP-1[J]. Cell Mol Life Sci, 2014, 71(4):659-672.
[3] Rittirsch D, Huber-Lang MS, Flierl MA, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J]. Nat Protoc, 2009, 4(1):31-36.
[4] Mizock BA. The multiple organ dysfunction syndrome[J]. Dis Mon, 2009, 55(8):476-526.
[5] Osuchowski MF, Welch K, Siddiqui J, et al. Circulating cytokine/inhibitor profiles reshape the understanding of the SIRS/CARS continuum in sepsis and predict mortality[J]. J Immunol, 2006, 177(3):1967-1974.
[6] Aird WC. The role of the endothelium in severe sepsis and multiple organ dysfunction syndrome[J]. Blood, 2003, 101(10):3765-3777.
[7] 邢丽英, 郑凌云, 吴玉娥, 等. p110δ突变失活上调血管MMPs表达并引发血管壁结构损伤[J]. 中国病理生理杂志, 2014, 30(11):1987-1992.
[8] Knotzer H, Pajk W, Dünser MW, et al. Regional microvascular function and vascular reactivity in patients with different degrees of multiple organ dysfunction syndrome[J]. Anesth Analg, 2006, 102(4):1187-1193.
[9] Galliera E, Tacchini L, Corsi Romanelli MM. Matrix me-talloproteinases as biomarkers of disease: updates and new insights[J]. Clin Chem Lab Med, 2015, 53(3): 349-355.
[10] Collazos J, Asensi V, Martin G, et al. The effect of gender and genetic polymorphisms on matrix metalloprotease (MMP) and tissue inhibitor (TIMP) plasma levels in different infectious and non-infectious conditions[J]. Clin Exp Immunol, 2015, 182(2):213-219.
[11] 谢建民, 王好问, 陆才生. TNF-α上调单核巨噬细胞MMP-9的活性与类风湿关节炎关节破坏的关系[J].中国病理生理杂志, 2009, 25(6):1181-1185.
[12] 朱运奎, 金远林, 肖永久, 等. 弹力蛋白酶和基质金属蛋白酶在肺组织破坏中协同作用的实验研究[J].中国病理生理杂志, 2005, 21(4):784-787.
[13] Hung CS, Chou CH, Liao CW, et al. Aldosterone induces tissue inhibitor of metalloproteinases-1 expression and further contributes to collagen accumulation: from clinical to bench studies[J]. Hypertension, 2016, 67(6):1309-1320.
