帕金森病患者外周血中骨髓来源抑制性细胞的检测及临床意义*
2018-01-19张晓玲官俏兵韩晨阳王琰萍
杨 毅, 张晓玲, 官俏兵, 郭 丽, 张 慧, 韩晨阳, 王琰萍
(嘉兴市第二医院, 浙江 嘉兴 314001)
帕金森病(Parkinson disease,PD)是一种由大脑黑质多巴胺神经元减少及脑区域α-突触核蛋白沉淀引起的神经退化性疾病,黑质神经元减少导致纹状体多巴胺的减少并出现一系列运动障碍是帕金森病发病的重要表现之一[1]。近年来研究发现免疫炎症反应和氧化损伤在帕金森病的发生发展中有着重要的意义[2-3],就免疫炎症反应而言,免疫抑制性调节细胞对于其促进和发展的作用是直接且巨大的。有研究表明[4],调节性T细胞在帕金森小鼠中显著增高,在帕金森患者外周血中亦增高。而骨髓来源抑制性细胞(myeloid-derived suppressor cells,MDSCs)同样具有强大的免疫调节作用,但是其在帕金森病中的作用报道较少,且其中重要的2组亚型CD14+CD11b+和CD14-CD11b+的差异尚未见报道。本文主要研究帕金森病患者外周血中CD14+CD11b+和CD14-CD11b+骨髓来源抑制性细胞与Hoehn-Yahr分期的关系,以及相关免疫抑制因子精氨酸酶1(arginase 1,ARG1)、白细胞介素10(interleukin-10,IL-10)和环氧合酶2(cyclooxygenase 2,COX-2)的表达水平。
材 料 和 方 法
1 研究对象
选择2016年1月~2017年3月于我院收治并确诊为PD的患者80人,其中男性48人,女性32人,年龄在58~86岁,平均年龄(69.5±5.7)岁,病程1~7年。按照Hoehn-Yahr法将80名患者进行分期,其中I级22人,II级24人,III级20人,IV级14人,V级0人。健康志愿者20人,其中男性10人,女性10人,年龄在25~45岁,平均年龄(31.5±6.7)岁,身体健康情况良好。患者入院均签署知情同意书。
2 方法
2.1外周血单个核细胞的分离 所有受试的患者及健康志愿者均禁食12 h后抽取肘静脉外周血5 mL,置于EDTA抗凝管,1 h内分离提取外周血单个核细胞(peripheral blood monouclear cells,PBMC),具体方法如下,在无菌条件下将外周血进行1 500 r/min离心15 min,弃去上层血清,于血细胞沉淀中加入生理盐水15 mL,均匀吹打后加入10 mL的淋巴细胞分离液(上海华精生物高科有限公司),3 000 r/min离心30 min,小心吸取中间的单个核细胞层,转移至干净的无菌管中,1 500 r/min离心10 min,弃去上清液后用PBS洗2次,最后得到的细胞加入PBS均匀吹打制备成为混悬液,待检测。
2.2流式细胞术检测CD14+CD11b+和CD14-CD11b+细胞 将上述制备得到的PBMC混悬细胞分为2份,转入无菌的离心管中,分别加入抗细胞表面膜蛋白抗体(anti-CD3、anti-CD11b、anti-CD14、antiCD4、antiCD8、anti-CTLA-4和anti-Tim3抗体,均购于BD),避光反应20 min后用PBS洗2次,之后加入0.5 mL PBS重悬,上机检测。
2.3磁珠分选CD14+CD11b+和CD14-CD11b+细胞及总RNA的提取 将上述得到的PBMC加入Washing Buffer重悬,吹打均匀后按照1×107细胞加入15 μL CD14磁珠,混匀后避光孵育20 min,再加入0.5 mL的Washing Buffer后离心,利用MS柱在磁场条件下分选收集CD14阴性的细胞,后取下柱子加入1.5 mL的Washing Buffer,在外界活塞压力下得到CD14阳性的细胞,得到的CD14阳性细胞按照上述方法在CD11b磁珠下分选,最终得到CD14+CD11b+和CD14-CD11b+2群MDSCs,进行细胞计数后备用。
在上述细胞中加入1 mL的Trizol液(TaKaRa),孵育20 min后加入0.5 mL氯仿,振荡2 min,在4 ℃下12 000 r/min离心15 min,上层水层为RNA,吸取RNA转移到无菌的离心管中,加入0.5 mL异丙醇震荡2 min后静置。离心后加入75%乙醇,混匀后12 000 r/min离心。取沉淀加入无酶的双蒸水10 μL,检测A260/A280比值(1.8~2.0)。保存在-80 ℃下备用。
2.4qPCR检测ARG1、IL-10和COX-2的mRNA表达 按照SYBR-qPCR-Kit(TaKaRa)试剂盒操作,设计qPCR的引物,序列见表1。在无RNA酶的PCR管中加入总RNA 1.0 μg,加水定容至12 μL,吹打均匀后在85 ℃保温5 min,使RNA变性,随后在冰盒中放置10~15 min冷却。在上述的PCR管中加入Oligo 0.5 μL、Random Primer 0.5 μL、10 mmol/L的dNTP 0.5 μL、核酸酶抑制剂0.5 μL、 5×Buffer 4.0 μL和M-MLV逆转录酶 0.5 μL,总体积为20.0 μL,将上述反应溶液于30 ℃保温10 min、42 ℃保温50 min,85 ℃反应10 min后迅速冷却,在-20 ℃条件下保存cDNA。在qPCR实验前将cDNA用灭菌纯水按照1∶10稀释,配制反应体系为灭菌纯水4 μL、SYBR Green PCR Master Mix 10 μL、上游引物 0.5 μL(10 μmol/L)和下游引物 0.5 μL(10 μmol/L),总体积 15 μL,上机检测。循环反应为: 95 ℃ 15 s, 60 ℃ 15 s, 40个循环。每个样本设置3个复孔,以2-ΔΔCt法计算并分析mRNA的相对表达量。

表1 qPCR的引物序列
F: forward; R: reverse.
2.5Western blot检测MDSCs表面膜蛋白CD14和CD11b以及ARG1、IL-10和COX-2的表达 将经磁珠分选的细胞分别提取后,以2 mL PBS分别清洗,加入500 μL的裂解液和5 μL的PMSF,冰上裂解完全后在4 ℃下12 000 r/min离心10 min,上清液在-20 ℃下保存。经过BCA试剂盒(武汉博士德生物技术有限公司)进行蛋白定量后,用常规方法进行Western blot检测(CD14、CD11b、ARG1、IL-10和COX-2的 I 抗和 II 抗购于Abcam)。
2.6ELISA检测ARG1、IL-10和COX-2的含量 在上述提取的总蛋白上清液中取一半,按照ELISA试剂盒(武汉博士德生物技术有限公司)说明书的操作步骤检测ARG1、IL-10和COX-2的含量。
3 统计学处理
采用SPSS 17.0统计软件进行统计学分析。实验数据采用均数±标准差(mean±SD)表示。计量资料组间比较采用独立样本t检验分析,计数资料的组间比较采用χ2检验,以P<0.05为差异有统计学意义。
结 果
1 流式细胞术检测帕金森病患者与健康志愿者PBMC 中CD14+CD11b+和CD14-CD11b+细胞比例的差异
PD组PBMC中CD14+CD11b+细胞的比例与control组相比无明显变化,而CD14-CD11b+细胞的比例与control组相比显著增加(P<0.05),见表2。Western blot结果显示,2组细胞CD11b表达的差异无统计学显著性,而PD组的CD14表达显著高于对照组(P<0.05),见图1。
表2健康志愿者与帕金森病患者外周血2种MDSCs比例的比较
Table 2. The proportions of two kinds of MDSCs in control and PD groups (%. Mean±SD)
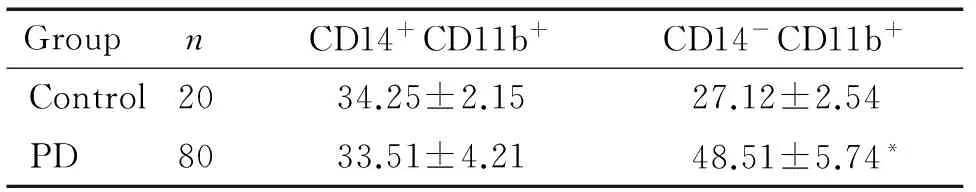
GroupnCD14+CD11b+CD14-CD11b+Control2034.25±2.1527.12±2.54PD8033.51±4.2148.51±5.74*
*P<0.05vscontrol group.
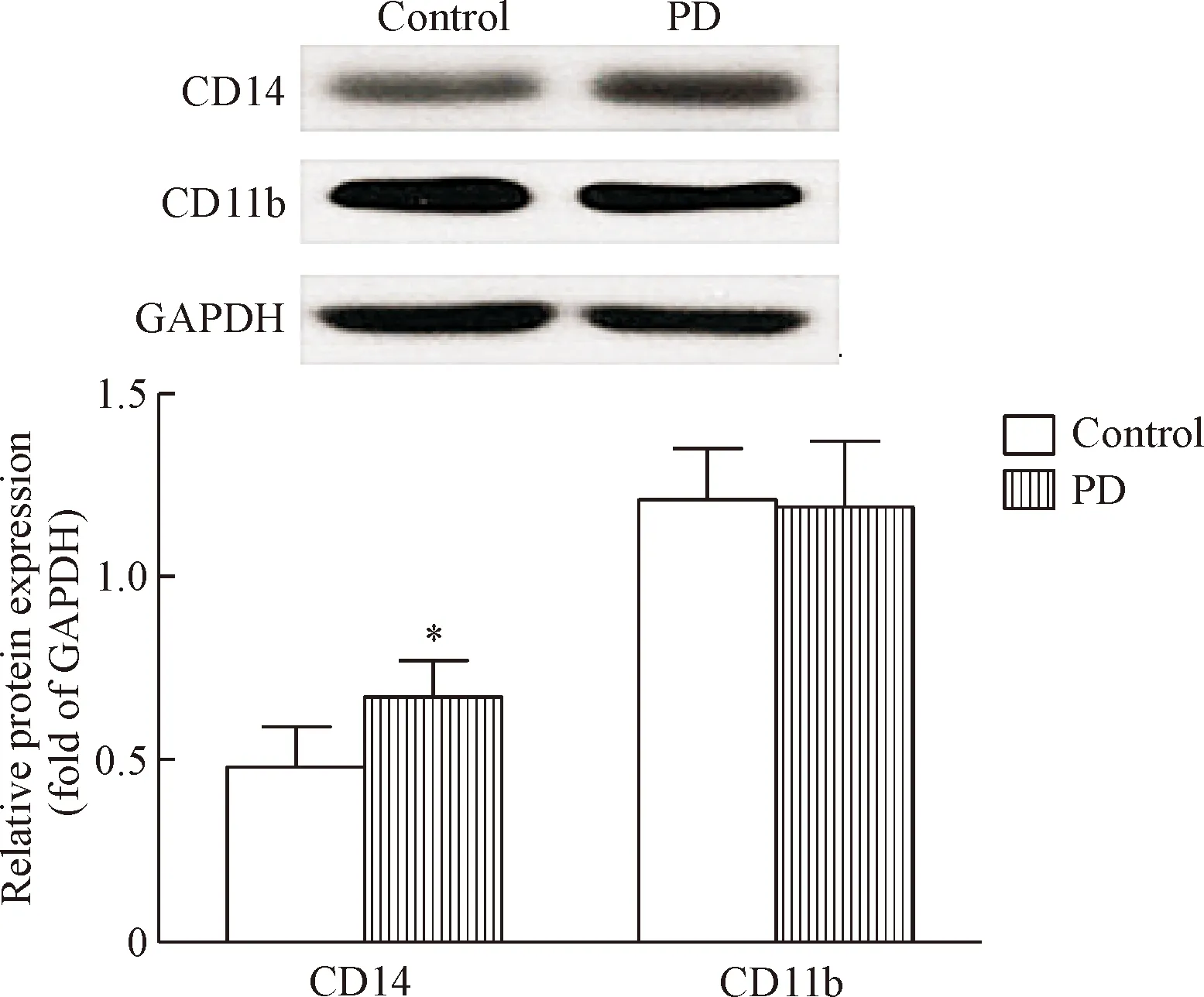
Figure 1. The protein expression of CD14 and CD11b on the cell surface. Mean±SD.n=3.*P<0.05vscontrol group.
图1细胞表面CD14和CD11b蛋白的表达
2 帕金森病患者外周血中CD14+CD11b+和CD14-CD11b+细胞的比例与Hoehn-Yahr分期的关系
按照Hoehn-Yahr法将80名患者进行分期,将患者流式细胞术的检测结果进行统计分析,其中2组间CD14+CD11b+细胞比例的差异无统计学显著性,与Hoehn-Yahr分期无关,而CD14-CD11b+细胞的比例随病情进展(分期增高)而增高,组间差异具有统计学显著性(P<0.05),见表3。
表3MDSCs的分类比例与Hoehn-Yahr分期的关系
Table 3. The relationship between the proportions of two kinds of MDSCs in control and PD groups and their stages of Hoehn-Yahr (%. Mean±SD)
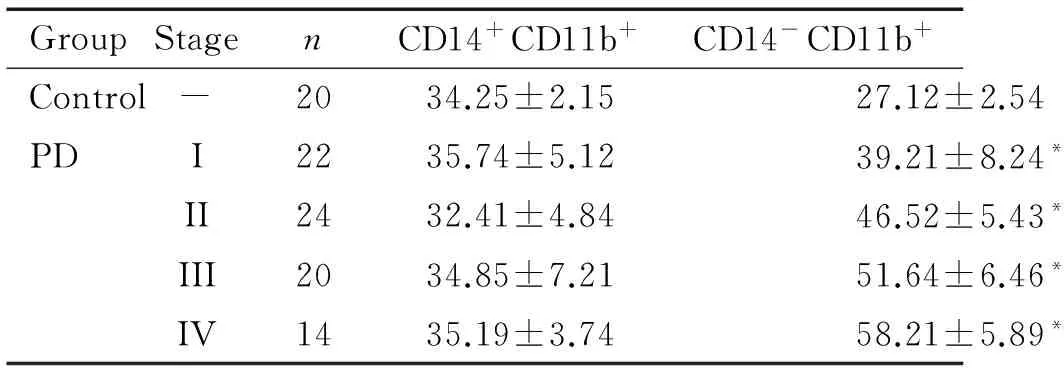
GroupStagenCD14+CD11b+CD14-CD11b+Control-2034.25±2.1527.12±2.54PDI2235.74±5.1239.21±8.24*II2432.41±4.8446.52±5.43*III2034.85±7.2151.64±6.46*IV1435.19±3.7458.21±5.89*
*P<0.05vscontrol group.
3 两群细胞ARG1、IL-10和COX-2的mRNA和蛋白表达水平的比较
通过磁珠分选得到CD14+CD11b+细胞和CD14-CD11b+细胞后提取总RNA,利用qPCR技术检测ARG1、IL-10和COX-2的mRNA表达水平,Western blot检测蛋白表达,以及ELISA法验证蛋白含量。结果显示,PD组的CD14-CD11b+细胞和CD14+CD11b+细胞共同高表达IL-10和COX-2,且与对照组的差异具有统计学意义(P<0.05),而PD组中仅CD14-CD11b+细胞高表达ARG1,与CD14+CD11b+细胞和control组比较差异有统计学意义(P<0.05),见表4、图2及表5。
表42群细胞ARG1、IL-10和COX-2的mRNA表达水平
Table 4. The mRNA expression levels of ARG1, IL-10 and COX-2 in the 2 kinds of MDSCs of control and PD groups (Mean±SD.n=3)
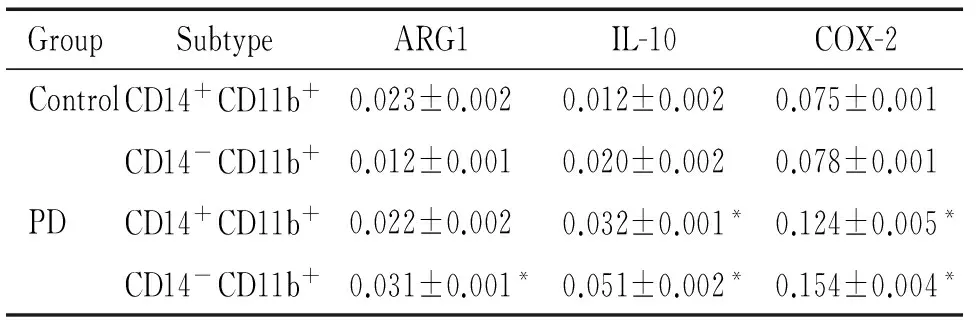
GroupSubtypeARG1IL-10COX-2ControlCD14+CD11b+0.023±0.0020.012±0.0020.075±0.001CD14-CD11b+0.012±0.0010.020±0.0020.078±0.001PDCD14+CD11b+0.022±0.0020.032±0.001*0.124±0.005*CD14-CD11b+0.031±0.001*0.051±0.002*0.154±0.004*
*P<0.05vscontrol group.
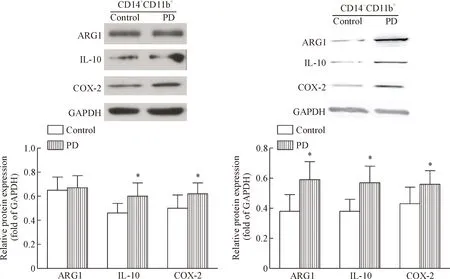
Figure 2. The protein expression levels of ARG1, IL-10 and COX-2 in 2 groups of cells. Mean±SD.n=3.*P<0.05vscontrol group.
图22群细胞ARG1、IL-10和COX-2的蛋白表达水平
表5ELISA法检测2群细胞ARG1、IL-10和COX-2的蛋白表达水平
Table 5. The protein levels of ARG1, IL-10 and COX-2 in the 2 kinds of MDSCs of control and PD groups measured by ELISA (ng/L. Mean±SD.n=3)
GroupSubtypeARG1IL-10COX-2ControlCD14+CD11b+8.50±0.4011.21±0.737.63±1.20CD14-CD11b+6.58±0.769.23±0.7310.13±1.23PDCD14+CD11b+8.80±0.8013.52±0.86*9.83±0.73*CD14-CD11b+8.87±1.20*11.85±0.73*14.85±0.93*
*P<0.05vscontrol group.
讨 论
传统意义上人们对于帕金森病发病原因的认识集中在中脑黑质多巴胺能神经元的变形缺失及路易小体形成,导致脑内神经递质多巴胺的减少,临床表现主要为运动障碍。而近年来最新研究发现,帕金森病患者中枢与外周的免疫失衡与发病有着重要的关联,其黑质纹状体中MPTP和脂多糖等免疫炎症指标呈现高表达,且黑质区还有异常聚集的T细胞,说明免疫炎症反应会引起机体免疫的失衡[5-6]。而抑制性免疫细胞作为免疫调节的一大家族,近年来关注度较高的为调节性T细胞和MDSCs,在以往的文献报道中已经证实了前者在帕金森病患者外周血中呈现异常高表达,所以免疫的抑制可能与炎症反应的发生和进展有着极大的促进作用[7-8],可以说免疫抑制是一种促进帕金森病发病和进程的高危因素。
MDSCs可以通过多种途径发挥免疫抑制的作用,主要通过抑制CD8+T细胞及诱导调节性T细胞的扩增来抑制机体免疫反应[9],在肿瘤的研究中已经明确了其促进肿瘤发生发展的作用,根据表面标志物的不同,可以分为单核系MDSCs(CD14-CD11b+)和粒系MDSCs(CD14+CD11b+)。有研究表明,单核系MDSCs对于免疫抑制的作用远远高于粒系MDSCs[10];MDSCs的免疫抑制作用是多样的,它不但可以直接抑制T细胞和NK细胞的增殖和分泌能力,还能通过抑制MHCII表达调节巨噬细胞的吞噬作用,由于MHCII和抗原复合物可以引起T细胞的特异性识别,而T细胞在识别表面抗原的同时还会释放淋巴因子刺激巨噬细胞的吞噬能力,所以MDSCs在抑制MHCII的同时也间接抑制了巨噬细胞的吞噬作用[11]。
但是对于免疫抑制来说,抑制性细胞的作用不是唯一的,一些关键的抑制性细胞因子的高表达同样可以引起免疫抑制反应[12],其中比较具有代表性的是ARG1、IL-10和COX-2,ARG1作为MDSCs中关键的调节酶,它的表达越高,L-精氨酸的含量就越低,同时就会导致过氧化物大量的产生,导致免疫炎症反应,而IL-10和COX-2同时可以参与炎症反应和免疫反应,是重要的免疫抑制因子[13-14],尤其是IL-10可以通过抑制CD28+T细胞的酪氨酸酶磷酸化来抑制T细胞的增殖。
MDSCs目前在帕金森病中的研究还未见专门报道,本研究发现,帕金森病患者外周血中2群MDSCs的比例是不同的,其中单核系所占的比例显著增高,而粒系的比例的差异未见统计学显著性,说明在帕金森病患者的发病中MDSCs确实起到了免疫抑制的作用,而此作用仅仅与单核系有关,由于单核系的免疫抑制作用远远高于粒系,所以对于帕金森病的发病起到了重要的作用,而深入的研究发现,单核系MDSCs在不同Hoehn-Yahr分期的患者中的比例是不同的,病情越严重、分期越高的患者,单核系所占的比例越高,组间差异存在统计学意义,而粒系不具备此种特点,这说明单核系MDSCs促进了帕金森病的进展,且它所占的比例可以间接反映出帕金森病患者的病情程度,在2群细胞中我们还检测了ARG1、IL-10和COX-2的mRNA表达水平,发现IL-10和COX-2在2群细胞中均呈现高表达,参考意义不大,而ARG1仅在单核系MDSCs中呈现高表达状态,这可以表明ARG1和单核系MDSCs有着密切的关系,两者共同作用于帕金森病的发生和发展,所以将ARG1和单核系MDSCs作为帕金森病发生发展的佐证指标是有一定的意义的。
综上所述,本研究表明单核系MDSCs在帕金森病患者外周血中比例升高,且与Hoehn-Yahr分期密切相关,同时单核系MDSCs中ARG1也呈现高表达,所以可以将两者结合作为帕金森病辅助诊断和分期的依据之一,但是局限于本研究病例数有限,还需要进一步扩大病例来验证。
[1] Jayaraj RL, Elangovan N, Dhanalakshmi C, et al. CNB-001, a novel pyrazole derivative mitigates motor impairments associated with neurodegeneration via suppression of neuroinflammatory and apoptotic response in experimental Parkinson’s disease mice[J]. Chem Biol Interact, 2014, 220:149-157.
[2] Yang G, Li H, Yao Y, et al. Treg/Th17 imbalance in malignant pleural effusion partially predicts poor prognosis[J]. Oncol Rep, 2015, 33(1):478-484.
[3] Pawlak CR, Chen FS, Wu FY, et al. Potential of D-cycloserine in thetreatment of behavioral and neuroinflammatory disorders in Parkinson’s disease and studies that need to be performed before clinical trials[J]. Kaohsiung J Med Sci, 2012, 28(8):407-417.
[4] Chen Y, Fang J, Chen X, et al. Effects of the Treg/Th17 cell balanceand their associated cytokines in patients with hepatitis B infection[J]. Exp Ther Med, 2015, 9(2): 573-578.
[5] Vivekanantham S, Shah S, Dewji R, et al. Neuroinflammation in Parkinson’s disease: role in neurodegeneration and tissue repair[J]. Int J Neurosci, 2014, 125(10):717-725.
[6] Hirsch EC, Vyas S, Hunot S. Neuroinflammation in Parkinson’s disease[J]. Parkinsonism Relat Disord, 2012,18(Suppl 1):S210-S212.
[7] 姜立刚, 慕振兴, 孙博谦. 帕金森病患者外周血 Th17/Treg 平衡及相关细胞因子水平测定及意义[J]. 中风与神经疾病杂志, 2016, 3(33):222-225.
[8] 罗 莎, 田小菲, 周懿舒, 等.SNCA和PARK16多态性与中国辽宁地区汉族帕金森病人的关联分析[J]. 中国病理生理杂志, 2012, 28(10):1879-1883.
[9] Almand B, Clark JI, Nikitina E, et al. Increased production of immature myeloid cells in cancer patients: a me-chanism of immunosuppression in cancer[J]. J Immunol, 2001, 166(1):678-689.
[10] Haile LA, Gamrekelashvili J, Manns MP, et al. CD49d is a new marker for distinct myeloid-derived suppressor cell subpopulations in mice[J]. J Immunol, 2010, 185(1):203-210.
[11] 邓婉萍, 孙君重. MDSCs的功能研究新发现[J]. 临床肿瘤学杂志, 2015, (5):474-477.
[12] Lees JR, Azimzadeh AM, Bromberg JS. Myeloid derived suppressor cells in transplantation[J]. Curr Opin Immunol, 2011, 23(5):692-697.
[13] 胡晓明. IL-10对肿瘤免疫的抑制[J]. 国外医学(免疫学分册), 2003, 26(2):107-110.
[14] 杨 燕, 李晓东, 季 枚, 等. COX-2/PGE2与肿瘤相关免疫细胞[J]. 临床检验杂志, 2016, 34(4):284-286.
